mapZ基因缺失对变异链球菌生长分裂及氯己定作用下生物膜形成能力的影响
乔 丹,李永亮,葛学军*
(1.山西医科大学口腔医学院 口腔医院,山西 太原 030001;2.北京大学口腔医学院 口腔医院,北京 100081)
龋病是影响人类口腔健康的最常见疾病之一,是以细菌为主的多种因素影响下,牙体硬组织发生的慢性破坏性疾病[1-2]。变异链球菌(Streptococcusmutans)是目前公认的龋病主要致病菌,可以利用蔗糖等碳水化合物形成细胞外多糖基质,包裹细菌黏附并定殖于牙齿表面形成牙菌斑生物膜[3-4]。细菌在这种生物膜基质保护下代谢碳水化合物产酸并逃避唾液冲刷和外界刺激,进而造成牙体组织脱矿形成龋坏[4-5]。因此,研究变异链球菌的生理调节过程,理解其中的作用机制,寻找潜在的药物作用靶点,将会为研发新型的抗龋药物提供参考。细胞分裂是细菌繁殖及黏附定殖的基础,通过不断分裂增加细菌数量从而帮助在其生态位上定殖,形成生物膜[6]。因此,细胞分裂和生物膜形成密不可分。细菌的二分裂是胞质分裂的重要生命过程,FtsZ是分裂过程中的核心骨架蛋白,可以在胞质分裂位点处组装并形成环形结构—Z ring,启动胞质分裂[7-9]。正确的分裂过程确保子细胞基因组完整性和正常细胞形态,该过程看似简单,其实是一个多基因参与调控的过程[10-12]。Z ring定位错误,染色体在分离完成之前开始细胞分裂,导致细胞不均等分裂[10,13]。跨膜蛋白MapZ在链球菌属中保守,是近年来在链球菌属中发现的一种FtsZ调控机制[14]。链球菌MapZ比FtsZ更早定位于链球菌分裂位点,调控FtsZ准确定位于分裂位点处并参与细胞分裂位点处隔膜的形成,进而启动胞质分裂[13]。北京大学口腔医院李永亮博士课题组[15]前期通过同源重组技术成功构建了变异链球菌mapZ基因缺失突变菌株ΔsmmapZ,经过多次传代和PCR技术鉴定该突变株能稳定传代。前期研究发现变异链球菌跨膜蛋白MapZ可以对FtsZ的运动路径进行限制和引导,从而保证FtsZ的准确定位。但变异链球菌mapZ基因缺失是否会影响变异链球菌其他生理过程,仍不清楚。在此基础上,本研究利用mapZ基因缺失突变菌株,研究mapZ基因缺失对变异链球菌细胞生长分裂、分裂基因ftsZ的相对表达量以及在口腔常用抑菌药物氯己定存在下形成生物膜能力等生理过程的影响,探讨mapZ在抗龋药物开发中作为潜在作用靶点的可能性。
1 材料与方法
1.1 材料
1.1.1 菌种来源 变异链球菌(Streptococcusmutans)标准株UA159、mapZ基因突变菌株ΔsmmapZ以及mapZ回复株mapZ+,均由北京大学口腔医院中心实验室惠赠。突变株ΔsmmapZ由课题组前期制备,具体方法如下[15]:①在NCBI上找到UA159mapZ上下游各2 kbp的序列,根据这段序列分别设计上游和下游引物,扩增出800~1 000 bp DNA片段。②利用融合PCR将①中上下游片段与IFDC2片段融合。③将融合产物转化入UA159中,用红霉素抗性BHI平板筛选出smmapZ基因敲除菌,但此时菌株在mapZ基因处残留IFDC2片段。④再次按照①步骤扩增上、下游片段,将两片段融合。⑤将④中片段再次转化入③中mapZ基因敲除菌,用带有p-Cl-phe的BHI板筛选,最终得到mapZ基因敲除且不含IFDC2的突变株。
1.1.2 培养基 ①BHI液体培养基:称取3.7 g脑浸心肉汤粉剂溶解于100 mL MiliQ水中,121 ℃高压灭菌15 min后在4 ℃冰箱保存;②BHIS(1%蔗糖)液体培养基:称取3.7 g脑浸心肉汤粉剂和1 g蔗糖粉末溶解于100 mL MiliQ水中,121 ℃高压灭菌15 min后在4 ℃冰箱保存;③BHI固体培养基:称取3.7 g脑浸心肉汤粉剂溶于100 mL MiliQ水中,混匀溶解后加入7.5 g琼脂粉,121 ℃高压灭菌15 min后,冷却至 50 ℃左右后倒入一次性培养皿中,在超净台中放置 30 min,充分凝固后密封培养皿口倒置于 4 ℃冰箱保存;④THY液体培养基(每100 mL):THB粉末3 g,酵母提取物粉末0.3 g,四环素粉末2.5 mg,ZnCl2溶液(储存液浓度为0.2 mol/L)100 μL,MiliQ水溶液100 mL;⑤THY固体培养基:THB粉末3 g,酵母提取物粉末0.3 g,四环素粉末2.5 mg,琼脂粉2 g;MiliQ水溶液100 mL。
1.1.3 试剂与仪器 0.1%结晶紫溶液(索莱宝,中国);RNA提取试剂盒(康为世纪,中国);逆转录试剂(东洋纺,日本)。电子扫描电镜(830.10U3,日本日立);酶标仪(EL808,美国伯腾公司);实时荧光定量PCR仪(7500,美国赛默飞世尔);恒温混匀仪(ThermoMixer C,德国艾本德);核酸蛋白分析仪(NanoDrop 8000,美国赛默飞世尔);离心机(5430,德国 艾本德);漩涡混匀仪(VORTEXZ,德国艾卡);水平摇床(WD-9405B,中国沃德生物医学仪器公司);二氧化碳孵箱(Heraeus HERAcel,美国赛默飞世尔);生物安全柜(1300A2,美国赛默飞世尔)。
1.2 方法
1.2.1 菌株的复苏 变异链球菌标准株UA159、ΔsmmapZ复苏于BHI固体培养基,mapZ+复苏于THY(含2.5 μg/mL四环素)固体培养基后,37 ℃、5% CO2孵箱中培养48 h,经菌落形态学和细胞形态学鉴定为变异链球菌。将变异链球菌单菌落过夜培养,次日菌液以1∶100分别接种于BHI和THY(含2.5 μg/mL四环素和0.2 mmol/L ZnCl2)液体培养基,孵育到对数期,调整有效活菌数为108cfu/mL备用。
1.2.2 扫描电镜(SEM)观察变异链球菌标准株UA159、ΔsmmapZ菌细胞形态及生长分裂差异 菌液和BHIS(含1%蔗糖)液体培养基以1∶100置入加有无菌硅片的24孔板内,37 ℃、5% CO2孵箱中培养24 h后将硅片移至新孔,冲洗,2.5%戊二醛固定4 h(固定温度4 ℃),梯度脱水(50%、70%、80%、90%、100%乙醇),室温下自然干燥,喷金,SEM下观察。
1.2.3 变异链球菌标准株UA159和突变株ΔsmmapZ以及回复株mapZ+的ftsZ基因相对表达量测定 变异链球菌各菌株总RNA的提取:取对数期菌液各10 mL,在4 ℃条件下12 000 r/min离心4 min后,PBS重悬2次,再次离心(离心条件同前)。在菌沉淀中加入100 μL溶菌酶(20 mg/mL),混匀后37 ℃恒温混匀仪孵育1 h破壁。依照细菌RNA提取试剂盒说明书提取细菌总RNA,提取操作均在生物安全柜中进行(离心均在4 ℃条件下),步骤如下:①破壁后的菌液加入350 μL Buffer RL缓冲液,涡旋振荡后全部加入过滤柱Spin Columns FL中,12 000 r/min离心2 min;②向①中得到的滤液中加250 μL无水乙醇,混匀后转移到吸附柱Spin Columns RM,12 000 r/min离心1 min,吸掉废液,重新将柱放回收集管中;③吸附柱中加入350 μL RW1buffer缓冲液,其余步骤同②;④吸附柱中加入80 μL DNaseI混合液,20~30 ℃孵育15 min;⑤重复步骤③;⑥吸附柱加入500 μL RW2缓冲液,12 000 r/min离心1 min弃废液;⑦重复步骤⑥后继续12 000 r/min, 离心2 min;⑧50 μL RNase-free water洗脱,12 000 r/min离心1 min,收集RNA溶液,Nanodrop 8000检测质量及浓度,-80 ℃保存。变异链球菌RNA逆转录为CDNA:依照ReverTra Ace qPCR RT Master Mix试剂盒说明书步骤将RNA反转录为cDNA,操作步骤如下:①RNA在65 ℃条件下热变性5 min后,立即置于冰上冷却;②在冰上配制如下反应液(10 μL体系):5×RT Master Mix 2 μL、RNA template 5 μL、Nuclease-free Water 3 μL;③在PCR仪设定逆转录程序:37 ℃ 15 min,50 ℃ 5 min,98 ℃ 5 min,4 ℃保持;④逆转录完成后,cDNA于-20 ℃保存备用。real-time PCR检测变异链球菌分裂基因ftsZ的相对表达量:Primer5软件设计最优引物(表1),实时定量荧光PCR仪检测菌株ftsZ基因的相对表达含量,16S rRNA作为内参照。PCR反应体系(20 μL):①Starlighter SYBR Green qPCR Mix 10 μL、正反向引物各1 μL、ROX 0.4 μL、cDNA 1 μL、Nuclease-free Water 6.6 μL; ②运行程序:95 ℃ 3 min、95 ℃ 30 s、60 ℃ 20 s,扩增循环设为35个循环。real-time PCR扩增完成后分析溶解曲线,2-ΔΔCt对样本进行相对定量。SPSS 23.0进行数据输入和CT值统计分析。

表1 引物序列
1.2.4 最小抑菌浓度(MIC)的测定及不同氯己定(CHX)药物浓度下变异链球菌生物膜的形成 二倍稀释法测定药物MIC:于96孔板各孔中加入50 μL BHIS(含1%蔗糖)液体培养基,在第1孔中加入50 μL CHX(4 mg/mL),充分混匀后,各取50 μL加到下一孔,以此类推,第6孔取50 μL弃去。调整变异链球菌UA159、ΔsmmapZ浓度为104cfu/mL,于各孔中加50 μL菌液,使每孔最终药物质量浓度分别为1.000 00、0.500 00、0.250 00、0.125 00、0.062 50、0.031 25 μg/mL。CO2孵箱培养过夜,次日观察每孔的浑浊程度,以肉眼看不到浑浊的最小浓度为最小抑菌浓度(MIC)。结晶紫检测不同CHX药物浓度下变异链球菌生物膜的形成:在二倍稀释法测定药物MIC(即在CHX药物浓度为1.000 00、0.500 00、0.250 00、0.125 00、0.062 50、0.031 25 μg/mL条件下培养变异链球菌)的实验基础上,CO2孵箱培养过夜,待形成生物膜后,先测菌液的OD630值,记录数据,然后吸走菌液,PBS缓慢冲洗3次,晾干,每孔加入50 μL结晶紫(0.1%,质量分数)染色15 min,弃废液,PBS再次缓慢冲洗3次,晾干后观察生物膜的染色情况。
1.2.5 统计学分析 所有实验重复3次,每次设3个平行对照实验。采用SPSS 23.0软件进行统学计分析,两组数据间比较采用t检验,以P<0.05为差异具有统计学意义。
2 结果与分析
2.1 变异链球菌标准株UA159、ΔsmmapZ扫描电镜结果
利用扫描电镜对UA159和ΔsmmapZ基因缺失突变株进行形态学观察,野生株呈现类杆状形态(图1c),分离隔膜处于菌细胞的正中位置(图1d白色实线)。但是ΔsmmapZ细胞形态变的短圆,呈短链状(图1a),并且胞质分裂不均匀且分裂隔膜位置偏离正中(图1b白色实线和箭头所示),分裂隔膜位置偏离细菌正中位置(图1)。这与前期的研究结果相似,证实了mapZ基因对细胞生长分裂的影响[10,13-14]。

图1 ΔsmmapZ、UA159扫描电镜(SEM)图
2.2 分裂基因ftsZ的相对表达量
采用实时定量荧光PCR对ftsZ的表达量进行分析,结果显示,ΔsmmapZ株中,ftsZ表达量相较UA159下降了四分之一(P<0.01),有显著性差异。在回复株mapZ+中发现,虽然ftsZ的表达量低于野生株,但相对于ΔsmmapZ株ftsZ的表达量有显著恢复(P<0.05),差异有统计学意义(图2)。虽然在回复株中ftsZ表达量并未完全恢复到与野生株UA159一致的水平,但这对Li等[15]的实验中回复株恢复野生株形态是足够的。
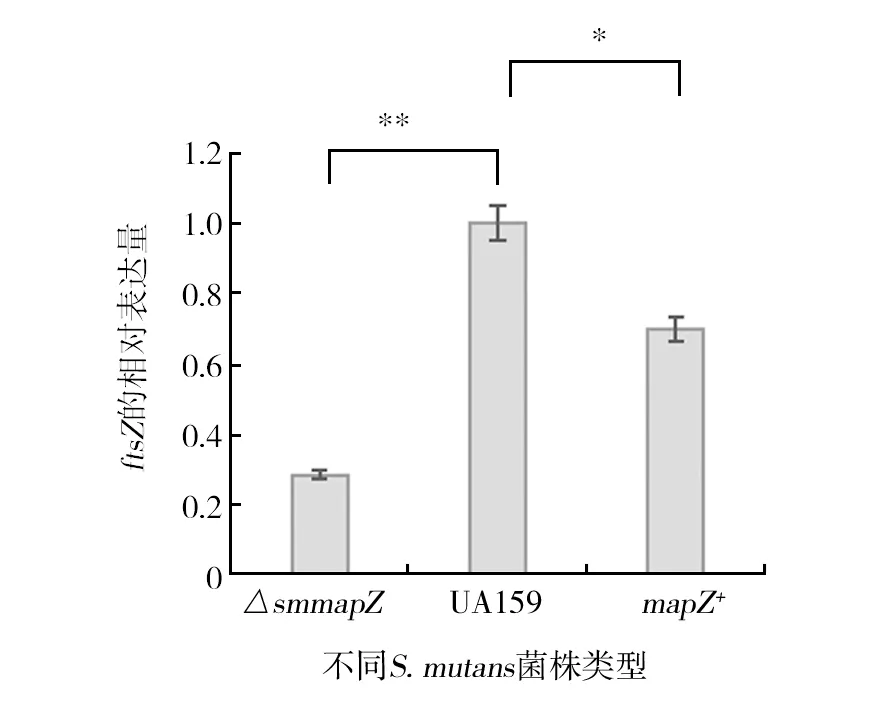
图2 S.mutans各菌株相关分裂基因ftsZ的相对表达含量
2.3 最小抑菌浓度测定及不同质量浓度CHX下生物膜的形成
2.3.1 最小抑菌浓度(MIC) 通过测定UA159与ΔsmmapZ对CHX的最小抑菌浓度,发现UA159的MIC为0.250 00 μg/mL,而ΔsmmapZ的MIC则为0.125 00 μg/mL。
2.3.2 不同质量浓度CHX下生物膜的形成 变异链球菌ΔsmmapZ在CHX质量浓度为0.062 50和0.031 25 μg/mL的情况下虽然可以形成生物膜,但浮游菌的数量仍比UA159少(图3a),这两组OD630值相比,P<0.05,差异有统计学意义;UA159在CHX质量浓度为0.125 00、0.062 50及0.031 25 μg/mL均可以形成生物膜(被结晶紫染色的即为有生物膜形成),而ΔsmmapZ只在0.062 50以及0.031 25 μg/mL质量浓度条件下形成生物膜,当CHX质量浓度为0.125 00 μg/mL则无法形成生物膜(图3b)。
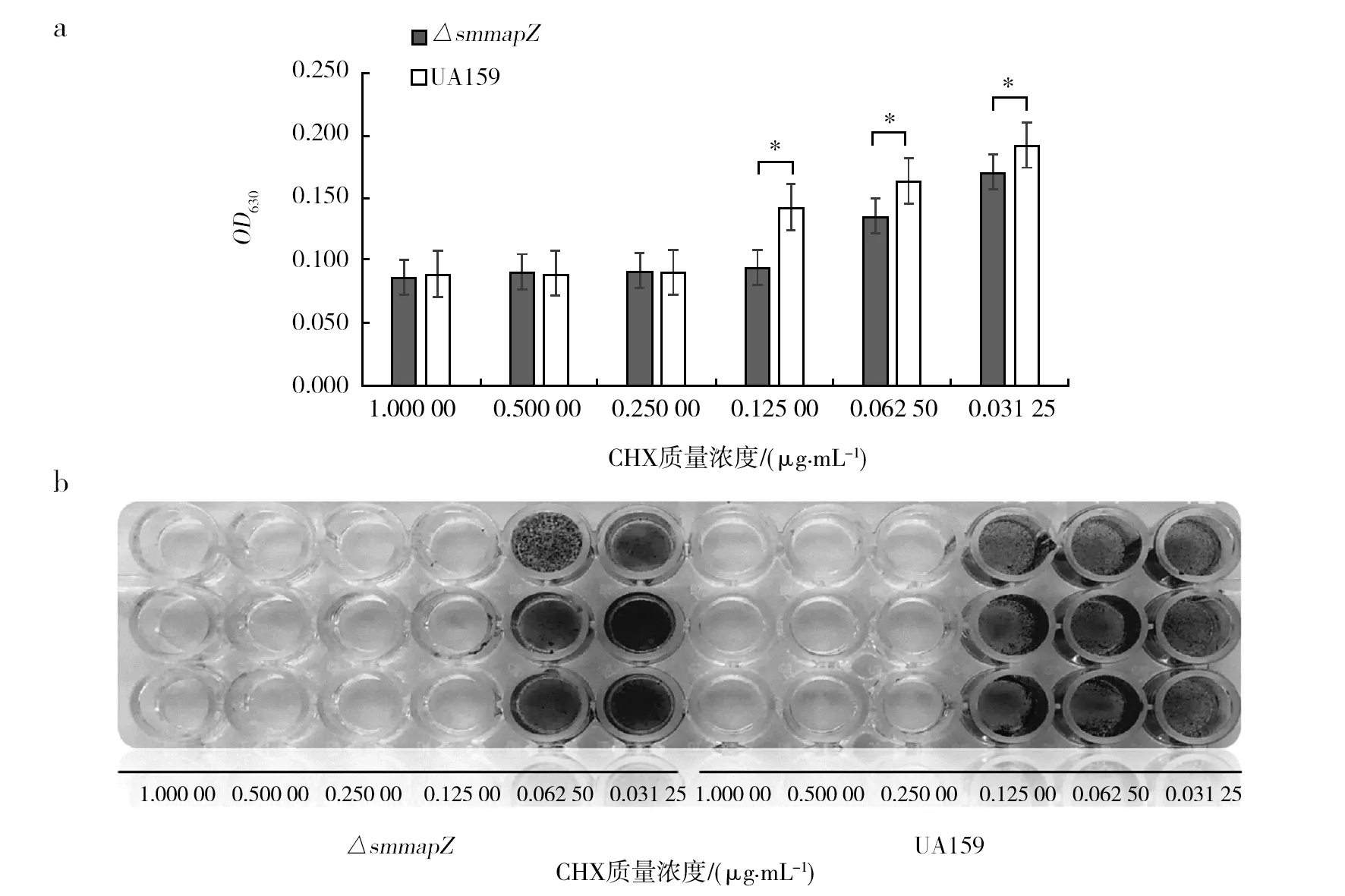
图3 UA159、ΔsmmapZ在不同CHX质量浓度下的生长及生物膜形成情况
3 讨 论
变异链球菌是公认的致龋菌,其致龋性与形成强健生物膜、产酸、耐酸性等有关[5]。细菌胞质分裂过程对于变形链球菌生长、增殖以及形成生物膜至关重要,是潜在的抗龋药物研发作用靶点。MapZ是近年来发现链球菌中主要的FtsZ调控机制。MapZ作为FtsZ定位Z ring的准确信号,决定分裂隔膜的形成位置和分裂位点,Z ring在错误位置形成会导致细胞不均等分裂[13]。Zring定位错误,导致染色体在分离完成之前开始细胞分裂,最终导致隔膜损坏染色体, 大大影响细菌的生长繁殖[10]。
有学者利用电子显微镜和荧光显微镜首先在肺炎链球菌中,观察到了MapZ缺失会导致肺炎链菌球菌细胞大小以及分裂隔膜微观结构的改变[13]。随后,Li等[15]在敲除变异链球菌的mapZ基因后,通过荧光显微镜观察到mapZ基因的缺失同样也会导致变异链球菌细胞大小发生改变(有迷你细胞形成),但未对细菌细胞表面的超微结构变化进行观察。本研究利用扫描电镜观察到变异链球菌mapZ基因缺失后,变异链球菌变为短链状,分裂不均等。这进一步证明了MapZ在变异链球菌中对分裂隔膜定位的影响。骨架蛋白FtsZ的空间定位直接决定了分裂隔膜的定位,mapZ缺失会影响FtsZ空间定位,但是否会影响ftsZ的表达仍不清楚。本研究通过实时定量PCR技术发现,mapZ基因缺失后变异链球菌中ftsZ的表达量下降,在回复株mapZ+(外源表达mapZ)中ftsZ表达量明显上升,但是仍未恢复到野生株水平。Holeǒková等[14]的研究表明,外源表达的MapZ(也称locZ)表达量低于野生株中内源MapZ,但是外源表达的MapZ已经足够回复株恢复野生株的表型。因此推测回复株中ftsZ的表达量较低是由于突变株mapZ表达量低于野生株,这进一步说明了mapZ对ftsZ有正反馈调控作用。
形成菌斑生物膜是变异链球菌的主要致龋特点,在有蔗糖存在的情况下,变异链球菌可以代谢蔗糖形成胞外基质,从而形成强健的生物膜附着于牙齿表面[16-17]。变异链球菌对口腔中复杂环境的耐受性较强,依靠菌斑生物膜在口腔中持久发挥作用[18]。CHX是口腔常用抑菌剂,作为广谱抑菌杀菌剂长达30多年[19]。CHX可以吸附在细菌胞浆膜的渗透屏障,使内容物泄露,在低浓度时呈抑菌作用,高浓度时呈杀菌作用,对革兰阳性菌杀灭效果更佳。但CHX长期使用对人体细胞具有毒性且会造成味觉变化和口腔染色问题,因此通过其他方式降低CHX工作浓度尤为重要[20]。本研究发现MapZ缺失可以降低CHX的MIC,这可能是由于变异链球菌在失去mapZ基因调控后,Z ring位置紊乱造成细菌细胞分裂隔膜位置紊乱、胞质分裂不均致使子细胞细胞膜组分改变,在受到带正电的CHX阳离子刺激后,细胞膜通透性改变无法及时做出相应快速的防御反应而造成细菌细胞胞膜和胞质不可逆损伤而死亡[21]。提示变异链球菌敲除mapZ后对药物耐受性降低导致形成生物膜能力下降,这对降低CHX在口腔治疗中用药的工作浓度具有参考意义。
本研究只描述了缺失mapZ后变异链球菌细胞分裂隔膜的位置和细胞形态大小变化,关于隔膜位置的细胞壁如何变化以及细胞壁对细胞膜的影响未进行深入研究。研究中发现,mapZ缺失可以降低变异链球菌对CHX的耐受性和形成生物膜的能力,但对具体分子机制也未进行深入研究。
变异链球菌敲除mapZ基因后对细菌细胞生长形态、分裂隔膜,以及在氯己定药物作用下成膜能力均有影响。MapZ有望作为新型抗龋药物的靶点。

