红色诺卡氏菌Nr-8206株培养形态与其有效物质及杂质关系分析
王 丹,闫泉香,章朦玥,薛金艳,窦 恒,王 琳,张怡轩*
(1.沈阳药科大学 生命科学与生物制药学院,辽宁 沈阳 110016;2.辽宁格瑞仕特生物制药有限公司,辽宁 本溪 117004;3.沈阳广播电视大学,辽宁 沈阳 110003)
在全球范围内,每年约有50余万例新发宫颈癌患者,约有20多万女性死于宫颈癌。据国际癌症研究机构2018癌症发病率和死亡率数据报告显示,在女性中,宫颈癌的发病率和死亡率均排名第四[1],是危害女性生命健康的主要因素之一。随着我国“两癌”筛查的大力推广及宫颈癌普治工作的开展,发现农村经济落后地区是我国宫颈癌防治的重点,但是城市女性宫颈癌的防治形势也不容乐观[2]。因此为解决女性痛苦,寻求一种价格低、疗效好的预防及治疗药物就显得尤为迫切。红色诺卡氏菌为好氧菌,革兰染色阳性,属于放线菌[3]的一种。红色诺卡氏菌Nr-8206株主要的有效成分为组成其细胞壁的多糖、胞壁酸和黏肽等。辽宁格瑞仕特生物制药有限公司生产的外用红色诺卡氏菌细胞壁骨架冻干粉制剂,以菌株Nr-8206作为生产菌株,经发酵传代获得菌体,其菌体经破碎、化学提取后进一步精制加工制得。外用红色诺卡氏菌细胞壁骨架,是一种非特异性免疫调节剂,能够提高免疫细胞CD4+T淋巴细胞[4]、CD8+T淋巴细胞[5]、巨噬细胞[6]及自然杀伤细胞[7]的活化作用和增殖促进作用,从而调节人体自身免疫系统,增强宫颈局部免疫功能,可有效清除HPV感染、治疗宫颈癌前病变,预防宫颈癌[8],临床治疗效果良好[9-10]。目前,菌株Nr-8206的不同培养形态对其生物量、有效物质的含量及其杂质残留量的影响尚无相关研究。本研究拟通过筛选红色诺卡氏菌株Nr-8206的不同菌株培养形态,结合不同形态生物量,研究不同形态与其有效物质及杂质之间的关系,筛选出最佳的培养形态。为企业提供高产菌株菌体及有效物质产率,从而提升产品的产量及质量,能够给全国乃至全球女性带来福音,具有广泛的社会意义。
1 材料与方法
1.1 材料
1.1.1 菌种来源 红色诺卡氏菌菌株Nr-8206(NocardiarubraNr-8206),由辽宁格瑞仕特生物制药有限公司提供。
1.1.2 培养基 ①甘油琼脂培养基:琼脂20 g,蛋白胨10 g,牛肉膏5 g,氯化钠5 g,磷酸氢二钠0.3 g,甘油10 mL,pH 7.2~7.5,溶于1 000 mL蒸馏水中;②肉汤培养基:蛋白胨10 g,牛肉膏5 g,氯化钠5 g,磷酸氢二钠0.3 g,甘油10 mL,pH 7.2~7.5,溶于1 000 mL蒸馏水中。
1.1.3 试剂与仪器 阿拉伯糖对照品(WXBB6540V,SIGMA);胞壁酸对照品(WXBB8072V,SIGMA);血清白蛋白(牛)对照品(140619-201622,中国食品药品检定研究院);牛肉膏、蛋白胨(北京奥博星生物技术有限责任公司);其他试剂均购自国药集团化学试剂有限公司。电子天平(JA203,上海海康电子仪器厂);自动电热压力蒸汽灭菌器(LDZX-40SBI,上海申安医疗器械厂);双人单面超净工作台(SW-CJ-ZD,苏州净化设备有限公司);电热恒温鼓风干燥箱(DGG-9070A,上海森新试验仪器有限公司);全温振荡培养箱(HZL-F160,江苏太仓华大实验仪器科技有限公司);台式离心机(TGL-16B,上海安亭科学仪器厂);光学显微镜(XSP-C204,重庆光电仪器有限公司);紫外-可见分光光度计(UV-2600,岛津仪器有限公司)。
1.2 方法
1.2.1 菌株复壮培养形态的分离筛选 甘油琼脂培养基经121 ℃,30 min灭菌处理后,制成甘油琼脂培养基平板。在超净工作台中,取一支菌株Nr-8206冻干管,加入300 μL无菌蒸馏水复溶,制成菌悬液,分别涂布[11]于3个平行平板,33 ℃恒温培养8 d;依据菌落直径大小,将所有单菌落分为小菌落(直径0~1.0 mm)、中菌落(直径1.0~2.0 mm)、大菌落(直径2.0 mm以上)三类,在每一类中选取一个典型形态单菌落,分别编号为RY1、RY2、RY3。分别挑取RY1、RY2、RY3单菌落划线,将菌株Nr-8206菌落(出发菌株)无菌蒸馏水溶解挑一环划线,分别传代至甘油琼脂培养基平板上,每个菌落3个平行,33 ℃培养4 d后,用适量无菌蒸馏水悬浮菌体,5 000 r/min离心3 min,弃上清,称重,分别配制成100 mg/mL菌悬液,每管加入200 μL该菌悬液制成一个甘油保藏管,-20 ℃保存,用于后续试验。
1.2.2 插片法美蓝染色形态观察 将分离出的单菌落分别接种于甘油琼脂培养基上并插片,33 ℃恒温倒置培养4 d后,美蓝染色制片于XSP-C204型光学显微镜下观察其形态结构特征。
1.2.3 菌株生理生化特征 针对菌株Nr-8206的特性,设计碳氮源利用试验、MR试验、V-P试验、色氨酸分解试验、硫化氢产生试验以及牛奶凝固与胨化、明胶液化、纤维素分解、淀粉水解、硝酸盐还原、脲酶、淀粉酶和酯酶等生理生化试验[12],采用Shirling等[13]方法进行实验并观察记录。
1.2.4 菌体生物量分析 将配制的甘油琼脂培养基分装于试管中,121 ℃灭菌30 min后制成试管斜面备用。以菌株Nr-8206(出发菌株)作为对照,分别将对照菌株及不同形态菌株在甘油琼脂培养基平板划线传代,分别挑取大小相同的单菌落接种于试管斜面上,每个菌落接种3个试管斜面,33 ℃培养4 d后,10 mL无菌水清洗菌体,分别转移至液体培养基(肉汤培养基,每个三角瓶150 mL)中,150 r/min,33 ℃培养4 d,3 000 r/min离心15 min。收集菌体,测定湿菌体含量(g/mL)。
1.2.5 有效物质及杂质测定 ①原液的获得:取分离筛选时保藏的菌株Nr-8206(出发菌株)、RY1、RY2、RY3甘油管各一支,分别接种于1个试管斜面(甘油琼脂培养基),33 ℃培养4 d,每个试管斜面对应转入1个克氏瓶内(甘油琼脂培养基),继续培养4 d,再分别转入三角瓶内(肉汤培养基)培养4 d增菌,弃去上清液,加无菌蒸馏水约100 mL,制备成菌悬液。吸取菌悬液加入克氏瓶内(每瓶加入5 mL),RY1、RY2、RY3各接种20个克氏瓶,33 ℃培养5 d,在超净台下,克氏瓶内加少许无菌蒸馏水,刮洗收集菌苔,其菌悬液于3 060 r/min离心10 min,弃上清液,称湿菌体质量,按湿菌体与无菌蒸馏水的质量比1∶4配制成菌悬液,超声波破碎至显微观察无活菌,获得产物加入链蛋白酶溶液(0.53 mg/mL)和胰蛋白酶溶液(8 mg/mL)联合作用12 h,16 000 r/min离心30 min,反复清洗离心3次,除去蛋白质,除杂后称干质量,加无菌蒸馏水将原液配制成50 mg/mL的溶液。②原液多糖含量测定[14]:分别配制20、40、50、60、80、100 μg/mL阿拉伯糖对照品工作液,纯化水作空白对照,在水浴冷却条件下,分别加入2%(质量分数)蒽酮乙酸乙酯溶液0.25 mL、浓硫酸2.0 mL,摇匀,80 ℃水浴30 min,水冷却至室温,625 nm波长处测定吸光度值,以吸光度为纵坐标(y),阿拉伯糖浓度为横坐标(x),绘制标准曲线y=0.005 03x-0.026 84,r2=0.992 7。取原液10 μL,加纯化水稀释至1.0 mL置于一具塞试管中,与对照品工作液同法处理,625 nm波长处测定菌株Nr-8206、RY1、RY2、RY3原液浓度,每个样品测定3份,通过计算获得糖含量。计算公式:原液糖含量(mg/mL)=原液浓度×原液稀释倍数/1 000。③原液胞壁酸含量测定:分别配制0.63、1.25、2.50、5.00、10.00、15.00、20.00 μg/mL胞壁酸对照品工作液,纯化水作空白对照,分别加入4%硫酸铜溶液100 μL,振荡20 s,加入6 mL浓硫酸,振荡20 s混匀,100 ℃水浴10 min,水冷却至室温,加入100 μL 1.5%对羟基联苯溶液,立即振荡20 s混匀。25 ℃水浴呈色30 min后,100 ℃水浴90 s使溶液澄清。564 nm波长处测定吸光度值,以吸光度为纵坐标(y),以胞壁酸浓度为横坐标(x),绘制标准曲线y=0.015 38x-0.001 35,r2=0.999 3。取原液20 μL,加水使其最终体积为1.0 mL至一具塞试管中,与对照品工作液同样处理,564 nm波长处测定菌株Nr-8206、RY1、RY2、RY3原液浓度,每个样品测定3份,计算获得胞壁酸含量,计算公式:胞壁酸含量(μg/mL)=原液浓度×原液稀释倍数。④原液蛋白质残余量测定:分别配制20、40、60、80、100 μg/mL血清白蛋白(牛)对照品工作液,纯化水作空白对照,分别加碱性铜试液1.0 mL,摇匀,室温放置10 min,快速加入福林酚试液4.0 mL,摇匀,室温放置30 min。650 nm波长处测定吸光度值,以吸光度为纵坐标(y),以血清白蛋白(牛)浓度为横坐标(x),绘制标准曲线y=0.000 15x-0.002 83,r2=0.997 0。取原液50 μL(稀释倍数为20倍)置试管内,加水至1 mL,与对照品工作液同样处理,650 nm波长处测定菌株Nr-8206、RY1、RY2、RY3原液浓度,每个样品测定3份,计算蛋白质含量,计算公式:
式中:原液浓度单位为μg/mL;原液稀释倍数为20倍;原液固体总量(g/mL)=烘干后样品质量/样品体积×100%(105 ℃烘干至恒质量);两个103(即106)为原液浓度(μg/mL)与固体总量的单位换算。
2 结果与分析
2.1 菌株复壮培养形态的分离筛选
通过对菌株Nr-8206进行复壮培养(图1)和形态统计,小菌落(直径0~1.0 mm)占比3.63%,中菌落(直径1.0~2.0 mm)占比58.10%,大菌落(直径2.0 mm以上)占比38.27%。小、中、大菌落中各选出1个,共选出3个典型形态(图2),分别编号为RY1(图2A)、RY2(图2B)、RY3(图2C)。RY1菌落直径0.60 mm,淡黄色,突起不明显,无褶皱,圆形;RY2菌落直径1.68 mm,橘色,有突起,有褶皱,菌落边缘呈丝状;RY3菌落直径2.56 mm,橘红色,有突起,有褶皱,菌落边缘呈放射状。
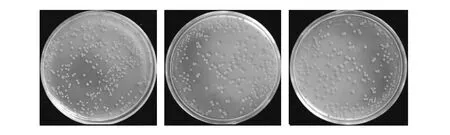
图1 红色诺卡氏菌Nr-8206株在3个平行甘油琼脂培养基上培养8 d的形态
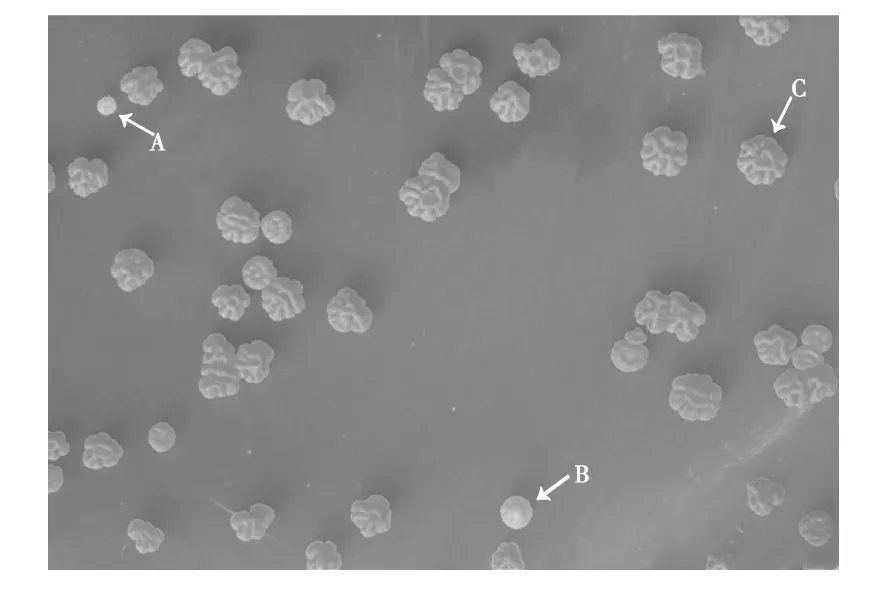
图2 红色诺卡氏菌Nr-8206株在甘油琼脂培养基上培养8 d挑选出的单菌落形态
2.2 菌体形态
将RY1、RY2、RY3分别接种于甘油琼脂培养基上并插片,33 ℃培养4 d后,美蓝染色光学显微镜下放大1 000倍观察其结构特征(图3),RY1(图3A)菌体球状或短杆状有横膈膜,RY2(图3B)菌体呈球状或短杆状有横隔膜,RY3(图3C)菌体见分支状,可见明显横膈膜,菌体大部分为长链(或杆)状。三种形态的菌体在显微镜下观察,横径无明显差别,说明遗传稳定性高。RY1(图3A)、RY2(图3B)结构无明显差别,RY3(图3C)菌体见分支状且多长链(或杆),说明三种形态可能处于不同的生长期。
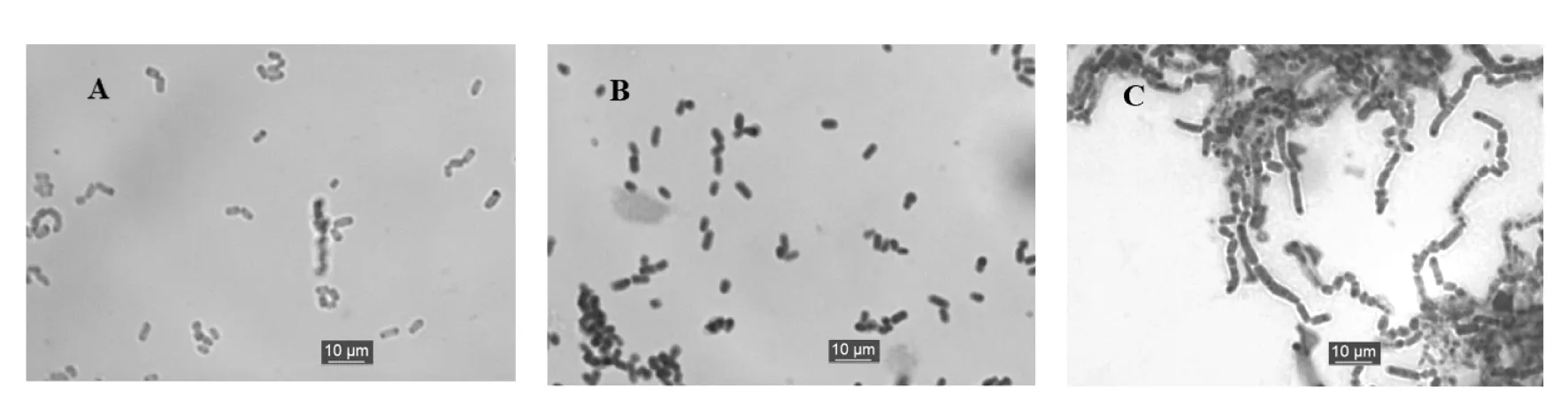
图3 RY1、RY2、RY3三种形态的菌株培养4 d的光学显微镜形态
2.3 菌株生理生化特征
通过对RY1、RY2、RY3生理生化特征分析,发现三种形态的菌株生理生化特征完全一致,无差别,均表现为具有过氧化氢酶,能催化过氧化氢分解;产生脂酶能够分解Tween-20、40、60形成晕圈,但不能分解Tween-80;硝酸盐还原结果阳性,能够还原硝酸盐为亚硝酸盐;不产生氧化酶、脲酶、淀粉酶和纤维素酶;不产生硫化氢,不能使脱脂牛奶产生凝固与胨化现象,不能使明胶产生液化现象,不能分解色氨酸,MR、V-P试验均为阴性。能够利用葡萄糖、果糖、岩藻糖、D-甘露糖生长代谢,对L-鼠李糖、D-半乳糖、D-木糖呈现出弱利用特征,不利用棉子糖、阿拉伯糖、麦芽糖。能够利用缬氨酸,弱利用赖氨酸、苯丙氨酸、组氨酸、丙氨酸和脯氨酸4种氮源,不利用甲硫氨酸和谷氨酸(表1)。
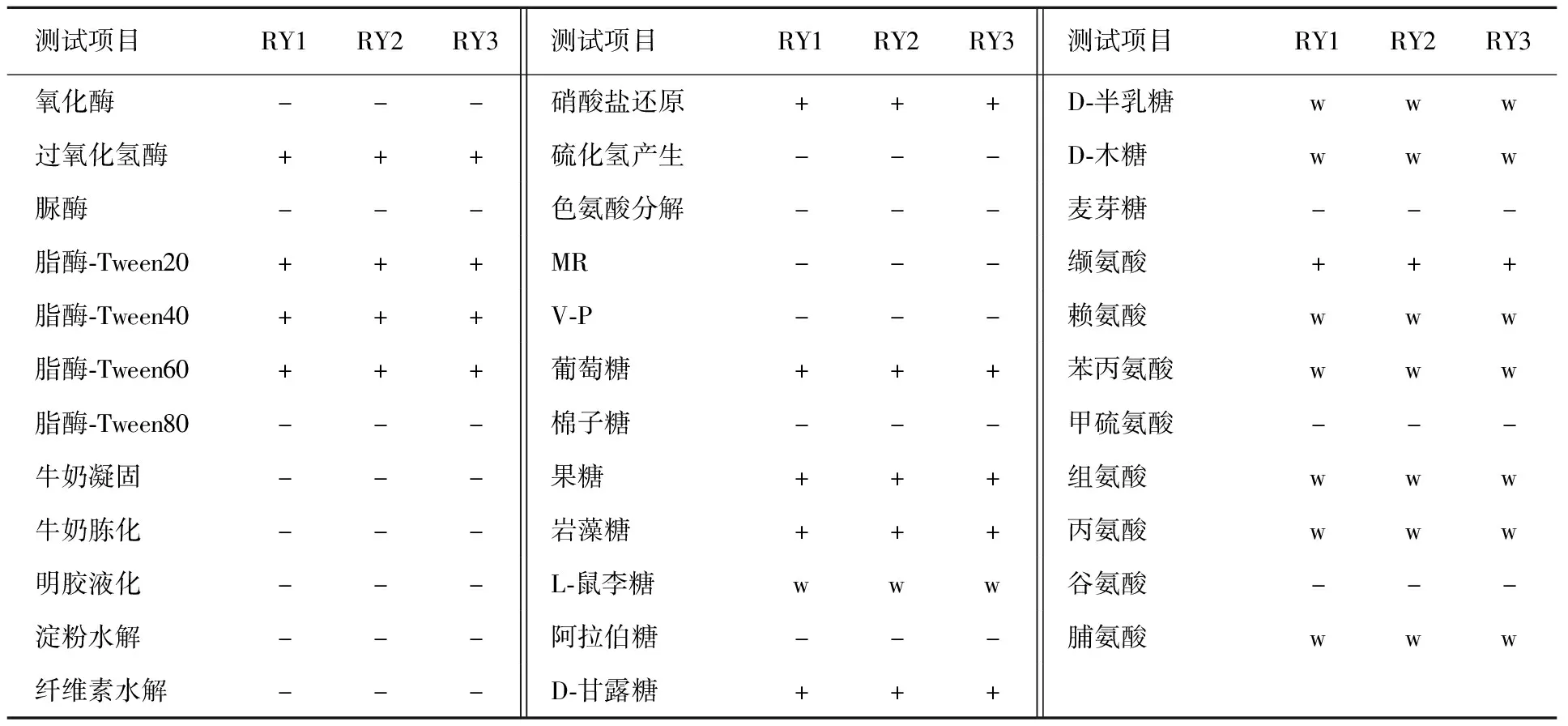
表1 RY1、RY2、RY3的生理生化特征
2.4 菌体生物量分析
培养及收集出发菌株Nr-8206、RY1、RY2、RY3湿菌体,测定湿菌体生物量分别为0.152 1、0.129 5、0.169 1、0.158 5 g/mL,RY2湿菌体含量最高,较Nr-8206(出发菌株)提高了11%,其次为RY3,其湿菌体含量与Nr-8206相差不多,RY1湿菌体生物量最低,降低15%(图4A)。
2.5 有效物质及杂质测定
紫外分光光度法测得出发菌株Nr-8206、RY1、RY2、RY3的细胞壁多糖含量分别为4.5、3.4、5.2、2.2 mg/mL(图4B);进一步测定,测得菌株Nr-8206、RY1、RY2、RY3的胞壁酸含量分别为384、284、438、231 μg/mL(图4C);Nr-8206、RY1、RY2、RY3的蛋白质残余量为8.8%、13.4%、6.9%、9.6%(图4D)。对比分析可见,RY2的糖含量最高,是Nr-8206的1.12倍,胞壁酸含量也最高,是Nr-8206的1.14倍,蛋白质残余量最低,较Nr-8206降低了22%。RY1糖含量、胞壁酸含量高于RY3,但低于RY2和Nr-8206,并且蛋白质残余量最高,杂质不易去除。RY3糖含量、胞壁酸含量最低,蛋白质残余量也高于Nr-8206,杂质也相对不容易去除。
将菌株Nr-8206、RY1、RY2及RY3生物量对比(图4A),RY2生物量最高,且有效物质糖含量、胞壁酸含量最高,蛋白质残余量最低,杂质更容易去除,综合表现最优。
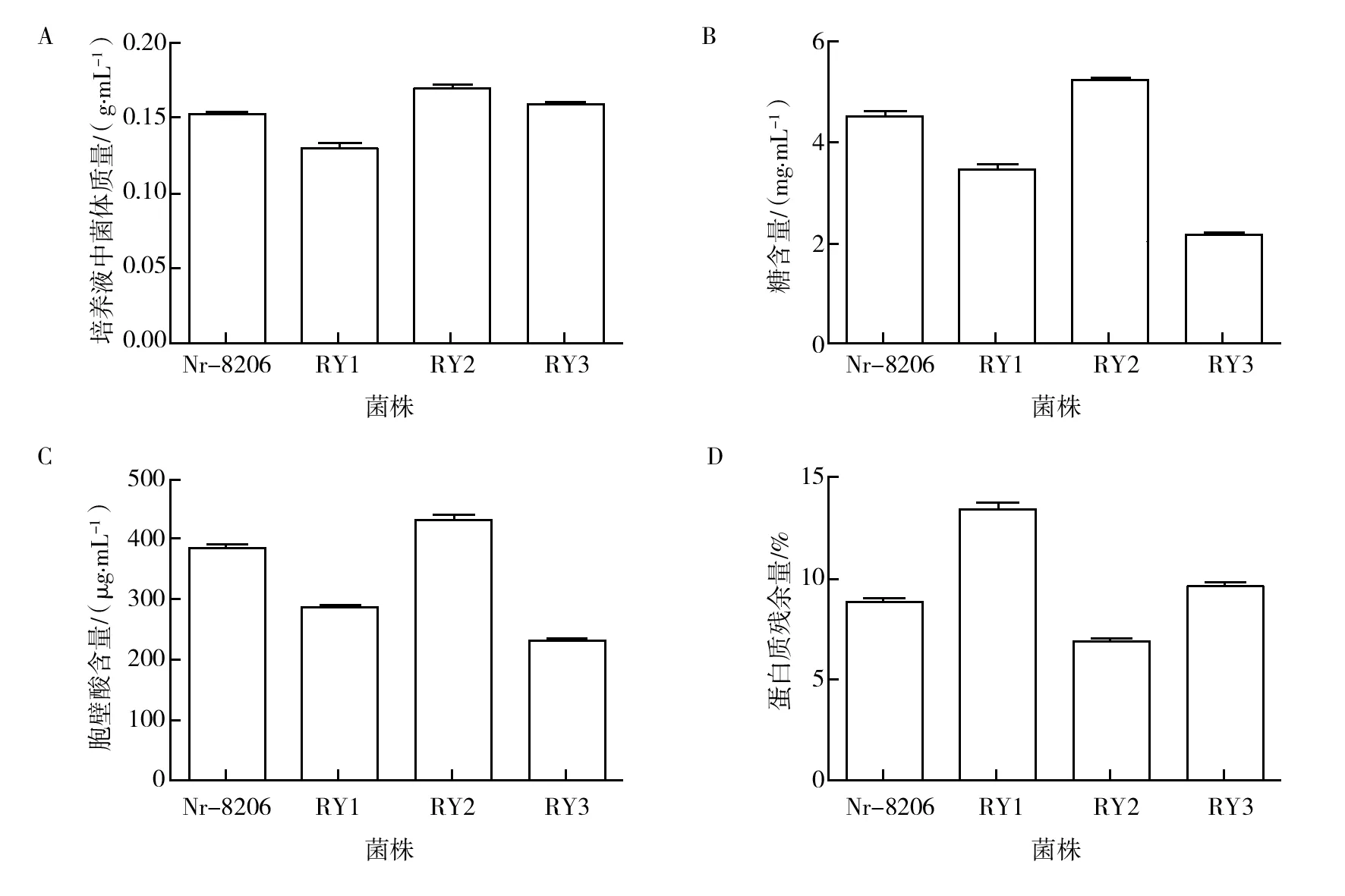
图4 红色诺卡氏菌Nr-8206株、RY1、RY2、RY3生物量、糖含量、胞壁酸含量和蛋白质残余量的对比结果
3 讨 论
本研究通过复壮红色诺卡氏菌Nr-8206株,经涂布后进行形态学统计,发现大、中、小三种菌落形态,每种形态各选一个典型形态进行研究分析。经对三种形态菌株进行生物量分析、有效物质糖含量、胞壁酸含量及杂质蛋白质的残余量的测定,对比分析结果显示,RY2为最佳培养形态,其菌落直径1.68 mm,橘色,有突起,有褶皱,菌落边缘呈丝状,光学显微观察菌体呈球状或短杆状有横隔膜。RY2发酵生物量明显高于出发菌株Nr-8206,较其提高11%,且均高于RY1和RY3。RY2有效物质糖含量为出发菌株Nr-8206的1.12倍,胞壁酸含量为出发菌株Nr-8206的1.14倍,且均远高于RY1和RY3。RY2杂质蛋白质的残余量较出发菌株Nr-8206降低22%,其杂质也更容易去除,综合表现较好。
筛选高性能、高质量的菌株,以达到提高目标有效成分产量和产率的目的[15],为生产高附加值生物制剂提供充足的原料。菌株的优选依赖于合理的筛选途径,可靠的试验方法,本研究通过复壮、涂布、形态学观察及统计分析等经典菌株筛选方法,挑选出具有典型特征的菌落形态,同时结合生物量并对菌株Nr-8206的有效物质和杂质质量指标,通过紫外可见光分光光度法测定分析,进一步确定优势菌落形态,为今后挑取Nr-8206活性良好的菌株提供标准。通过本研究结果可知,优势菌株RY2属于中菌落形态,而中菌落形态占出发菌株复壮总菌落数量的58.10%,说明中菌落形态具有较强活性,选择中菌落形态能最大限度的发挥其稳产、增产的作用[16]。本研究同时对菌株Nr-8206的三种形态分别进行了生理生化特征分析,三种形态生理生化特征无差别。这些生理生化特性对文献参阅、种属特性判断以及对该菌株生理生化研究信息的补充具有重要意义。同时,本研究对于今后发酵技术的改进和分离纯化都有重要的参考作用[17]。

