中链化学品微生物制造
朱志伟,谭亚娣,张乔馨,薛 闯,2
(1.大连理工大学 生物工程学院,辽宁 大连 116024;2.大连理工大学 宁波研究院,浙江 宁波 315016)
1 中链化学品
一般认为,含6~12个碳原子的直链脂肪酸为中链脂肪酸,相应的衍生物被称为中链化学品,广泛用作生物燃料、材料单体、日用化学品和精细化学品[1]。中链脂肪酸可作为除草剂、抗菌剂和润滑剂的中间体;中链酮和中链烷基酯是香精香料,中链酯也可以用作车用生物燃料;中链醇可用作表面活性剂、塑化剂、生物燃料和医药中间体;中链烷烃是汽油和航空燃油的理想替代品;中链烯烃可用于生产表面活性剂、塑化剂和特种塑料;中链二元酸是生产聚酰胺塑料(尼龙)的单体;ω-羟基酸可用作聚合物单体。现有中链化学品大多源自煤和石油化工原料,使用可再生原料合成中链化学品是实现其可持续绿色制造的必然选择。小部分中链化学品可使用动植物油脂为原料合成,例如椰油和棕榈仁油含70%~80%的中链脂肪酸,其中主要组分为月桂酸(C12);蓖麻油富含的蓖麻油酸(Ricinoleic acid,12-羟基油酸)经裂解转化后,可合成聚酰胺PA11的单体ω-氨基十一酸。然而植物油料来源的中链脂肪酸供应受土地、水肥和天气等因素的影响和限制,无法满足产业链需求。而微生物发酵生产不受上述因素影响,使用代谢工程改造的微生物细胞工厂合成中链脂肪酸,以木质纤维素为原料、或直接通过光合作用捕获CO2和光能、或使用可再生电能进行CO2转化,将为中链化学品生产提供一条可持续的绿色合成路线,也有助于“碳达峰、碳中和”目标的实现。过去5~10年内,代谢工程、合成生物技术、过程工程等技术的融合,已经催生了许多惊喜的成果,本文着重讨论中链化学品合成的酶学基础及细胞工厂改造策略,探讨存在的主要问题和挑战,并提出后续工作的方向。
2 碳链延伸途径
中链化学品的合成依赖碳链延伸途径,绝大多数微生物其天然的碳链延伸途径并不形成中链产物,因此细胞内中链化合物的浓度很低。随着对碳链延伸反应机制的理解及研究不断深入,现在可以操纵碳链延伸途径合成中链羧酸,这些途径包括脂肪酸合成途径、逆β-氧化途径、聚酮合成途径、α-酮酸延伸途径等。
2.1 脂肪酸合成途径
除少数古细菌外,地球上的生物均使用携带酰基的磷脂分子作为细胞膜的组分,且酰基碳链长度一般为C16和C18。原核生物、真核生物线粒体和叶绿体使用II型脂肪酸合酶系统,每种酶活性由单个基因编码。而I型脂肪酸合酶是多酶复合物,其亚基包含多个酶催化结构域。动物细胞的胞浆中存在二聚体、分子量约为540 kD的I型脂肪酸合酶;真菌和部分放线菌中存在分子量高达2.5 MD的另一种I型脂肪酸合酶。不同脂肪酸合酶系统催化的化学反应高度类似(图1a),针对不同脂肪酸合酶系统,引入短链硫酯酶(Thioesterase),或突变催化缩合反应的酮酰合酶(Ketoacyl synthase)和参与产物释放的丙二酰基/棕榈酰基转移酶(Malonyl/palmitoyl transferase),可以调控脂肪酸产物链长(图1a)[2]。
2.2 逆β-氧化途径
辅酶A(Coenzyme A,CoA)依赖的碳链延伸途径与脂肪酸β-氧化途径方向相反,常称为逆β-氧化途径。产溶剂梭菌利用逆β-氧化途径合成丁醇,该途径被改造后可以合成C≥6醇[3-4]。通过合成生物学手段和系统生物学分析,已确认大肠埃希菌逆β-氧化途径的核心组分,该途径发生的关键是替换酰基-CoA脱氢酶为反式-烯酰-CoA还原酶[4],而硫解酶(Thiolase)的底物链长特异性对实现多轮迭代逆β-氧化循环并合成C≥6产物起关键作用,另外硫酯酶(Thioesterase)也能显著影响产物的链长(图1b)[5]。逆β-氧化途径不依赖ATP,且使用NADH为还原力,这些特征有助于提高产物得率。尽管真核微生物(如酿酒酵母)可采用类似途径合成丁醇,但进一步延长碳链合成中链产物仍相当困难[6]。
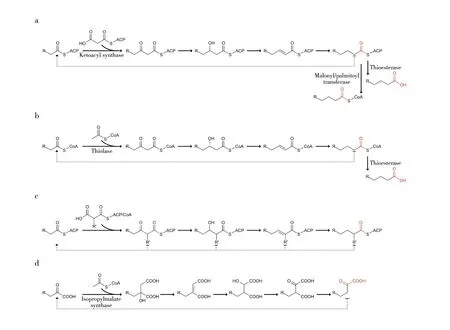
图1 中链化学品合成相关的碳链延伸途径
2.3 聚酮合成途径
聚酮合成途径与脂肪酸合成途径类似,但聚酮合成途径可使用的起始单元和延伸单元更加多样,如丙酰-CoA、甲基丙二酰-CoA等;此外聚酮合成途径往往缺乏酮酰还原、脱水或烯酰还原等步骤,最终产物骨架上保留了羰基、羟基或烯基基团,再加上环化和后续修饰,聚酮产物的结构非常多样[7]。通过改造聚酮合酶,可以合成中链化学品(图1c)。Keasling课题组利用大环内酯类抗生素Borrelidin合成相关的延伸模块1,替换其酮酰还原结构域和脱水酶结构域,并表达合适的硫酯酶,获得杂合的聚酮合酶可催化琥珀酰-CoA和丙二酸-CoA合成己二酸[8]。而对LipPks1聚酮合酶进行多轮的结构域替换与突变,可以合成多种酮类化合物(C6和C7乙基酮,C5和C6甲基酮)[9]。也有研究表达聚酮合酶SgcE与硫酯酶SgcE10来合成C15的直链烯烃[10],而改变硫酯酶SgcE10的特异性,将可能获得中链烯烃。目前,相当多的研究聚焦于次级代谢产物相关的聚酮合酶的发现与表征,改造与重设计聚酮合酶的研究尚不多,主要原因是聚酮合成机制较复杂,理性改造的难度较大。
2.4 α-酮酸延伸
该碳链延伸途径(图1d)与氨基酸合成有关,天然α-酮酸延伸途径通常只催化一轮反应,使底物增加一个亚甲基[11]。由于异丙基苹果酸合酶(Isopropylmalate synthase)的底物混杂性,该酶可使用氨基酸代谢产生的C6支链α-酮酸为底物,经一轮延伸反应,合成C7产物[12]。而通过蛋白质工程扩大其底物结合口袋,可使延伸循环次数增加,进而合成C6-8直链醇[13]。α-酮酸延伸使用乙酰-CoA为延伸单元,但每轮反应只增加一个碳原子,另一个碳原子经脱羧反应损失,因此该途径的碳原子利用效率不高,从而限制其应用。
2.5 其他途径
异戊烯合成途径使用C5单元,其中以香叶基焦磷酸为中间体,可形成10碳支链产物,例如香叶醇。另外脂肪酸β-氧化途径可对高碳链底物进行裁剪,但该途径依赖于长链脂肪酸,原子经济性较差。
3 链长控制
利用不同的碳链延伸途径,并且调控产物链长,是合成中链产物的关键。与产物链长控制相关的酶包括硫酯酶、酮酰合酶、硫解酶和酰基转移酶。
3.1 硫酯酶
酰基-酰基载体蛋白(Acyl Carrier Protein,ACP)硫酯酶催化水解酰基与ACP的磷酸泛酰巯基乙胺之间的硫酯键,释放出游离脂肪酸,使ACP再生并用于下一轮脂肪酸合成,而酰基-ACP硫酯酶的链长特异性决定脂肪酸产物链长。从加州月桂(Umbellulariacalifornica)中找到的中链酰基-ACP硫酯酶BTE,可实现转基因拟南芥积累大量C12脂肪酸[14],且高产C12脂肪酸的转基因油菜已商业化种植[15]。在缺失脂肪酸降解途径(敲除fadD或fadE基因)的大肠埃希菌中表达酰基-ACP硫酯酶BTE,可使该细菌大量分泌C12脂肪酸,表明通过硫酯酶调控脂肪酸链长具有可行性[16]。使用木质纤维素作为底物,以大肠埃希菌等微生物为底盘合成脂肪酸及其衍生燃料化学品(如脂肪酸乙酯、脂肪醇等),是生物燃料绿色制造的重要路线[17-18],且通过表达中短链硫酯酶来调整产物链长,有望生产出可替代汽油(平均碳链长度C8)及航空煤油(平均碳链长度C11)的生物燃料分子[19-20]。
酰基-ACP硫酯酶大多兼具酰基-CoA硫酯酶活性,可用于逆β-氧化途径的链长控制,如过表达大肠埃希菌内源硫酯酶tesA和ydiI,可显著提高中链脂肪酸合成水平[4-5,21]。最近报道细菌硫酯酶AtTE(源自Anaerococcustetradium)可能更偏好酰基-CoA底物,使表达的逆β-氧化途径与内源脂肪酸合成途径正交[22]。
由于硫酯酶在产物链长控制方面的重要作用,通过家族序列特征挖掘硫酯酶或通过蛋白质工程手段提高硫酯酶活性或特异性,都有许多成功的例子。例如,根据序列亲缘关系和来源物种的脂肪酸组成,选择31条硫酯酶基因,表征并归类这些硫酯酶的底物特异性,发现多个合成中短链脂肪酸的硫酯酶[23]。硫辛酸合成缺陷菌株(ΔlipB)的生长依赖辛酸(C8),使用该宿主筛选CpFatB1基因的随机突变文库,可获得高特异性合成辛酸的突变体[24]。使用迭代蛋白重设计算法指导大肠埃希菌tesA改造,也改变了该硫酯酶的链长特异性[25];另外根据tesA蛋白结构,对底物结构口袋进行改造,使该酶对酰基-ACP(C8)的底物选择性提高了133倍,而表达RD-2突变体(E142D、Y145G、M141L、L146K)使C8脂肪酸的合成量提高了10倍[26]。针对酵母和细菌来源的I型脂肪酸合酶,笔者研究发现其反应活性空腔存在富余空间,可嵌入中短链硫酯酶以劫持中间体,并证明重设计的脂肪酸合酶可合成中链脂肪酸[27-28],且已利用该重设计的脂肪酸合酶为下游中链化合物合成提供前体[29]。
3.2 酮酰合酶
酮酰合酶催化酰基-CoA/ACP与丙二酰-ACP发生Claisen缩合反应,该酶底物结合口袋空间是影响链长的重要因素。大肠埃希菌含3个酮酰合酶编码基因(FabH、FabB和FabF),并具有不同的底物特异性。FabH对乙酰-CoA具有选择性,特异性催化脂肪酸链延伸的起始反应形成乙酰乙酰-ACP,而FabB和FabF则催化后续Claisen缩合反应[30]。FabF底物结合口袋存在特定异亮氨酸残基I108,可根据酰基碳链长度调整构象,而突变该氨基酸为苯丙氨酸,可使FabF催化C6以上底物的活性显著减弱[31],从而限制长链脂肪酸合成。线粒体II型脂肪酸合成系统和真菌I型脂肪酸合酶的酮酰合酶也存在相似的Gatekeeper残基,例如酵母Fas2蛋白的M1251残基,如果突变其邻近的G1250为丝氨酸,限制M1251侧链旋转,或直接突变M1251为大侧链色氨酸,可使酵母脂肪酸合酶催化产生中短链脂肪酸[2,27,32],引入类似突变到细菌I型脂肪酸合酶,也能获得合成中链脂肪酸的突变体[28,33]。
3.3 硫解酶
硫解酶可分为合成型(如乙酰乙酰-CoA硫解酶)和分解型(如β-酮酰-CoA硫解酶)。分解型硫解酶热力学上偏好于催化β-酮酰-CoA裂解,但是在偶联下游热力学偏好反应(如烯酰-CoA还原)情况下,可催化两种酰基-CoA发生Claisen缩合反应[4,34]。硫解酶的底物特异性对产物链长起决定性作用,然而该酶的链长控制机制尚不清楚。筛选并测试不同来源的硫解酶有助于获得可特异性催化合成特定链长产物的硫解酶,通过序列相似性网络(Sequence Similarity Network)分析,找到了区别于聚羟基烷酸和脂肪酸降解途径的硫解酶,该酶可用于合成C8和C10脂肪酸[22]。蛋白质工程改造也能提高硫解酶的链长选择性,模型指导的底物结合位点重设计,使硫解酶合成产物中C6/C4的比例提高10倍[35]。近期研究发现,硫解酶介导的碳链延伸也可以接受β-酮酰-CoA为底物,实现聚酮化合物合成[36],硫解酶在碳链延伸反应过程中的底物混杂性,有望用于扩展生物合成化学品的结构多样性[34,37]。
3.4 酰基转移酶
酰基转移酶在脂肪酸合酶和聚酮合酶中,催化酰基-CoA与酰基-ACP间发生可逆的转酰基反应。该酶活性中心存在保守丝氨酸残基,该丝氨酸残基的羟基与酰基形成酯中间体。不同脂肪酸合酶系统中,酰基转移酶的催化特性与底物选择性不一样。例如大肠埃希菌FabD催化丙二酰-CoA为丙二酰-ACP;动物脂肪酸合酶的丙二酰/乙酰转移酶(MAT)结构域可转移乙酰-CoA和丙二酰-CoA两种底物,且还能识别多种CoA硫酯[38];而真菌I型脂肪酸合酶含有两个酰基转移酶结构域,催化乙酰-CoA的乙酰基转移酶(AT)结构域和催化丙二酰-CoA与长链终产物棕榈酰-ACP的丙二酰/棕榈酰转移酶(MPT)结构域。突变酿酒酵母脂肪酸合酶AT结构域(I306A)可增加对底物乙酰-CoA的亲和力,而突变MPT结构域(R1834K)则减少对底物丙二酰-CoA的亲和力,这两种突变改变进入脂肪酸链延伸反应的两种底物(乙酰-CoA和丙二酰-CoA)的比例,从而使脂肪酸合酶合成中链脂肪酸[32-33]。
4 前体供应
中链化学品合成依赖细胞代谢提供前体,并通过前述碳链延伸途径合成中链脂肪酸等平台化合物。乙酰-CoA和还原型辅因子是碳链延伸途径的关键前体底物,而这两种代谢物供应的原子经济性及能量转化效率是影响产物合成的重要因素。
4.1 乙酰-CoA
乙酰-CoA是细胞内重要的C2中心代谢物,是许多产物(如脂肪酸、聚酮、萜类化合物)的前体,并通过乙酰化修饰参与细胞调控过程[39]。提高乙酰-CoA的供给,对平台细胞工厂的创制非常重要[40]。Nielsen课题组对酿酒酵母乙酰-CoA供给进行了系统改造,包括引入多条乙酰-CoA合成途径,并结合适应性进化手段对胞内初级代谢进行了重塑(例如阻断乙醇发酵,消除Crabtree效应),并用于目标产物的合成[40-46]。大肠埃希菌等原核微生物的丙酮酸脱氢酶位于胞浆中,上调丙酮酸脱氢酶复合物基因表达,并通过质粒拷贝数调谐表达水平,增加了乙酰-CoA合成,并提升脂肪酸产量[47]。通过提高丙酮酸合成通量、减少乙酸代谢溢流以及提升CoA合成水平,也能增加乙酰-CoA供给[48]。此外设计构建新型乙酰-CoA合成途径,例如非氧化糖酵解途径可保留葡萄糖的所有碳原子,有望提高碳源转化得率[48-49]。从头设计羟基乙醛合酶和乙酰磷酸合酶,可使甲醛经3步反应形成乙酰-CoA,该精简途径不需要ATP输入,为C1底物原料的生物炼制提供同化途径[50]。
4.2 还原型辅因子
脂肪酸类产物的还原度高,其合成需要大量还原型辅因子,如逆β-氧化途径使用NADH为辅因子[51],而脂肪酸合成途径则主要使用NADPH[52],因此提升细胞内NAD(P)H水平和可及性是改善产物合成效率的有效手段[53]。过表达NAD+依赖型甲酸脱氢酶,不仅促进甲酸副产物利用,还可以利用外加甲酸为细胞供给NADH,从而有效提高逆β-氧化途径的中链脂肪酸合成能力[54]。对于脂肪酸合成途径,为提高NADPH水平,通常过表达中心代谢途径中产生NADPH的酶(如磷酸戊糖途径、异柠檬酸脱氢酶、苹果酸酶、NADP+依赖型3-磷酸甘油醛脱氢酶等),或催化NAD(H)转化为NADP(H)的NAD激酶和转氢酶(如PntAB和Udh),或改造目标途径使用NADH辅因子。例如,使用NADH依赖型酮酰-ACP还原酶fabG(源自Cupriavidustaiwanensis),脂肪酸产量提升了60%[55]。Stephanopoulos课题组系统评估了解脂耶氏酵母(Yarrowialipolitica)的氧化还原代谢,发现过表达NADP+依赖型3-磷酸甘油醛脱氢酶、NADP+依赖型苹果酸酶可提高脂质得率到0.28 g/g的最高水平[56]。在酿酒酵母中,过表达苹果酸酶和磷酸戊糖途径,并调谐磷酸葡萄糖异构酶Pgi1的表达来控制磷酸戊糖途径与糖酵解途径的代谢流量分配,使脂肪酸产量提高了28%[44-45]。
5 代谢工程策略
天然菌株合成目标产物的能力较低,要获得符合工业生产要求的生产菌株,大多需要对出发菌种进行多轮迭代改造,以提高底物到产物的转化率、产物浓度和生产强度。随着合成生物学工具研究的不断扩展,对细胞代谢的改造能力已达到前所未有的水平,并且会随着组学大数据、自动化设施、人工智能的应用而进一步深入。针对中链化学品制造,使用较多的代谢工程策略包括如下几个方面。
5.1 Pull-Bush-Block
引入高活性酶催化不可逆的产物形成反应(拉,Pull)、重编程中心代谢将前体导向目标产物合成(推,Push),阻断非必需反应减少副产物形成(阻,Block)是经典的代谢工程策略。针对中链脂肪酸产物合成,表达硫酯酶,引入催化不可逆酰基-ACP/CoA水解反应,生成游离脂肪酸产物,是典型的Pull策略。该反应减少酰基-ACP/CoA积累,能解除脂肪酸合成途径和逆β-氧化途径的反馈抑制作用[57];在酵母中,也可以敲除酰基-CoA合成酶编码基因FAA1和FAA4,使细胞积累和分泌脂肪酸[58]。除了提高乙酰-CoA和还原型辅因子的供应外,针对脂肪酸合成途径,提高丙二酰-CoA的水平对于推动(Push)前体进入脂肪酸合成途径有重要作用。过表达乙酰-CoA羧化酶,在原核和真核微生物中均能提高脂肪酸或脂质产量[58-60]。酿酒酵母乙酰-CoA羧化酶Acc1受磷酸化修饰调节,突变主要的磷酸化位点(S659和S1157),可以提高脂肪酸乙酯产量[61]。结构分析表明,S1157磷酸化位点位于非必需Loop区域(1137到1170),该区域缺失可解除Acc1的磷酸化调节,并对脂肪酸合成有利[28,62]。脂肪酸降解途径主要为β-氧化,为更好积累产物,一般均需要敲除β-氧化途径的关键编码基因,如大肠埃希菌的fadD/fadE[17,63]、酿酒酵母的POX1[44,58]、解脂耶氏酵母的MFE1[64]。对于酵母细胞,脂肪酸产物还可以用于合成甘油三酯、甾醇酯和磷脂,消除或减弱这些储存脂质的合成,可使碳流更多地导向脂肪酸产物形成[64-66]。此外,阻断中心代谢途径副产物形成,可实现代谢流汇聚,例如消除大肠埃希菌的发酵途径,包括敲除adhE(乙醇形成)、ldhA(乳酸形成)、frdA(琥珀酸形成)和pta/poxB(乙酸形成)[51]。乙醇作为酿酒酵母的主要副产物,Nielsen课题组尝试了消除乙醇形成途径,并使酿酒酵母从醇类发酵转变为合成脂肪酸[45]。
5.2 蛋白改造与重设计
中链脂肪酸合成需要对链长进行控制,已有多项研究对控制链长的关键酶或催化结构域进行改造(见小节3)。合成途径的辅因子不适配也需对酶的辅因子依赖型进行改造,与NAD(H)相比,NADP(H)的腺苷核糖环2′位连接磷酸基团,与该环2′和3′位基团相互作用的氨基酸残基决定酶的辅因子特异性。Arnold课题组开发了一种改变辅因子特异性的通用在线分析工具CSR-SALAD,可分析蛋白结构,并预测需要改变的氨基酸位点[67],该辅因子依赖型改造方法可用于调整辅因子不平衡问题。膜转运子可促进底物进入细胞或产物分泌,是代谢工程操作的重要靶点,然而许多膜转运子的结构及功能并不清楚。定向进化是改造膜转运子的有效手段,针对辛酸耐受相关的膜转运子Tpo1,笔者构建随机突变文库,富集并筛选出可增加酵母辛酸耐受性的突变体M49(含F322L、T45S和I432N突变),该突变体能提高多种胞外中链酸的产量[28]。
5.3 自适应进化
中链化学品对细胞具有较大毒性,且理性改善细胞耐受性难度较大。自适应进化利用细胞复制产生的自发突变,通过施加胁迫因子富集有利突变,最终获得耐受表型。自适应进化已广泛应用于提高细胞工厂的耐受性,并提升产物的合成[68]。对大肠埃希菌进行自适应进化,提高其辛酸耐受性,所获菌株可耐受30 mmol/L辛酸,且辛酸产量从32 mg/L提高到180 mg/L[69]。中链脂肪酸对酵母细胞的抑制作用更强,低至1 mmol/L即产生较大毒性[70]。笔者使用自适应进化手段,使酿酒酵母细胞在含辛酸的培养基中驯化约100 d,最终获得辛酸耐受能力显著改善的突变菌株,该菌株中链脂肪酸合成产量提高了2~3倍[28]。中链二羧酸可作为聚合物单体,自适应进化能提高酿酒酵母对戊二酸、己二酸和庚二酸的耐受性[71]。对进化菌株进行重测序,并与出发菌株进行比较分析,可鉴定进化菌株中的基因突变,结合CRISPR基因编辑工具,进行反向工程和表型分析,可找到主效突变[68]。然而,当存在许多中性突变时(不引起表型变化的突变),鉴定主效突变将相当困难。酵母细胞可进行有性生殖,将进化菌株与相反交配型出发菌株杂交形成二倍体,然后减数分裂形成子代单倍体,可实现突变等位基因的重组与分离,对子代细胞进行表型分析,并选取目标表型子代细胞进行基因组测序分析,在具有目标表型的子代细胞中富集的突变基因将大概率为主效基因。酵母有性生殖特性为主效基因发现提供便利,是理想的生物材料。
5.4 遗传编码的生物传感器
传统代谢物或产物的检测和定量依赖体外分析技术,如气相色谱、液相色谱等,但这些检测方法的通量比较低(10~1 000样品/d)。生物传感器可实时监测细胞代谢物水平,通过耦联合适的基因调节回路,还可实时对代谢途径进行精细调节,因此生物传感器可满足合成细胞工厂构建过程中的高通量分析检测和动态代谢调控需求[72]。感知脂肪酸产物或前体的生物传感器已应用于脂肪酸类产物的生物合成调控。例如使用识别酰基-CoA的转录因子FadR调控乙醇、酰基-CoA和脂肪酸乙酯合成相关基因的表达,使脂肪酸乙酯产量提升,并显著降低副产物积累[73];使用FadR控制生长相关基因表达,使低产脂肪酸菌株的生长受抑制,对细胞群体的生产性能进行质量控制,使脂肪酸产量提升3倍,发酵产量达到21.5 g/L[74]。现已开发出识别中链脂肪酸的生物传感器,包括基于G-蛋白偶联受体OR1G1和PDR12启动子的传感系统[75-76],可用于基因组过表达文库筛选,并找到KCS1和FSH2两个基因,其过表达提高辛酸产量约60%[77]。后续研究设计特异性更好、动态范围更广的生物传感器,用于多种文库的筛选,例如RNAi和CRISPRi基因表达抑制文库,可找到以前未被认知的靶点基因[78]。
6 中链衍生化学品合成
以中链脂肪酸为前体,通过化学与生物合成方法可获得许多衍生化学品。生物催化的衍生反应主要发生在羧基官能团,包括还原反应、脱羧反应、α-氧化、β-氧化、酯化反应等(图2)。P450酶可催化脂肪酸不同位置的碳氢键活化,并扩展了脂肪酸结构多样性,形成内酯、ω-羟基脂肪酸等。其中ω-羟基脂肪酸是聚合物单体,可进一步形成ω-二羧酸、ω-氨基脂肪酸等。下面将对几种重要衍生反应进行介绍。

图2 中链脂肪酸衍生化学品
6.1 羧基还原
羧基还原是合成醇、烷烃和烷基乙酸酯的重要反应,由于化学惰性,羧基往往需要激活后才参与化学反应。现有参与羧酸生物还原的酶都使用激活的羧酸硫酯(如酰基-CoA/ACP/PCP)为底物。其中羧酸还原酶为特殊非核糖体多肽合成酶,其腺苷化结构域催化转移羧酸到肽基载体蛋白形成硫酯中间体(酰基-PCP),然后经还原酶结构域催化该中间体为脂肪醛[79]。羧酸还原酶整合了羧酸激活和还原两种活性,并使用羧酸为直接底物,在催化还原脂肪酸的过程中有独特优势。细胞内酰基-CoA/ACP对脂肪酸合酶有反馈抑制作用[58],为提高脂肪酸合成的代谢通量,一般采用硫酯酶释放游离脂肪酸来消除酰基-CoA/ACP积累[63],从而解除反馈抑制。在这种情况下,细胞内游离脂肪酸的浓度较酰基-CoA/ACP硫酯高很多,相较于酰基-CoA/ACP还原酶,羧酸还原酶催化脂肪酸还原在动力学上优势明显,且评估多种脂肪酸还原酶对脂肪醇形成的影响,也表明羧酸还原酶性能最好[44]。由于羧酸还原酶底物特异性不好,笔者采用多种蛋白质改造手段,包括理性定点突变缩小腺苷化结构域的底物结合口袋、定点饱和突变消除还原酶的构象调控、定向进化提高转化中链脂肪酸的能力,最好的羧酸还原酶突变体可提高中链醇产量约3倍[80]。
以脂肪醛为底物,经醇脱氢酶或醛还原酶催化可合成脂肪醇。Pfleger课题组一直致力于辛醇合成,前期工作包括筛选合适的CpFatB1硫酯酶突变体[24],通过表达特异性更好的酰基-CoA合成酶(源自Mycobacteriumtuberculosis的FadD6)和酰基-CoA还原酶(源自Marinobacteraquaeolei的ACR),其他优化包括染色体整合型表达,提高酰基-CoA合成酶基因拷贝数等,使辛醇产量达到1.3 g/L水平,占总脂肪醇产量的90%以上[81]。该课题组也在脂肪酸合成途径和逆β-氧化途径菌株中表达酰基-CoA还原酶,使中链脂肪醇产量分别达到1.6 g/L和1.8 g/L水平[82-83]。在解脂耶式酵母中过表达中链硫酯酶(源自Cupheapalustris)和酰基-CoA还原酶(源自Arabidopsisthaliana),并敲除PEX10基因,获得0.5 g/L的癸醇[84]。使用光合蓝细菌为底盘,通过固定CO2和光能合成目标产物,是一种低碳合成策略,Jones课题组使用羧酸还原酶催化脂肪酸还原,使光合蓝细菌合成0.1 g/L的辛醇和癸醇,并发现中链脂肪酸前体不足是醇类产量受限的主要原因。以酿酒酵母为底盘,在表达脂肪酸合酶突变体形成辛酸的基础上,过表达羧酸还原酶,可形成约50 mg/L的辛醇[85]。笔者在前期构建的中链脂肪酸高产菌株中,过表达偏好中链底物的羧酸还原酶,敲除膜转运子Tpo1减少脂肪酸前体溢出胞外,最终摇瓶发酵合成252 mg/L的中链醇(C6-C12)[80]。脂肪醇进一步与酰基-CoA反应合成酯,且酰基-CoA硫酯键断裂为反应提供自由能,细胞内乙酰-CoA是丰度最高的酰基-CoA分子,合成乙酸烷基酯的反应动力学最具优势[86],而且合成的乙酸酯对细胞的毒性较低[87],因此中链醇乙酸酯目标分子的合成具有多种优势。
脂肪醛经脱羰基反应形成烷烃分子,现已发现包括脂肪醛脱甲酰加氧酶(fatty aldehyde deformylating oxygenase,ADO)、植物膜结合脱羰基酶(CER1)和昆虫P450氧化脱羰基酶(CYP4G1)可催化脂肪醛形成烷烃。与另外两种酶相比,ADO为可溶性蛋白,不同宿主中均可表达ADO合成烷烃[88-89]。大肠埃希菌表达硫酯酶tesA(L109P突变体)、酰基-CoA还原酶(源自Clostridiumacetobutylicum)和醛脱羰基酶CER1(源自Arabidopsisthaliana),组合其他改造,补料批式发酵可合成0.5 g/L烷烃[19]。笔者在产中链酸的酵母细胞中,表达羧酸还原酶,同时测试了10余种ADO及其偏好中链底物的突变体,发现源自嗜热蓝细菌(Thermosynechococcuselongatus)的ADO催化性能最佳[29]。由于脂肪醛中间体易被还原为脂肪醇而形成副产物,将烷烃合成途径区域化到过氧化物酶体,可显著减少醛类还原,从而增加烷烃的合成量[29,90]。前述三种酶催化烷烃合成的效率均不高,提高这些酶的催化性能是未来需要解决的主要瓶颈问题。
6.2 脱羧反应
已报道多种酶可催化脂肪酸脱羧形成端位烯烃,包括P450脱羧酶OleT、非血红素-铁(II)-氧化酶UndA、膜结合的类脂肪酸去饱和酶UndB,以及脂肪酸光脱羧酶FAP[91]。使用这些酶催化中链脂肪酸脱羧形成中链端位烯烃也有较多报道,例如优化OleT的氧化还原电子传递链,包括使用putidaredoxin作为电子传递系统,可以合成0.93 g/L的中短链烯烃(C3-C8)[92]。在大肠埃希菌中表达UndA,可合成超过5 mg/L的C11烯烃[93],笔者在酿酒酵母中表达UndA,可合成3 mg/L的端位烯烃,其中C9和C11是主要产物[29]。在脂肪酸脱羧过程中,UndA的辅因子Fe(II)转化为Fe(III),而细胞内再生该辅因子的还原剂尚未找到,限制了UndA的催化效率。UndB可合成不同链长(C9-C17)的端位烯烃[94-95],且还可以转化α,ω-二羧酸为α,ω-二烯烃[96]。另外在藻类中发现了一种光催化型脱羧酶FAP[97],FAP可催化长链脂肪酸脱羧,通过加入不同链长烷烃为诱导剂,可使短链羧酸发生脱羧反应[98]。在大肠埃希菌中表达中链硫酯酶和FAP,可形成C11和C13烷烃,表明FAP具有催化中链脂肪酸脱羧活性[99]。与ADO相比,FAP催化烷烃合成的产量更高[100],但蓝光输入显著增加成本,若能改变其催化所需光的波长,实现自然光下烷烃高效合成,并以光合微生物为底盘合成烃类,将显著提高经济性。
6.3 ω-官能团化
中链脂肪酸末端修饰羟基、羧基和氨基等,可用作可再生聚合物材料的单体。多种酶可以催化烷基羟基化[101],这些酶为脂肪酸末端修饰提供基础,例如P450单加氧酶或整合膜蛋白AlkB(烷烃单加氧酶)可催化ω-羟基化[102]。已报道能催化ω-羟基化的P450酶的种类和数量也比较多,但这些酶大多存在电子传递链复杂、底物特异性差、羟基化位点不专一等问题[103]。CYP153家族的P450单加氧酶催化ω-羟基化的位置选择性好,且为可溶性P450酶,其结构信息丰富,酶催化机制比较清楚,有助于酶的理性改造[104-106],使用CYP153合成ω-羟基脂肪酸将是比较理想的选择。AlkB单加氧酶催化脂肪酸ω-羟基化的研究也比较多,由于是膜蛋白,获得晶体结构比较困难,所以其改造和设计只能采用不依赖于结构的定向进化策略[107]。使用热带假丝酵母为生物催化剂,转化烷烃或脂肪酸甲酯为二羧酸已经商业化。而转化细胞自身合成的脂肪酸为ω-官能团化产物,将创制出一条完全依赖可再生原料的合成路线,例如在合成中链脂肪酸的酵母中,表达P450单加氧酶合成8-羟基辛酸,可获得3 mg/L的产物[108],由于产量很低,后续仍需对酶和菌株进行大量改造工作。
6.4 其他
中链酰基-CoA与醇类分子合成的中链酯可作为食用香精,例如己酸乙酯是浓香型白酒中主要的呈香成分。此外脂肪酸合成或降解途径的中间体(α,β-不饱和脂肪酸、β-羟基脂肪酸和β-酮酸)也是重要的高值产物,如3-羟基脂肪酸是合成聚羟基烷酸的前体,β-酮酸脱羧可形成甲基酮。脂肪酸α-氧化使脂肪酸丢失一个碳原子形成奇数碳脂肪酸,或脂肪醇[109],从而可扩展中链产物的链长多样性。
7 结 语
与其他链长(长链和短链)的脂肪酸相比,中链脂肪酸生物合成的难度更大,主要原因:①链长控制困难,尽管已获得多种硫酯酶和脂肪酸合酶突变体,或者使用逆β-氧化途径合成中链脂肪酸,但精准控制脂肪酸的链长还比较困难,所获得的产物为混合物,增加了后续分离成本;②中链脂肪酸的细胞毒性大,尤其是对细胞膜的扰动较强,需要提高底盘细胞的耐受能力。部分中链衍生物,例如中链烷基乙酸酯、中链二羧酸的毒性相对较低,以这些低毒性中链衍生物为目标产物,可以规避毒性问题。但中链衍生物合成过程的前体如脂肪酸、脂肪醛等容易溢出细胞外,如何调谐中间体溢出与下游途径合成也是需要考虑的问题。例如,我们前期发现敲除膜转运子Tpo1可减少胞外脂肪酸形成,同时增加了脂肪醇的产量[80]。由于中链产物的合成涉及蛋白、途径和细胞生理等多个尺度的调控,亟需组合蛋白质工程、途径工程和细胞生理工程进行多维度优化,并结合理性设计与非理性突变进行多尺度工程。
——中核工程创新驱动改革,奋力打造核工程产业链“链长”

