血管紧张素受体-脑啡肽酶抑制剂在肾性高血压的应用
余 乐 综述 俞雨生 审校
肾性高血压的治疗是临床常遇的难题,有报道慢性肾脏病(CKD)人群高血压患病率高达85.7%[1],中国透析前CKD患者高血压患病率约为78.4%[2]。随着肾小球滤过率(GFR)下降,高血压的患病率和严重程度也随之升高。CKD患者对降压治疗反应差,需长期联合多种药物降压。此外,高血压可加速CKD患者的肾功能恶化,甚至导致心、脑等重要脏器损害。因此降压治疗是临床改善CKD预后的核心环节之一。2021-06-01中国药品监督管理局批准了全球首个血管紧张素受体-脑啡肽酶抑制剂(ARNI)沙库巴曲/缬沙坦在原发性高血压治疗中的适应证,本文就其在肾性高血压中的应用做简要综述。
肾性高血压治疗的特殊性
由于水钠潴留、肾素-血管紧张素-醛固酮系统(RAAS)和交感神经系统(SNS)的过度激活、内皮功能障碍、炎症状态等多种因素,CKD患者患高血压可能性更大(图1)[3],二者互为因果、相互促进。相较于原发性高血压,肾性高血压有以下特殊之处。

图1 慢性肾脏病高血压的病理生理机制[3]
隐蔽性高CKD患者血压昼夜节律消失,夜间高血压发生率高、隐匿性高血压多见。2018年发表的涉及全球7518例CKD患者血压监测的研究显示[4],16%的CKD患者有隐匿性高血压、39%的患者高血压持续不受控,20%有白大衣效应,仅25%的患者血压达标。
控制难度大CKD患者难治性高血压患病率较普通高血压人群高2~3倍,且随着GFR的下降和蛋白尿的增多患病率逐渐升高,在CKD 4期人群中甚至可超半数,是导致不良结局的高危因素。
降压药物选择受限随着肾功能的下降和合并症的不同,降压药物的选择也随之变化。如中重度肾功能不全或透析患者,在使用血管紧张素转化酶抑制剂(ACEI)或血管紧张素Ⅱ受体拮抗剂(ARB)时应监测肌酐和血钾水平,且不建议醛固酮拮抗剂与ACEI或ARB连用,可加速肾功能恶化或发生高钾血症。双侧肾动脉狭窄和高钾血症时禁用RAAS抑制剂。GFR<30 ml/(min·1.73 m2)或合并高血酸血症时慎用噻嗪类利尿剂,此时仍可选用袢利尿剂,但肾损害的严重程度影响利尿效果。
肾性高血压降压治疗新理念
强化降压CKD患者常合并蛋白尿,蛋白尿与高血压对肾脏病进展有促进作用;此外,相较于原发性高血压患者来说,CKD患者发生高血压时的年龄更轻,因此建议遵循更严格的降压目标。2021年《KDIGO慢性肾脏病患者血压管理指南》建议非透析CKD患者收缩压应<120 mmHg[5],但在合并糖尿病或处于更晚的CKD分期等情况时,强化降压的益处/风险比仍有争议。
联合用药目前主流的降压药物有五大类,联合用药时需遵循机制互补、副作用相抵的原则。近年来复方制剂备受青睐,但依旧只是在原有药物基础上的简单合用,未涉及新的降压作用靶点。
脏器保护降压更重要的目的是阻止或延缓靶器官损害,在高血压、肾脏病进展、心血管疾病(CVD)的发生发展中均可见RAAS不恰当激活的身影,虽然RAAS抑制剂可一定程度降压、减缓CKD进展、改善心室重构等,但上述风险仍较高。
由于上述原因,我们亟待新型降压药物的出现。
ARNI的降压新机制
新靶点利尿钠肽(NPs)是一个多肽类家族,人体有三种:心房利尿钠肽(ANP)、脑利尿钠肽(BNP)和C型利尿钠肽(CNP)。ANP和BNP是维持体液和血压稳态最重要的物质,在CKD和心力衰竭(HF)等疾病状态下,循环中利尿钠肽水平上调以抵消过度活跃的RAAS和SNS。研究表明,提高利尿钠肽水平可降低血压并改善患者预后。
ANP前体在远端肾小管细胞局部表达产生尿钠素,两者对血管紧张素Ⅱ(ATⅡ)、肾素、醛固酮和抗利尿激素都具有抑制作用。ATⅡ诱导的系膜细胞收缩作用被ANP抵消后,毛细血管滤过表面积增加产生利尿效果。ANP和BNP都可抑制近端和远端肾小管对钠的重吸收,通过利钠和利尿导致血管内容量减少和血压下降。ANP还通过扩张全身血管、优先扩张肾小球入球小动脉和收缩出球小动脉增加肾血流灌注,从而增加肾小球内毛细血管压力、滤过分数和GFR。
动物实验证实[6],敲除ANP前体基因的动物会发生盐敏感型高血压(SSH),ANP基因转染SSH小鼠可降低血压,减少肾损伤、心肌肥厚和中风的发生。编码利尿钠肽相关基因的遗传变异与高血压风险相关[7]。
除了肾内作用,ANP通过激活环磷酸鸟苷(cGMP)依赖的蛋白激酶G,介导一氧化氮 (NO)产生增加,随后血管平滑肌松弛并降低血压;ANP还可在主动脉、心室和肾脏中诱导Ca2/钙调蛋白依赖的内皮NO合酶。ANP还可增加内皮细胞通透性,促进血浆蛋白和液体从分布至间质,导致血管内容量的减少。在心脏中ANP减弱交感神经兴奋并增强迷走活动,导致心率和心输出量下降。NPs不仅可通过上述机制影响血管张力和体液稳态,而且可减少血管重塑。高水平的BNP可减少转化生长因子β的表达,并促进细胞外纤维基质成分降解。此外NPs通过与其G偶联受体相互作用,拮抗促心肌肥大的病理信号。
循环中的NPs可被利尿钠肽C型受体和脑啡肽酶(或称中性内肽酶,NEP)降解。NEP不仅可降解利尿钠肽,还可调节其他多种血管活性多肽,包括ATⅡ、缓激肽、内皮素1、P物质、肾上腺髓质素和淀粉样蛋白,因此其的净效应依赖于血管收缩素(vasoconstrictor)和血管扩张肽(vasodilatory peptides)之间的平衡。正因如此,单独使用NEP抑制剂(NEPI)并未导致有临床意义的血压下降,因为NEPI不仅增强了NPs的作用,同时也减少了对ATⅡ的降解,代偿性RAAS和SNS的上调抵消了NPs增多的优势。因此需要同时对NEP和RAAS进行抑制,以增强有益的肾脏和心血管作用。
联合ARB,增强脏器保护作用,减少不良反应
NEPI最初设计与ACEI联合,但在临床试验中血管性水肿发生率较高,严重者甚至需住院或机械通气治疗。
ARB与ACEI有相似的心肾作用,可改善心脏重构、降低高血压患者CVD的发生风险,并减少尿蛋白,目前普遍认同其是伴有蛋白尿的CKD患者降压的一线药物[8]。
但ARB对缓激肽的影响小,故ARNI制剂LCZ696是由NEPI沙库巴曲和ARB缬沙坦以1∶1的摩尔比组成的新型单一共晶体,这种独特的药物结构保证了两药可以同步发挥药效。服用后LCZ696迅速解离为沙库巴曲(AHU377)和缬沙坦,AHU377进一步被酶促裂解为其活性形式LBQ657,抑制NEP活性(图2)[9]。ARNI独特的双通道作用机制使得降压效果更强、起效更迅速。
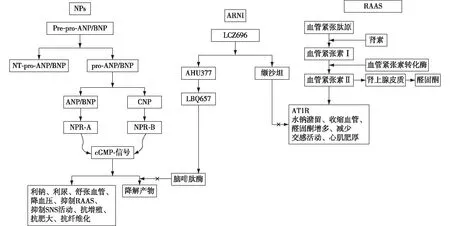
图2 ARNI的作用机制[9]NPs:利尿肽钠系统;Pre-pro-ANP/BNP:前心房利尿钠肽/脑利尿钠肽原;NT-pro-ANP/BNP:N-末端心房利尿钠肽/脑利尿钠肽前体;pro-ANP/BNP:心房利尿钠肽/脑利尿钠肽前体;ANP/BNP:心房利尿钠肽/脑利尿钠肽;CNP:C型利尿钠肽;NPR-A:利尿钠肽受体-A;NPR-B:利尿钠肽受体-B;cGMP:环磷酸鸟苷;RAAS:肾素-血管紧张素-醛固酮系统;SNS:交感神经系统;ARNI:血管紧张素受体-脑啡肽酶抑制剂;AT1R:血管紧张素Ⅱ 1型受体;LCZ696:沙库巴曲和缬沙坦1∶1组成的共晶体;AHU377:沙库巴曲;LBQ657:沙库巴曲的活性形式
ARNI在CKD患者中的应用与疗效(表1)
降低血压
PARAMOUNT试验[10]中治疗12周时ARNI组的血压平均降低-9.0±13.8/-4.8±10.0 mmHg,缬沙坦组下降-2.8±16.9/-1.9±10.9 mmHg;治疗36周,ARNI组血压平均下降-7.5±15.1/-5.1±10.8 mmHg,缬沙坦组降低-1.2±16.1/-0.2±11.6 mmHg。
目前除了在HF人群中,还没有使用ARNI治疗高血压的大规模随机对照试验。
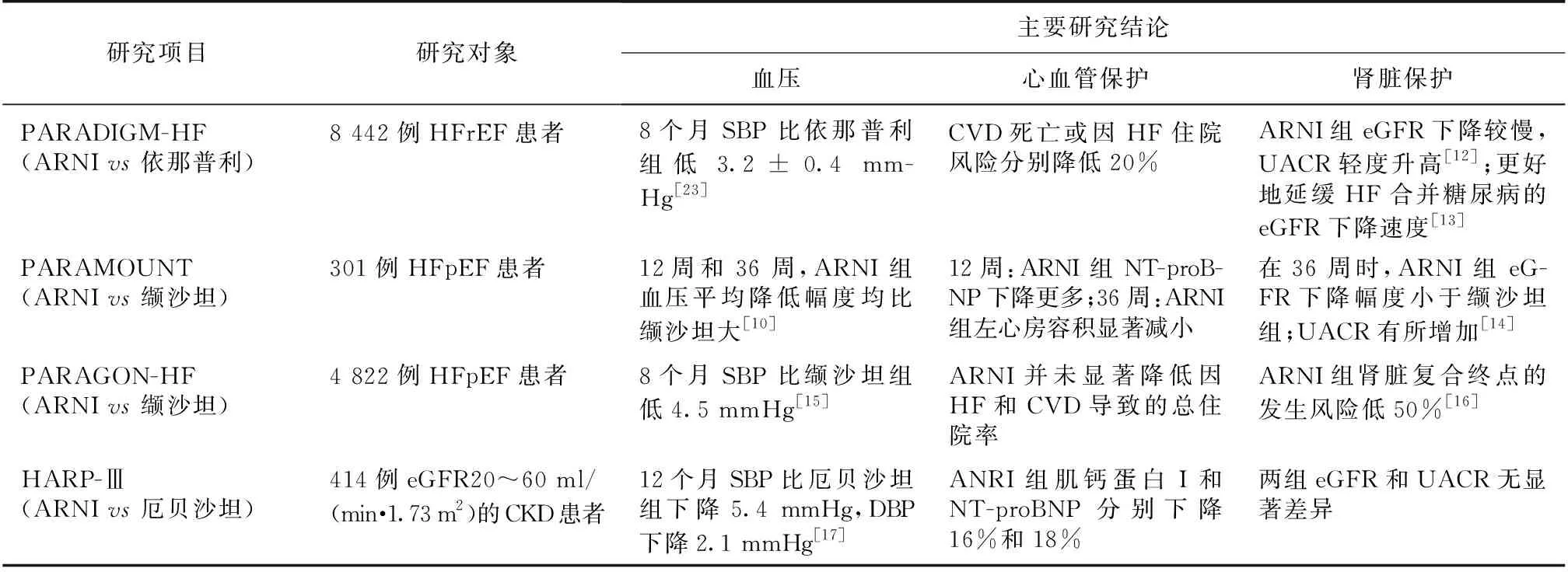
表1 ARNI大规模随机对照试验结果
ARNI:血管紧张素受体-脑啡肽酶抑制剂;SBP:收缩压;DBP:舒张压;CVD:心血管疾病;HF:心力衰竭;NT-proBNP:N-末端脑利尿钠肽前体;HFrEF:射血分数减少的心力衰竭;HFpEF:射血分数保留的心力衰竭;eGFR:估算肾小球滤过率;UACR:尿白蛋白排泄率
日本一项小型针对CKD[估算肾小球滤过率(eGFR)在15~60 ml/(min·1.73 m2)]合并高血压人群的研究显示[18]:服用ARNI 8周患者的坐位平均收缩压和舒张压分别下降20.5±11.3 mmHg和8.3±6.3 mmHg,尿白蛋白排泄率(UACR)平均下降15.1%。
对靶器官的保护
改善心血管并发症
CKD患者发生CVD的风险明显增加,无论CKD处于何种阶段,在大多数患者中,CVD导致的过早死亡比进展为终末期肾病(ESRD)的风险更显著,是导致CKD患者预后不佳的主要原因。
动物试验切除大鼠5/6的肾脏后随机分为不治疗组、缬沙坦组和ARNI治疗组。8周后ARNI组大鼠的心脏/体重比、血清N-末端脑利尿钠肽前体(NT-proBNP)、成纤维细胞生长因子23水平和肾功能明显改善,主动脉纤维化及心肌肥厚和纤维化好转,心脏氧化应激和炎症指标下降,单独使用缬沙坦的效果不及ARNI[19]。
PARAMOUNT试验[10]12周时ARNI组的NT-proBNP水平下降程度更多(ARNI:基线783 pg/ml,12周605 pg/ml;缬沙坦:基线862 pg/ml,12周835 pg/ml;ARNI/缬沙坦变化比0.77(0.64~0.92),P=0.005);治疗36周后,心脏彩超测得ARNI组左房容积明显减小(-4.6vs0.37,P=0.003)。
曾筱曼等[20]回顾性分析了25例接受ARNI治疗心肾综合征(CRS)的患者,治疗3个月后NT-proBNP降低[1 429(506.4~3 057) pmol/Lvs225(105.4~869.3) pmol/L,P<0.01)、平均动脉压更低[109.4±10.7 mmHgvs94.7±12.3 mmHg,P<0.05)]。
Heyse等[21]报道了1例患有射血分数减少的心力衰竭(HFrEF)(EF 35%)的血液透析患者,在低血压的情况下开始ARNI治疗并逐渐滴定剂量。治疗过程中患者HF的症状改善、活动耐力提高,长期升高的心脏充盈压下降,用药3个月时,NT-proBNP从初始的11 400 pg/ml降至5 960 pg/ml。
2021年6月发表的一项纳入21例腹膜透析(PD)患者的小样本回顾性观察研究显示[22],对HFpEF的PD患者使用ARNI治疗,随访3~12月NT-proBNP水平和心率明显下降,HF症状和体征减轻,未出现药物不良反应。
在刚刚发表的我国首部透析患者慢性心力衰竭管理指南中,推荐ARNI可成为合并高血压的透析心衰患者的新的药物选择。
延缓肾损害进展
早期糖尿病肾病的动物模型发现,与单独抑制RAAS相比,联合抑制ARNI可显著减少蛋白尿、改善肾脏超微结构和肾小管损伤标志物[23-24],且这些效应独立于血压下降发生。可能是通过抑制炎症和氧化应激介导,以及药物特异性的保护足细胞完整性的作用实现[23-25]。
PARADIGM-HF事后分析显示[12],ARNI组eGFR下降较慢,UACR轻度升高,但不影响预后,且更少因肾脏不良反应停药。此外与非糖尿病患者相比,ARNI可更好地延缓HF合并糖尿病患者的eGFR下降速度,这一额外的肾脏保护作用可能与ARNI介导的cGMP升高有关[13]。
PARAGON-HF试验中[16]47%的患者eGFR在30~60 ml/(min·1.73 m2),至研究结束ARNI组肾脏复合终点(因肾功能衰竭死亡、ESRD或eGFR较基线下降≥50%)的发生风险更低。
以上大型研究均未纳入eGFR<30 ml/(min·1.73 m2)的严重肾功能不全患者。来自台湾的真实世界研究[26]招募了932例HFrEF患者,其中10.9%的患者eGFR<30 ml/(min·1.73 m2)。随访15个月,与仅接受标准HF治疗相比,加用ARNI治疗的患者的全因死亡、CVD死亡、猝死、HF再发住院率均显著下降,在不同CKD分期的患者中,ARNI组的预后也更好:在CKD 1~3期患者中,ARNI组因HF死亡或住院的发生率降低14%;CKD 4~5期患者中,ARNI组CVD死亡或住院人数减少28%。
ARNI的不良反应及用药注意事项
ARNI常见的具有临床意义的不良反应主要包括症状性低血压、肾功能恶化、高血钾、咳嗽和血管性水肿,eGFR<15 ml/(min·1.73 m2)、双侧肾动脉狭窄及中重度肝功能异常患者慎用。沙库巴曲/缬沙坦的常规降压剂量为200 mg,1次/d,难治性高血压患者可酌情加量至最高400 mg/d,CKD患者可从50~100 mg/d的较低剂量开始。为避免发生血管性水肿,禁止与ACEI合用,如需切换药物,应停止使用ACEI 36h后方可开始ARNI治疗[27]。
小结:改善CKD患者的血压控制能够显著减少CVD和延缓ESRD的发生,ARNI在降血压、保护心血管、延缓GFR下降等方面都存在优势。ARNI独特的全新药物作用靶点以及单一共晶体结构,可更好地有效降压。该药在高血压及慢性HF适应证方面已获审批,对心血管系统和肾脏具有全面的靶器官保护作用,有望打断高血压-心血管事件链的魔咒,让更多的高血压患者获益。
但ARNI在CKD 4~5期及接受肾脏替代治疗患者中的临床研究仍较少,目前仅有个案报道或零星的病例回顾,需要进一步扩大样本量和延长观察时间。另外,从作用机制上来说,ARNI可保护内皮系统、减轻纤维化和改善代谢紊乱导致的微炎症状态,可能有益于PD患者残余肾功能的保护并延缓腹膜纤维化的进展,在这些方面仍需进一步的研究。

