创伤相关急性肾损伤
汤文君 综述 李世军 审校
创伤相关急性肾损伤(AKI)是由创伤之后肾脏功能在短时间内急剧下降而出现的一组临床综合征。肾功能障碍轻重不一,从轻度血清肌酐升高到需要肾脏替代治疗(RRT)。创伤后合并AKI使患者预后更差,并与患者住院时间延长、死亡率增加等不良后果有关[1-2]。合并AKI的创伤患者后期更易发展为慢性肾脏病(CKD),远期合并症和死亡率更高[3]。随着急救技术进步,创伤患者短期存活率得到改善,后期包括AKI在内的全身性并发症的处理给临床医生带来更大挑战和更高要求。本文归纳总结了创伤相关AKI的流行病学、发病机制、治疗和预后方面的最新进展。
流行病学
关于创伤患者AKI发病率的研究结果差别很大,主要源于各研究间临床和方法学的不同。重症监护病房(ICU)的研究结果显示,创伤相关AKI的发病率为20%~24%。其中,56%~59%为AKI 1期,23%~30%为AKI 2期,14%~18%为AKI 3期。每10例AKI患者中就有1例需要RRT,约占总创伤患者的2%[1,2,4]。而两项分别在伦敦[4]和巴黎[5]创伤人群中进行的大型观察性研究显示,创伤相关AKI的总发病率为13%,7%~8%的患者为AKI 1期,1%~4%为AKI 2期,2%~3%为AKI 3期。此外,美国国家创伤数据库最近的一项回顾性研究提出,创伤相关AKI 3期的发病率为0.68%[6]。75%~95%AKI发生在创伤后5d内,从创伤到符合AKI诊断标准的中位时间在ICU创伤人群为3d[1],在总创伤人群为2d[4-5]。
病因
创伤相关AKI是一种涉及多种因素的异质性疾病。创伤早期AKI的致病因素包括低血容量性休克(失血性休克)、横纹肌溶解、直接肾外伤以及大量输血。创伤后期的致病因素主要包括接受具有肾毒性药物的治疗方案和创伤相关并发症,如脓毒症和腹腔室隔综合征(ACS)。临床上主要通过监测与病因相关的指标来评估患者进展至创伤相关AKI 的风险(表1)[7]。一项针对颅脑外伤、战创伤、多发伤患者发生AKI的荟萃分析显示,腹部创伤和脓毒症的OR值>3,高APACHE Ⅱ评分、低GCS评分、休克和高ISS的OR值>2[1]。研究表明大量输血是导致创伤相关AKI的最重要危险因素之一[1,4-5],与其他创伤相关AKI风险的指标不同,大量输血存在特异性危险因素,包括输血后免疫抑制、溶血产物、血浆游离血红蛋白和铁增加。过去一直认为使用碘对比剂是造成AKI的重要原因,但大型荟萃分析表明,静脉注射对比剂并未增加患者发生AKI、RRT需求或死亡率的风险[8]。有研究甚至发现ICU创伤人群中使用对比剂的患者发生AKI的概率更低[1]。这提示临床可能高估了对比剂相关AKI的风险,并对其临床意义、目前使用的对比剂的真正毒性作用以及限制使用对比剂的正当性提出了质疑。总之,创伤相关AKI是多因素相互作用的综合结果,很难明确每个因素的具体作用。

表1 创伤相关急性肾损伤的病因、病理生理学机制和临床指标[7]
危险因素
创伤患者的平均年龄较低且无基础疾病,但有一部分创伤患者自身存在危险因素,在特定致病因素下更容易进展为AKI。综合目前的研究结果,增加创伤后发生AKI风险的危险因素包括高龄、糖尿病、高血压、CKD、肥胖和非洲人种[1]。女性是公认的AKI的危险因素,但在创伤相关文献中,关于性别对创伤相关AKI影响的研究结果是互相矛盾的,既有结果支持女性患者创伤后发生AKI风险更大[9],又有研究认为男性患者风险更大[1],还有研究的结论是两者无显著差异[4]。事实上,临床上很难明确性别对创伤相关AKI的真实影响,因为混杂因素在男性和女性创伤患者群体中分布并不均匀。
发病机制
作为一种异质性疾病,创伤相关AKI可能存在多种病理生理学机制(图1)[7]。
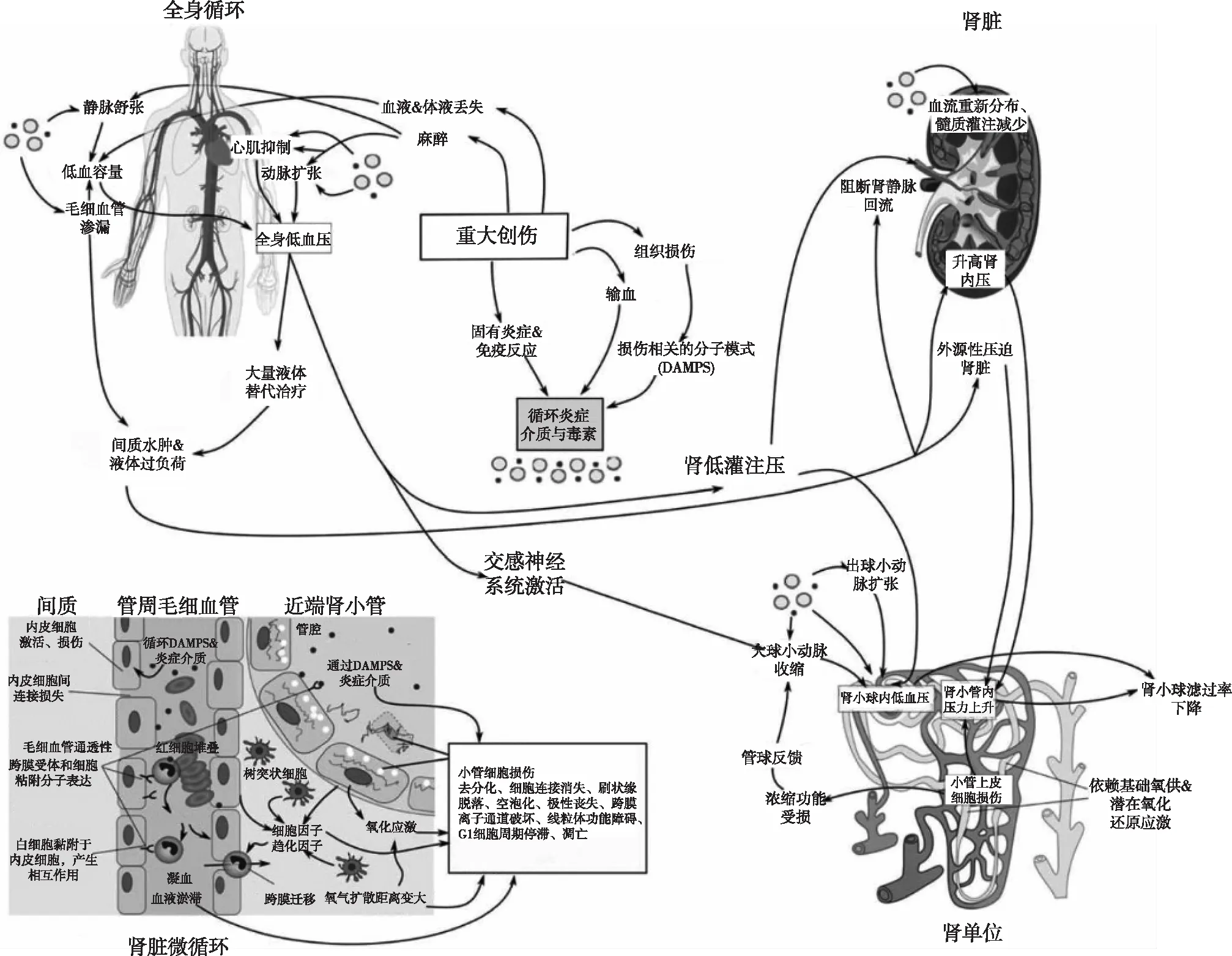
图1 创伤相关急性肾损伤的病理生理学机制[35]DAMPS:损伤相关分子模式
失血低血容量导致全身低灌注,当肾灌注压低于其自身调节的下限时,肾脏血流减少,肾组织氧供随之下降。机体为了维持血压和肾小球滤过率(GFR),反应性激活交感神经和肾素-血管紧张素-醛固酮系统,使得肾内血管收缩,肾组织缺血、缺氧加重。同时,在低血容量状态下,肾小管对钠的重吸收增强,肾组织耗氧增多,最终导致肾脏氧合过程持续失衡,肾功能受到损害。失血后早期在肾细胞中检测到缺氧诱导因子1α的表达[10]为该机制提供了证据支持。Mayeur等[10]报道了失血性休克的AKI表现为肾小管刷状缘脱落、上皮细胞空泡化,管腔内可见脱落的上皮细胞。失血性休克早期肾脏处于缺血、缺氧状态,后期进入再灌注阶段,肾脏产生微血管病变和炎症反应。既往研究发现缺血再灌注可使肾组织发生氧化应激,产生超氧阴离子,启动细胞凋亡,超氧化物歧化酶(SOD)活性的快速下降是其中一个重要原因。诱导型一氧化氮合酶(iNOS)在失血后表达增加,产生大量NO,与活性氧反应生成过氧亚硝酸盐,破坏线粒体结构。减轻氧化应激能够提高肌酐清除率[11]。
炎症失血本身可导致炎症,如发生失血性休克90 min后小鼠肾脏肿瘤坏死因子α(TNF-α)和白细胞介素6(IL-6)表达增加[12]。肾微血管内皮细胞早期被激活,表达细胞间黏附分子1和E选择素,介导白细胞的黏附、滚动和迁移。但这种促炎反应是由缺血和再灌注共同引起的,仅缺血无法引发同等程度的炎症反应[12]。受损组织能够向体循环中释放损伤相关分子模式(DAMPs)参与创伤后血管的炎症反应[13]。骨骼、肝细胞或肌肉可释放核或线粒体DNA、组蛋白、高迁移率族蛋白B1(HMGB1)等物质,通过白细胞受体[包括Toll样受体(TLR)]激活固有免疫细胞,导致多器官炎症反应。研究发现创伤通过改变白细胞80%的基因表达对机体造成炎症损伤[14],但目前关于这些分子途径在创伤相关AKI中作用机制的探索仍较少。
横纹肌溶解横纹肌溶解对肾脏的损害主要由肌红蛋白介导。在肾小球内,肌红蛋白可显著增强血管紧张素Ⅱ对入球小动脉的收缩效应[15],增加入球小动脉血管壁上超氧阴离子的产生,使NO数量减少,导致血管过度收缩[15]。在肾小管内,肌红蛋白能够诱导上皮细胞脂质过氧化[16],其降解产物(主要是游离铁)可产生羟基,严重损害细胞膜的结构[17]。作为一种小分子蛋白,肌红蛋白能够通过肾小球滤过膜,并在肾小管中积聚,生成管型,阻塞远端肾小管,低血容量引起的酸性尿可促进管型生成。肌红蛋白通过激活血管内皮细胞和中性粒细胞,产生局部促炎分子[核因子κB(NF-κB)和IL-6],引发炎症反应[18]。肾小管氧化损伤可释放趋化因子,吸引单核细胞向肾脏迁移,同时,肌红蛋白诱导单核细胞转化为M1型巨噬细胞,释放IL-1和IL-12介导肾小管炎症反应,并分泌纤维连接蛋白和胶原蛋白促进肾间质纤维化[19]。在横纹肌溶解相关AKI实验模型中,提高巨噬细胞迁移抑制剂浓度、清除巨噬细胞或诱导单核细胞转化为M2型(抗炎巨噬细胞)而非M1型巨噬细胞均可减少AKI的发生[20]。
腹腔高压创伤是导致腹内压升高的常见原因,0~37%的创伤患者继发ACS[21]。根据一项小样本研究,继发ACS的创伤患者AKI的发生率为42%[22]。腹腔内压力过高直接压迫肾脏血管,导致肾灌注减少,GFR下降。实验发现单纯的肾脏外部压迫并不影响GFR,压迫肾静脉可使GFR下降,解除压迫时,GFR迅速恢复[23],这与临床上腹部减压手术能快速逆转ACS导致的少尿非常相似。ACS和创伤相关AKI的关联还可以通过液体复苏引起的肾实质水肿来解释。尽管罕见,但ACS也发生在无腹部损伤的创伤患者中[24],其中液体复苏量与创伤患者发生ACS的风险密切相关[25]。研究发现健康成人在接受2L液体负荷时出现肾脏体积增加[26]。由于肾包膜的顺应性较低,在肾实质体积增大的情况下,肾内压会迅速升高,造成AKI。
直接肾损伤钝性或穿透性肾外伤可直接引起创伤相关AKI,根据美国创伤外科协会器官损伤量表,肾外伤严重程度分为五级(Ⅰ~Ⅴ)。低度损伤(Ⅰ~Ⅲ)局限于包膜和(或)实质,而高度损伤(Ⅳ~Ⅴ)累及肾脏大血管和(或)集合系统。研究证实,直接肾脏损伤可使AKI风险增加4~8倍[4-5],超过25%肾实质血流中断是长期肾功能障碍的独立预测因素[27]。
预防与治疗
创伤相关AKI与手术相关AKI相似,均存在明确的启动因素,提示早期风险分层和干预可能影响最终的临床结局,因此可以通过手术相关AKI的研究推断创伤相关AKI的治疗方法。但需要注意的是,创伤相关AKI有其独特性,涉及更多不同种类的危重患者。允许性低血压、早期使用血液制品和损伤限制手术等现代创伤治疗手段在降低院前和院内死亡率的同时,对肾脏功能提出很高要求,临床医生需要根据患者个体和临床实际情况进行适当调整。创伤24h后,临床医生还需要及时调整合并AKI或有高度AKI风险的创伤患者的支持治疗策略。
首先在创伤患者的早期复苏和后期管理中需谨慎选择补液的种类和液体量。相比于晶体,血液制品通常是早期复苏的首要选择,但大量输血与创伤相关AKI密切相关。以不限制输血为对照,限制性输血的安全性已经在诸如心脏手术等其他无活动性出血的危重患者中得到了证明[28]。因此复苏过程中,在保证必要水平的基础上尽可能减少输血量可能会减少AKI的发生。现代创伤管理限制在院前和早期复苏中使用晶体。在入院后24~48h,无限制补充晶体可以增加患者的死亡率[29-30]。越来越多的证据表明,除了最初的复苏期之外,相对严格的液体管理可能更有益,在创伤后入院的前7天采取更自由的补液策略可能会导致机械通气时间和ICU住院时间延长[31]。当需要补液,尤其是液体需求量很大时,与等渗盐水(0.9%NaCl溶液)相比,使用平衡溶液被视为危重患者一种更安全的选择。
现已证实允许性低血压可以降低创伤死亡率。最新研究表明允许性低血压不会增加AKI的发生率[32]。因此,ICU医生推荐危重患者平均动脉压(MAP)≥65 mmHg。升压药通常用于创伤后低血压阶段,与其他升压药相比,休克患者使用血管紧张素Ⅱ维持血压可以减少AKI的发生和改善其严重程度,并为难治性血管麻痹提供了一种潜在的治疗方法[33]。
横纹肌溶解相关的AKI预防措施包括识别和治疗潜在病因(缓解骨筋膜室综合征)以及保持一定的尿量以减少肾小管中管型生成。目前临床上主要使用袢利尿剂维持尿量>2 ml/(kg·h)和1.26%碳酸氢盐来碱化尿液[34]。高容量血液滤过或超高通量血液透析的证据仅限于病例系列报告中。
预后
对不同危重患者群体的研究表明,AKI与较高的死亡率和CKD风险增加有关[35]。AKI对创伤患者预后的影响与在其他危重患者组中观察到的不利影响一致。然而,AKI与死亡率和肾功能恢复之间的独立因果关系错综复杂。最近的两项系统综述显示,创伤相关AKI的总死亡率为27%,合并AKI的创伤患者死亡相对风险增加了3.6倍,且随着AKI严重程度的增加,死亡率呈上升趋势[1-2]。
小结:创伤相关AKI在临床上十分常见,且与患者的不良预后密切相关。未来需要精心设计相关研究,深入理解该并发症的临床表型、病理生理学特点和长期预后,进一步探索新的预防和干预治疗措施,以改善此类患者的临床结局。

