免疫低危肾移植受者切换为西罗莫司治疗的远期疗效
伍倩倩 陈劲松 程东瑞 倪雪峰 徐 峰 李 雪 谢轲楠 文吉秋
2009年,改善全球肾脏病预后组织(KDIGO)建议联合钙调磷酸酶抑制剂(CNIs)、抗增殖药物,伴或不伴类固醇激素作为肾移植受者的主要免疫抑制方案[1]。目前,超过90%的肾移植受者采用基于CNIs为主的免疫抑制方案[2],但CNIs类药物所致的移植肾毒性、间质纤维化、小管萎缩[3]、新发恶性肿瘤[4]等并发症对移植肾预后的影响仍不可忽视。多项研究显示将CNIs类药物切换西罗莫司后移植肾功能保持稳定[5-6]甚至改善[7-8]。对于最佳切换人群,研究推荐合并恶性肿瘤、严重高血压、CNIs移植肾毒性、移植后糖尿病、溶血尿毒综合征及慢性移植肾肾病患者切换为西罗莫司[9],肾小球滤过率及蛋白尿可能是切换是否成功的关键[10]。因此,本研究拟报道对于肾活检证实的免疫低危受者,观察CNIs类药物切换为西罗莫司的远期疗效及不良反应。
对象和方法
研究对象入选标准:(1)切换前采用CNIs+麦考酚酸(MPA)类药物为基础的免疫抑制剂方案;(2)移植肾活检未提示急、慢性排斥反应,包括抗体介导的排斥反应及T细胞介导的排斥反应;(3)切换前蛋白尿<1 g/24h。
排除标准:(1)术前高致敏受者;(2)二次或者多次肾移植受者;(3)西罗莫司服药时间<1年;(4)已失访>1年。
急性和慢性排斥反应的诊断参照《Banff 2017》标准[11]。
免疫抑制剂切换方案入组患者由原来的CNIs[他克莫司(FK506)/环孢素A(CsA)+吗替麦考酚酯(MMF)+泼尼松或CNIs+西罗莫司+MMF+CsA切换为西罗莫司+MMF+泼尼松。所有受者服用西罗莫司时间及于国家肾脏疾病临床医学研究中心随访时间至少>1年。西罗莫司服用方法:首日6 mg,次日起2 mg/d,每天上午11:30服药,目标谷浓度在5~8 ng/ml,根据浓度来调整剂量。
观察资料收集患者的临床基本资料、换药前后血小板、血红蛋白、三酰甘油、胆固醇、血糖、谷丙转氨酶、谷草转氨酶、血清白蛋白、总蛋白、尿蛋白及群体反应性抗体(PRA)水平。纳入患者切换前、切换时、切换后的血清肌酐(SCr)。患者切换一年及末次随访/停药时西罗莫司的平均浓度;随访中出现新发排斥反应、新发PRA阳性、新发蛋白尿、肺部感染等不良事件情况。收集并分析重复移植肾活检结果。
统计学分析使用《SPSS 26.0》软件进行统计分析,《Graphpad Prism 8.0》软件作图。计量资料以均数±标准差或中位数(四分位间距)表示,计数资料以例数(百分数)表示。正态资料满足方差齐性且箱线图未发现极端值时采用重复测量方差分析,并行两两比较(经Bonferroni法校正),其中不满足Mauchly’s球形假设采用Greenhouse-Geisser方法校正。非正态分布资料或箱线图存在极端值时行非参数Friedman检验。生存资料采用Kaplan-Meier法进行描述,并采用log-rank检验对生存曲线进行比较。通过point-biserial相关性分析及二分类Logistic回归联合比值比(OR值)对相应变量行相关性分析。P<0.05为差异有统计学意义。
结 果
基线资料共入选38例活检证实的免疫低危受者。根据活检原因,分为常规活检组(12例),指征活检组(26例,因SCr升高行指征肾活检)。所有患者基线数据见表1。

表1 38例免疫低危肾移植受者的基线数据
移植肾活检提示2例合并血栓性微血管病样损伤,1例合并IgA肾病。切换前,所有患者均为人类白细胞抗原(HLA)Ⅰ及Ⅱ类抗体阴性。总体服用西罗莫司时间为80.71±41.37月(12~194月)。长期随访中共9例停西罗莫司,原因包括新发群体反应性抗体阳性(3例)、SCr升高或蛋白尿加重(2例)、新发排斥反应(1例)、慢性移植肾肾小球病(1例)及不明(2例)。
临床指标变化情况切换前、后各阶段血小板、胆固醇、三酰甘油、血清白蛋白及总蛋白水平具有统计学差异(表2);血糖、血红蛋白、谷丙转氨酶及谷草转氨酶水平无统计学差异。血小板及血清白蛋白水平仍在正常范围内。有13例患者胆固醇高并予降脂治疗,其中多数患者末次随访或停药时指标正常。
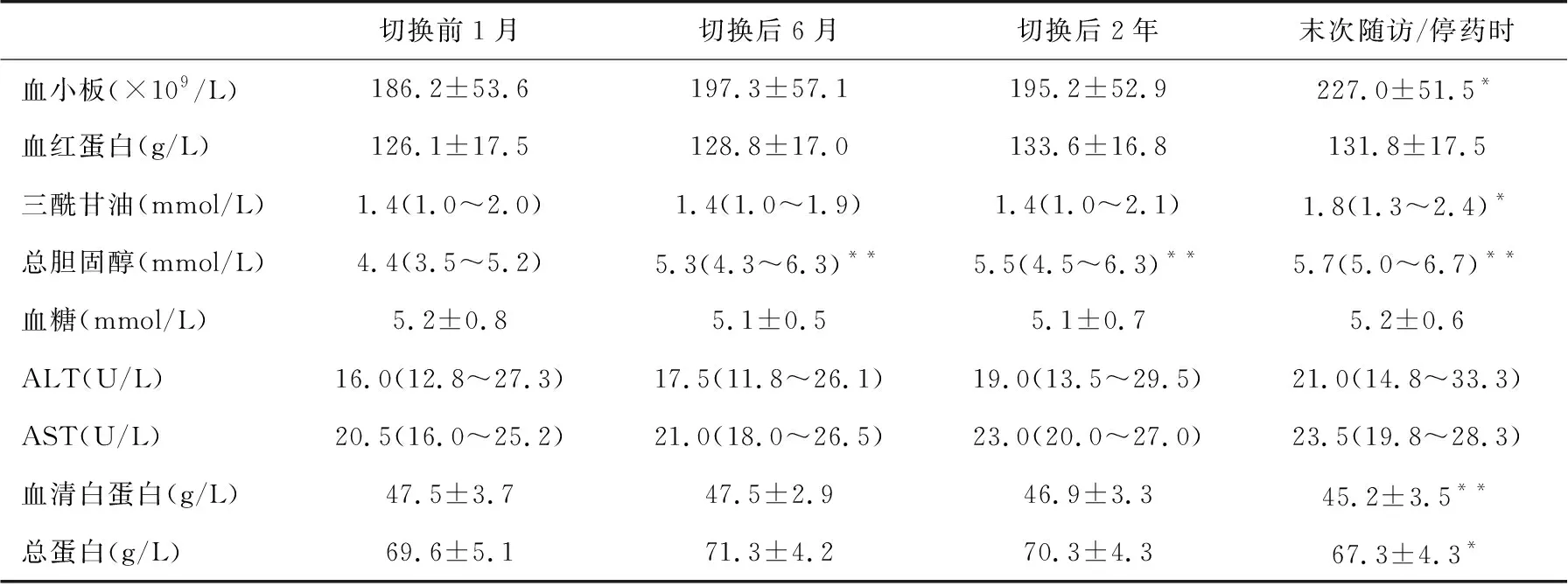
表2 转换前后血液检查指标比较
SCr变化切换后SCr水平总体呈下降趋势。常规活检组(图1A)切换后SCr长期保持稳定,切换4年后SCr显著下降(P<0.001),中位SCr水平为111.38 μmol/L;至末次随访或停药时,指征活检组(图1B)切换后SCr明显下降(P<0.001),末次随访时中位SCr降至123.76 μmol/L,3例受者后期SCr升高,其中1例病程中发生移植肾急性排斥反应,1例出现慢性移植肾肾小球病,另1例因未行活检原因不明。

图1 常规活检组(A)与指征活检组(B)切换前后SCr变化SCr:血清肌酐;与切换前比较,*:P<0.01,**:P<0.001
不良事件长期随访过程中, 7例新发PRA阳性,其中2例为供体特异性抗体(DSA),2例非DSA,3例不明;3例PRA-I类阳性经干预后转阴。2例出现经活检证实的急性抗体介导的排斥反应(Banff评分:GradeⅠ,Grade Ⅱ)。切换后共有新发尿蛋白18例,出现尿蛋白的中位时间为28月(0.5~104月),其中多数患者(72%)最高蛋白尿水平仅为±~1+,且7例患者经门诊处理后蛋白尿水平有不同程度降低。随访期间可见新发高三酰甘油血症(8例),新发高胆固醇血症(13例),肺部感染(5例),肺间质纤维化(1例),带状疱疹(2例),尿路感染(3例)。
换药后移植肾生存分析以切换西罗莫司为随访起点,截止2021-01-24,38例患者共随访253.93人年,中位随访时间为75.3(54.5~102)月,以移植肾失功为终点事件绘制Kaplan-Meier曲线。36例患者未发生移植肾失功,末次随访SCr水平为120.22±29.17 μmol/L。共2例患者发生移植肾失功,5年及10年移植肾存活率分别为96.7%与92.8%(图2)。2例移植肾失功受者均在指征活检组,在服用西罗莫司28月及34月后出现新发PRA阳性及新发排斥反应,确诊排斥反应的19月、37月后开始血液透析。
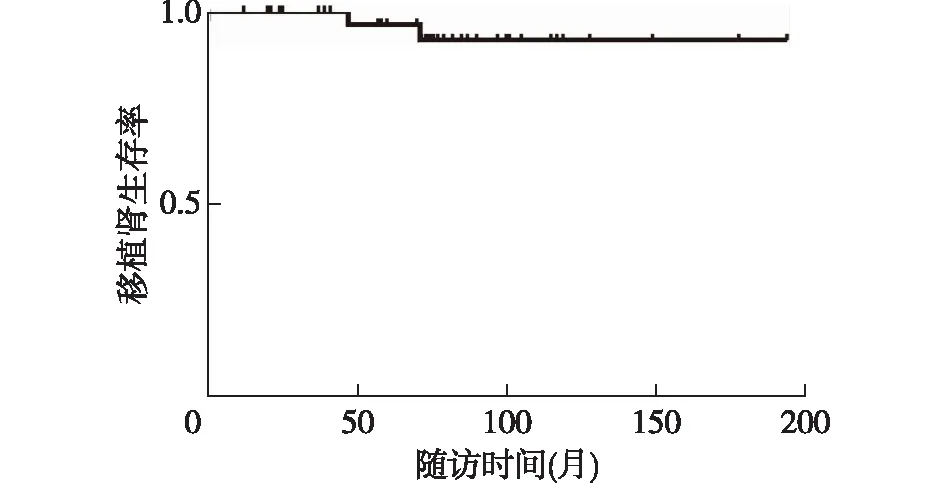
图2 切换后移植肾Kaplan-Meier生存曲线
相关因素分析以停西罗莫司为结局事件,Kaplan-Meier生存分析显示,切换前蛋白尿情况显著性影响西罗莫司的服药时间(log-rank检验,P=0.004)。切换前SCr>176.8 μmol/L与新发排斥反应相关(OR=7,95%CI 1.03~47.54,P=0.046)。切换一年和末次随访或停药时,平均西罗莫司浓度分别为7.06±1.28 ng/ml和6.58±0.88 ng/ml。平均西罗莫司血药浓度与不良事件无显著相关性(P>0.05)。
切换前后重复活检结果对比共7例于切换后行移植肾重复穿刺活检,5例未见排斥反应征象,2例因新发PRA阳性行移植肾活检提示急性抗体介导的排斥反应,1例患者于切换前活检示移植肾CNIs毒性及肾小球内血栓形成,切换为西罗莫司后活检未见明显血栓。
讨 论
本研究38例肾移植受者西罗莫司服药时间为80.71±41.37月,最长达194月。研究发现,这类患者大部分远期预后良好,切换后多数患者SCr较前平稳下降;移植肾长期生存率高,仅2例患者后期出现移植肾失功,这可能与其切换前血SCr水平较高有关(271.39 μmol/L与213.04 μmol/L)。
西罗莫司是一种哺乳动物雷帕霉素靶蛋白(mTOR)抑制剂,与CNIs相比,西罗莫司的移植肾毒性相对较小。但有多个报道其可引起急性排斥[12]、肺部感染、肺间质纤维化及其他感染的风险上升[13],蛋白尿加重[14],移植肾功能不断恶化等不良反应[15]。目前,针对中国人群,基于活检证实的低免疫风险人群将CNIs类药物直接切换为西罗莫司的报道甚少,且随访观察时间不长。本中心自2000年开始对此类免疫低危患者予以切换西罗莫司,回顾性分析显示将CNIs类药物切换为西罗莫司安全有效,且长期预后良好。本研究发现切换后18例出现新发蛋白尿。然而,在其长期随访中最高蛋白尿水平多数为1+,且7例患者经门诊处理后蛋白尿情况较前好转,这提示可通过一定的干预措施稳定尿蛋白水平。同时,我们发现切换前蛋白尿阳性患者(9例)中有4例(44.4%)后期停西罗莫司,蛋白尿阴性患者(29例)中有5例(17%)后期停用西罗莫司,两者服用西罗莫司时间存在显著性差异。本组部分新发PRA阳性患者可经干预转阴(3例,43%),因此建议切换后应行常规移植肾活检及定期筛查PRA,早期明确诊断以调整治疗方案提高移植肾生存率。
Sayin等[8]发现SCr水平较低的患者换为西罗莫司后肾功能较稳定,而SCr>176.8 μmol/L的肾移植受者切换后移植物失功风险较高。本研究发现切换前1月高SCr水平(>176.8 μmol/L)与发生排斥相关事件(活检证实的排斥反应及新发PRA阳性)有关。我们在长期随访中未发现患者出现新发肿瘤,这可能与西罗莫司的抗肿瘤作用有关[16-17],但也研究表明mTOR抑制剂与CNIs类药物在引发恶性肿瘤方面无统计学差异[13-14]。期待未来大样本的随机对照试验去证实。
本研究存在不足:(1)属于回顾性研究,样本量相对较小。(2)切换前后重复移植肾活检人数较少,期待更大的前瞻性研究进行重复活检,以进一步明确切换效果。(3)本研究发现切换前1月高SCr水平(>176.8 μmol/L)与发生排斥相关事件相关,切换前已有蛋白尿人群服用西罗莫司持续时间较短,但由于本研究样本量相对较小,该现象不足以成为西罗莫司的转换标准,需大样本研究去验证。
综上所述,基于肾脏病理证实的免疫低危受者切换CNIs为西罗莫司后大多数受者SCr有不同程度的下降,且远期预后良好。常规活检者也可通过切换受益,因SCr升高而行移植肾活检者获益更多。要密切监测患者尿蛋白及血脂水平,定期筛查PRA以及重复移植肾活检,以便早期发现和及时调整免疫抑制剂。

