载脂蛋白E相关肾小球疾病的诊治进展
马 妍 综述 谢红浪 审校
载脂蛋白E(apolipoprotein E,apoE)是一种主要由肝脏合成的多功能蛋白,参与受体介导的脂蛋白摄取,在血浆清除脂蛋白过程中起着关键作用,可促进胆固醇的转运代谢,从而调节血脂水平,降低动脉粥样硬化性心血管疾病发生风险[1]。apoE基因多态性不仅影响apoE的功能,还可以引起脂质和脂蛋白代谢的紊乱,与老年性痴呆、心血管疾病的发生密切相关[1]。研究表明,apoE基因多态性可以影响apoE浓度及各类脂蛋白的再分布,参与慢性肾脏病的发生发展[2],同时apoEε2 等位基因是糖尿病肾病危险因素[3]。此外,apoE基因突变引起apoE结构异常和功能障碍参与了apoE2纯合子肾小球病和脂蛋白肾病(LPG)等肾小球疾病[4-5],将这类疾病统称为apoE相关性肾小球病,临床表现为蛋白尿、肾功能不全及脂蛋白代谢异常,血清apoE浓度显著增加等。
apoE结构、功能与基因多态性
apoE是由19号染色体上的apoE基因编码的含有299个氨基酸的糖蛋白,相对分子质量34 200,主要在肝脏合成,其他组织细胞如脑星形胶质细胞、肾脏系膜细胞、脂肪细胞和巨噬细胞也可合成。近来研究表明,肾小球系膜细胞也可分泌apoE[6]。apoE可分为2个结构域,每个结构域具有不同的结构和功能。N端结构域包含识别低密度脂蛋白(LDL)受体和硫酸乙酰肝素糖蛋白(HSPG)的位点,C端结构域与脂质结合密切相关[7]。apoE 通过C端结构域与三酰甘油、胆固醇结合,共同组成极低密度脂蛋白(VLDL)、中密度脂蛋白(IDL)及一部分高密度脂蛋白(HDL)[7]。肠道分泌的乳糜微粒及肝脏分泌的VLDL 进入血循环后被脂蛋白脂肪酶分解,脂蛋白残余颗粒上的 apoE 可以通过 HSPG 通路或者与肝细胞内 LDL受体结合,被肝脏摄取,从而降低血循环中血脂水平。apoE还可影响 VLDL 颗粒的产生、VLDL 肝内组装和分泌,apoE基因过表达可造成 VLDL、三酰甘油过度产生,导致高三酰甘油血症[8]。因此,apoE在脂蛋白代谢中起核心作用(图1)。

图1 载脂蛋白E(apoE)不同区域的基因突变
LPG相关apoE基因突变常发生于LDL受体结合位点(氨基酸136~150)或其周围,尤其是在硫酸乙酰肝素糖蛋白(HSPG)结合位点(氨基酸142~147)。位于HSPG结合位点的突变(apoE Tokyo/Maebashi/Sendai/Chicago)见图1红色区域。LDL受体结合位点外的突变(如apoE1/E2/E4/E5/Toyonaka)见图1蓝色区域。
肾脏apoE主要由肾小球系膜细胞产生,研究表明,apoE基因缺失小鼠肾小球系膜扩张[6]。apoE可抑制生长因子以及LDL等各种刺激引起的肾小球系膜细胞增殖,抑制氧化低密度脂蛋白(oxLDL)诱导的系膜细胞凋亡,其可能机制是通过上调系膜细胞HSPG的表达,发挥抗系膜细胞增殖和基质扩张作用。apoE基因缺失小鼠可以有严重的高脂血症伴肾小球炎症,表现为内皮细胞活化、泡沫细胞浸润、巨噬细胞募集等[9]。以上证据提示apoE与肾脏疾病密切相关。
人类apoE基因有ε2、ε3、ε4三个等位基因,三个等位基因共显性表达组成六种基因型:纯合子apoE2/2,E3/3,E4/4及杂合子apoE2/3,E2/4,E3/4。分别编码apoE的三种异构体:E2、E3、E4。apoE3是最常见的亚型,占正常人群的70%以上,不影响脂蛋白代谢,apoE4亚型约占15%,可与富含甘油三酯的极低密度脂蛋白结合,导致LDL受体功能下调,增加LDL水平,与冠状动脉粥样硬化性心脏病发生相关[10]。apoE2亚型最为罕见约占8%,由于结构改变,受体结合区域功能受损,致其清除剩余脂蛋白能力减低,外源性和内源型的三酰甘油代谢受阻,进而引起高三酰甘油血症[10]。apoE1、apoE5和apoE7是已知的少见亚型,其中apoE5亚型与肾脏损伤有关[2]。
apoE相关肾小球疾病
膜性肾病样apoE沉积病膜性肾病样apoE沉积病是一种新认识的肾小球病,在apoE Toyonaka伴apoE2 纯合子携带者中发现。apoE Toyonaka为apoE(Ser197Cys)基因突变,目前仅有三例相关病例报道[11-13],这三例患者均表现为肾病综合征,伴镜下血尿,血清apoE水平增高,肾脏活检光镜下可见膜性肾病钉突样结构,电镜下可观察到肾小球基膜的上皮下、内皮下和系膜区大量电子致密物沉积(EDDs),与继发性膜性肾病类似。然而电镜下可见微泡和微囊的出现,免疫荧光可见非特异性IgG和C3沉积,表明这一疾病并非免疫复合物介导。免疫组化和串联质谱法提示肾小球基膜的EDDs中含有大量apoE,提示apoE突变与本病相关。可能机制为apoE2纯合子合并apoE Toyonaka突变时,apoE N端LDL受体结合区域功能障碍引起血清apoE升高,伴铰链损伤,C端结构区域结合脂质功能障碍,导致大量未与脂质结合的apoE在肾小球内积聚,由于apoE分子相对较小,富含携带正电荷的精氨酸,可以穿过肾小球基膜,在上皮下引起EDDs[14]。给予非诺贝特、普罗布考等降脂药物,以及泼尼松龙和环孢素A等治疗,可减少尿蛋白,但不能阻止肾功能减退。其中有2例[12-13]患者有明显高三酰甘油血症的Ⅲ型高脂血症(HLP),肾脏病理可见apoE2纯合子肾小球病特征的泡沫细胞浸润和非层状脂蛋白血栓脂蛋白栓子,提示apoE Toyonaka突变合并apoE2纯合子的携带者中,因为apoE Toyonaka突变在铰链区的影响不同,其病理表现可能具有非免疫性MN样病变和(或)apoE2纯合子肾小球病变特点。
apoE2纯合子肾小球病apoE2/2基因型为apoE(Arg158Cys)基因突变,约占人群的0.5%~1%,其携带者LDL受体代偿性表达上调,导致LDL胆固醇水平较低,因此95%的apoE2/2基因型表现为正常血脂或低脂血症,只有少数发展为Ⅲ型HLP[14]。人群中Ⅲ型HLP发生率为0.1%~0.01%,几乎所有的Ⅲ型HLP都是apoE2/2基因型[15]。其他因素,如糖尿病、高胰岛素血症、肥胖等与apoE2/2基因型共同参与Ⅲ型HLP[14]。全球报道了10例apoE2/2基因型引起的肾小球病变,8例临床表现为肾病综合征,2例表现为蛋白尿伴镜下血尿,其中5例伴随糖尿病,提示糖尿病可能在apoE2/2基因型纯合子肾小球病发生发展中起作用[16]。Sakatsume[4]等将这种apoE2/2基因型引起的肾小球病变称为apoE2纯合子肾小球病,组织学表现为肾小球硬化,肾小球毛细血管及系膜区明显的泡沫状巨噬细胞浸润,部分可出现非层状脂蛋白栓子或内皮下和上皮下非免疫性EDDs,可能源于Ⅲ型HLP异常脂质沉积(图2A、B)[15]。apoE2纯合子肾小球病表现为Ⅲ型 HLP伴血清三酰甘油、VLDL、 LDL增加, VLDL和LDL能够中和肾小球基底膜阴离子部分,引起肾小球基膜的电荷选择缺陷,促进了肾小球系膜细胞和巨噬细胞对脂蛋白的摄取,导致泡沫细胞形成和肾小球硬化,还可引起脂蛋白栓子[15]。内皮下非免疫性EDDs还可见于杂合apoE2/3基因型携带者[17],脂蛋白栓子和泡沫状巨噬细胞浸润也可见于杂合apoE2亚型和apoE Tokyo/Maebashi基因携带,apoE Tokyo/Maebashi基因也是LPG的代表性基因突变之一[18],以上可能提示复合杂合子可引起非典型的组织病理学改变。
apoE2亚型是1型和2型糖尿病发展为糖尿病肾病的重要危险因素。研究表明,在糖尿病肾病组apoE2等位基因频率为 7.69%,而对照组为 3.49%,携带apoE2等位基因的糖尿病患者,糖尿病肾病发生风险约为携带 apoE3等位基因糖尿病患者的2.2倍[3],且apoE2等位基因可增加肾小球病变的严重程度,导致肾小球肥大,加重肾功能损伤[19]。
脂蛋白肾病全世界大约报告了150例LPG病例,主要发生在日本和中国[5]。已发现10余种LPG相关apoE基因突变,呈常染色体显性遗传,在中国发现的LPG相关基因突变主要包括apoE Kyoto、apoE Tokyo/Maebashi、apoE Guangzhou和apoE Chengdu[20]。既往研究发现,LPG患者临床表现多为肾病综合征,患者可存在不同程度的镜下血尿,伴Ⅲ型HLP,但仅累及肾脏,不伴有高脂血症全身改变,病理表现为肾小球毛细血管扩张,伴非泡沫细胞的片状脂蛋白栓子形成,免疫荧光检查证实内含apoB和apoE,提示apoE与LPG相关[21](图2C、D)[22]。Oikawa等[23]对apoE基因进行分析,发现apoE基因突变与LPG的发生有关,大多数是与LDL受体结合位点相近的杂合apoE基因错义突变,最常见的是apoE-Sendai。然而,陈珊等[21]对17例LPG患者apoE基因全长序列分析研究中发现,与正常对照组相比,未发现存在apoE基因突变,提示可能无法单纯从apoE基因水平解释LPG发病,需要考虑从转录或蛋白表达水平综合研究apoE在 LPG中可能的作用。
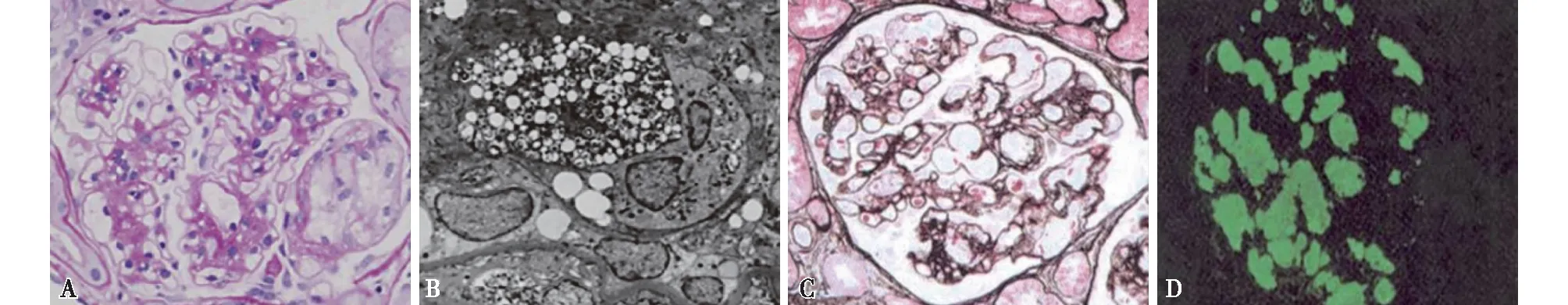
图2 apoE纯合子肾小球病(A、B)[15]及脂蛋白肾病(C、D)[21]肾活检病理表现 A:肾小球毛细血管中大量泡沫细胞浸润和肾小球系膜轻度扩张(PAS,×400);B:毛细血管中泡沫细胞浸润,脂蛋白栓子(EM,×2 000);C:肾小球系膜增生性病变,毛细血管扩张,伴片状脂蛋白栓子(PAS,×400);D:apoE染色阳性++,弥漫分布于毛细血管袢腔内(IF,×400)
apoE5亚型也可能与LPG相关。apoE5(Glu3Lys)是apoE的一个亚型,既往研究报道其与高脂血症和心血管疾病有关[24]。文献报道LPG病例中杂合子apoE5 携带率增加,且与LPG特异性突变如apoE Chicago或apoE Sendai相关,这些病例血清三酰甘油≥400 mg/dl[25],提示apoE5亚型导致的高三酰甘油血症很可能是LPG的触发因素。此外,Sasaki等[24]报道了一例携带apoE5(Glu3Lys)/E3基因型的局灶性节段性肾小球硬化(FSGS)患者,该患者存在高胆固醇血症和泡沫状巨噬细胞。既往的实验与临床研究证明,高脂血症可以通过影响巨噬细胞泡沫样变参与FSGS[26],因此apoE5(Glu3Lys)基因可能通过诱导高脂血症参与了FSGS的发展。这些发现表明apoE5亚型可能是脂蛋白肾病的潜在危险因素之一(表1)。

表1 apoE相关肾小球疾病特点
巨噬细胞参与apoE相关肾小球病
已知巨噬细胞浸润参与了FSGS过程,前文提示apoE2纯合子肾小球病也有巨噬细胞的参与,apoE5亚型相关的FSGS病例也提示了巨噬细胞浸润参与病变过程。巨噬细胞在apoE相关脂蛋白代谢中扮演各种角色,其功能损伤或活化参与了apoE相关肾小球疾病。在apoE2纯合子肾小球病中血LDL的升高促进肾小球系膜细胞或巨噬细胞对脂蛋白的吸收,使其在肾小球系膜区域浸润,促进了肾小球硬化的发生。而在LPG中脂蛋白栓子的形成却不伴巨噬细胞泡沫改变[27]。Kanamaru等[28]发现,在Fcγ受体小鼠缺陷的慢性移植物抗宿主病可导致LPG而不伴apoE异常,可能由于巨噬细胞对LDL的摄取减少所致。以上提示,与Fcγ受体功能障碍相关的巨噬细胞功能损伤可能是LPG发展的关键因素。由于携带apoE基因突变的apoE2纯合子肾小球病和LPG的遗传外显率较低,巨噬细胞功能改变可能是这些疾病的一个重要病因(图3)[29]。

图3 apoE纯合子肾小球病与脂质性肾病发病机制apoE:载脂蛋白E;LPG:脂蛋白肾病;LDL:低密度脂蛋白;黑色箭头显示,apoE基因突变可引起LDL的增加,影响apoE结构直接参与LPG;绿色箭头显示,apoE基因突变也可通过抑制巨噬细胞间接导致LPG;黄色箭头显示,apoE基因突变引起高脂血症可刺激巨噬细胞活化参与apoE纯合子肾小球病
apoE与心脑血管疾病
apoE2和E4亚型可改变脂质与受体结合,增加脑血管和心血管疾病的风险。高脂血症是动脉粥样硬化性心血管疾病的主要危险因素,apoE基因型、循环apoE浓度和心血管疾病(CVD)风险的相关性已得到证实[1],但Sofat等[30]的研究未能显示循环apoE浓度与心血管疾病有明显关联,提示apoE基因型带来的CVD风险可能是通过影响蛋白质功能而不是血液中的蛋白质浓度来实现的。apoE基因的多态性与阿尔茨海默病(AD)风险相关:携带ε4等位基因的个体比携带ε3等位基因的个体患AD的风险增加,而携带ε2等位基因的个体则罹患AD风险降低[31]。在正常衰老过程中,apoE ε4等位基因还增加了脑血管淀粉样变风险并与年龄相关认知能力下降有关[12]。
治疗和预后
apoE相关的肾小球疾病是基于apoE基因突变引起的脂蛋白变性介导的,尽管病理类型不同,通常都会发展为终末期肾病。目前认为免疫抑制治疗对LPG无效,LPG患者肾移植术后肾脏病变仍会复发。因此,有必要寻找合理有效的治疗手段。
药物治疗LPG通常与Ⅲ型HLP相关,富含甘油三酯的脂蛋白(如VLDLs和IDLs)是主要成分。因此,治疗Ⅲ型HLP对LPG患者十分重要。Hu等[20]和范文静等[32]证实了非诺贝特治疗LPG效果显著,可延缓肾功能不全的进展。非诺贝特也可用于apoE2纯合子肾小球病患者[14]。
此外在载脂蛋白E缺乏症(apoE-/-)小鼠模型中[33],长期低剂量吡格列酮可激活过氧化物酶体增殖物激活受体γ(PPARγ),调节血浆胆固醇和三酰甘油水平,显著降低主动脉粥样硬化、肝脂肪变性以及与衰老相关的肾小球硬化和间质纤维化。
血液净化治疗占锦峰等[22]证实了葡萄球菌蛋白A免疫吸附治疗的可行性,葡萄球菌蛋白A免疫吸附利用葡萄球菌蛋白A氨基末端有4个高度同源的Fc段结合区,可与人类血清中免疫球蛋白(Ig)分子Fc结合的特点,从而清除循环中的apoE及沉积于肾组织中的apoE,定期治疗能显著延缓肾脏病变进展。然而,重复免疫吸附治疗可致免疫球蛋白明显下降进而增加患者感染事件以及经济负担。因此,范文静等[34]提出双重血浆滤过(DFPP)清除apoE, DFPP可迅速降低血浆apoE水平及尿蛋白,3~10次DFPP治疗后重复肾活检可见肾小球毛细血管袢内脂蛋白栓子缩小甚至消失,提示DFPP是治疗LPG的有效手段。
Yang等[35]发现LPG患者接受他汀类或贝特类药物和血管紧张素受体阻滞剂以及血浆置换治疗后,其尿蛋白和血清脂质水平仅在短时间内缓解。随访期间,蛋白尿部分缓解(较基线降低50%)组的患者肾功能恶化较慢,提示蛋白尿可能是LPG患者肾功能恶化的风险指标,并且进一步表明,LPG患者降低尿蛋白治疗对于延迟肾功能不全进展至关重要。
小结:apoE是一种重要的载脂蛋白,在脂蛋白代谢中起着重要的作用。apoE突变引起的脂蛋白代谢异常涉及多种肾脏疾病,巨噬细胞的过度活跃和抑制也参与了这些疾病的发生发展。随着apoE基因突变的不断发现,不仅有助于在分子水平认识apoE相关肾病的发病机制,还为基因治疗和个体化药物治疗提供有效手段,延缓apoE相关肾小球疾病的发展。

