仿细胞膜结构聚合物涂层对醋酸纤维素膜透析器生物相容性的影响
史珂慧 王彦兵 高菊林 张 欢 宫永宽 蒋红利
血液透析是终末期肾病患者赖以生存的主要治疗方式。膜材料是血液透析的核心部分,由于生物不相容性,当膜与血液接触后体外循环(ECC)会发生凝血和机体炎症反应,不仅影响透析治疗效果,而且会降低患者的生存率[1]。对膜材料表面进行改性是提高生物相容性的一个重要策略。2甲基丙烯酰氧乙基磷酰胆碱(MPC)是含有磷酰胆碱基团的仿细胞膜结构磷脂聚合物,将MPC聚合物涂敷在材料表面可以提高材料的血液相容性[2-4],但是既往的MPC聚合物涂层由于不稳定性在使用的过程中可能会脱落[5]。体外实验发现,在MPC聚合物中加入多巴胺合成仿细胞膜和仿贻贝结构的“双仿生”聚合物,可以增加MPC聚合物涂层的黏附性,提高材料的抗污性能[6-10]。然而目前该类聚合物涂层还没有被用于透析器膜材料的改性。本研究将仿细胞膜和仿贻贝结构的MPC/对硝基苯氧羰基聚乙二醇甲基丙烯酸酯/多巴胺(PMNC)聚合物涂敷在醋酸纤维素(CA)透析器膜表面,通过体外、体内序贯性实验研究该聚合物涂层对透析器生物相容性的影响。
材料和方法
PMNC聚合物合成参照Gong等[6]合成方法合成PMNC聚合物。
涂层构建将10 mg PMNC聚合物溶解在10 ml蒸馏水中,用饱和碳酸钠溶液将pH值调整至8.5,配置成1 mg/ml的PMNC聚合物溶液,将CA膜浸泡在上述溶液中120 min,80℃加热交联8h,然后蒸馏水洗涤。
将1 mg/ml PMNC聚合物水溶液注入透析器[容积75 ml、面积1.3 m2、超滤系数10 ml/(h·mmHg)],浸涂2h,抽出溶液后加热干燥(80℃,24h),蒸馏水洗涤后真空干燥,改性后的透析器用环氧乙烷消毒后备用。
涂层稳定性评估将不同量的PMNC聚合物溶解于3.5%伦拿灵溶液中,检测液体表面张力,并绘制伦拿灵溶液表面张力随PMNC聚合物浓度变化的标准曲线图。将PMNC涂层改性后的CA膜在伦拿灵溶液中浸泡12h后检测溶液表面张力,并根据标准曲线图计算溶液中的PMNC聚合物含量,观察PMNC聚合物涂层是否从CA膜表面脱落到伦拿灵溶液里。
体外蛋白质吸附实验将蛋白质工作液与BCA工作试剂等体积混匀,60℃显色60 min;紫外分光光度计测量各溶液的吸光度值(562 nm),绘制蛋白质工作曲线;将无涂层与PMNC聚合物涂层CA膜样品置于PBS溶液中平衡120 min;PBS洗涤;滤纸吸掉多余的PBS;将样品分别浸入4.5 mg/ml牛血清白蛋白(BSA)溶液及0.3 mg/ml 纤维蛋白原(Fib)溶液中;二氧化碳培养箱中37℃培养120 min;依次用PBS和蒸馏水洗涤;将样品置于装有2 ml 1%SDS水溶液的烧杯中超声解吸附20 min;取1.5 ml解吸液,加入等体积BCA工作试剂,60℃显色60 min;紫外分光光度计测定溶液在562 nm处的吸光度值,代入蛋白质工作曲线,通过解吸液中蛋白质浓度计算蛋白质在样品上的吸附量。
动物体内实验该实验由本校实验动物伦理委员会批准进行。实验比格犬共6只,体重9~12 kg,分为PMNC聚合物涂层组和无涂层组,采用交叉实验方法,洗脱期为2周。3%戊巴比妥钠溶液(30 mg/kg)腹腔注射麻醉,经股静脉留置双腔中心静脉导管(8.5Fr)。羟乙基淀粉130/0.4氯化钠注射液预充管路及透析器,股静脉导管动脉端引血,血液在压力泵的作用下流经透析器经股静脉导管静脉端输回体内。ECC时间为120 min,若有部分凝血则提前结束。血流速度90 ml/min,血液保存液(4%枸橼酸钠)在透析器前180 ml/h持续泵入,葡萄糖酸钙溶液经外周静脉补充,检测透析器前、后血液的钙离子浓度,使透析器后的钙离子浓度为透析器前的30%左右。ECC结束后拔除股静脉插管,局部按压至少30 min直至伤口不渗血。分别于ECC 0 min、5 min、15 min、30 min、60 min及120 min采集血样,检测血液中血小板(PLT)、白细胞(WBC)和红细胞(RBC)计数及Fib、β血小板球蛋白(β-TG)、白细胞介素8(IL-8)、凝血酶-抗凝血酶复合物(TAT)、补体片段5a(C5a)和凝血酶原片段1+2(F1+2)等浓度。ECC 120 min后,用2 000 ml生理盐水冲洗循环管路和透析器,观察透析器的凝血情况。
统计学方法使用《IBM SPSS Statistics 24》软件对原始数据进行整理并做统计学分析,以均数±标准差表示计量数据,使用t检验比较两组计量数据之间的差异,P<0.05为差异具有统计学意义。
结 果
涂层稳定性图1A所示为伦拿灵溶液表面张力随PMNC聚合物浓度变化的标准曲线。将PMNC聚合物涂层CA膜在伦拿灵溶液中浸泡12h,结果显示浸泡前后液体的表面张力无明显变化(P>0.05),提示PMNC聚合物涂层具有优异的生物稳定性见图1B。

图1 PMNC聚合物涂层醋酸纤维素膜在伦拿灵中浸泡前后液体表面张力
蛋白质吸附实验结果在4.5 mg/ml BSA溶液中浸泡120 min后,无涂层CA膜与PMNC聚合物涂层CA膜BSA吸附量分别为(0.31±0.08) μg/mg和(0.06±0.02) μg/mg,两者相比有明显差异(P<0.01)(图2A)。同样,在0.3 mg/ml FIB溶液中浸泡120 min后,无涂层CA膜FIB吸附量为(0.45±0.03) μg/mg,而PMNC涂层CA膜仅为(0.08±0.01) μg/mg(P<0.01)(图2B)。PMNC聚合物涂层使CA膜对BSA和FIB的吸附量分别下降了81%和82%。
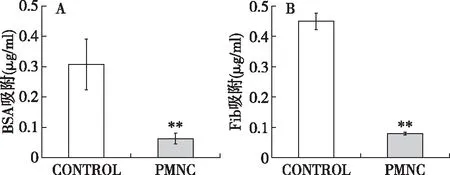
图2 无涂层CA膜和PMNC聚合物涂层CA膜对BSA及FIB的吸附CONTROL:无涂层组;CA:醋酸纤维素;BSA:牛血清白蛋白;Fib:纤维蛋白原;**:无涂层组和PMNC聚合物涂层组比较,P<0.01
透析器凝血情况ECC 120 min后,无涂层透析器可见较多红色的凝血纤维束,而PMNC聚合物涂层改性透析器则为白色几乎没有血栓形成(图3)。以上结果表明,PMNC聚合物涂层可以减轻CA膜表面的凝血现象。

图3 体外循环120 min后透析器凝血情况A:无涂层透析器;B:PMNC聚合物涂层透析器
纤维蛋白原吸附与凝血激活如图4A所示,ECC 5 min时无涂层组和PMNC聚合物涂层组FIB浓度较ECC前分别下降了25%和7%(除去血液稀释影响16%),两组相比有统计学差异(P<0.01),而且ECC 120 min时这种差异依然存在。F1+2和TAT都是凝血反应的早期产物。ECC后两组TAT浓度和F1+2浓度均较ECC前有所增加,而无涂层组上述指标增加幅度更明显。120 min时无涂层组TAT浓度达峰值(6.70±0.50)ng/ml,是ECC前的2.45倍,而PMNC聚合物涂层组TAT浓度为(3.84±0.73) ng/mL,两组间比较有显著性差异(P<0.001)(图4B)。在整个ECC过程中,虽然无涂层组F1+2浓度上升的趋势比PMNC聚合物涂层组更明显,但是两组之间比较没有统计学差异(P>0.05)(图4C)。
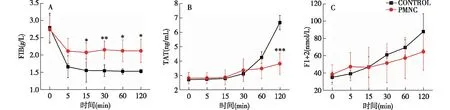
图4 体外循环中Fib、TAT、F1+2变化Fib:纤维蛋白原;TAT:凝血酶-抗凝血酶复合物;FH2:凝血酶原片段H2;CONTROL:无涂层组;PMNC聚合物涂层组和无涂层组比较,*P<0.05,**P<0.01,***P<0.001
PLT吸附与激活如图5A所示,ECC 5 min时两组PLT均出现下降,30 min时无涂层组和PMNC聚合物涂层组PLT下降率分别为13%和1%(除去血液稀释影响),两组比较有统计学差异。ECC 30 min后两组PLT计数逐渐达到平台期。β-TG是血小板活化的标志物之一,无涂层组β-TG浓度在ECC 5 min时开始上升,30 min时达峰值(为ECC前的1.95倍),之后则逐渐下降,而PMNC聚合物涂层组β-TG浓度仅轻度上升,两组比较有显著性差异(图5B)。
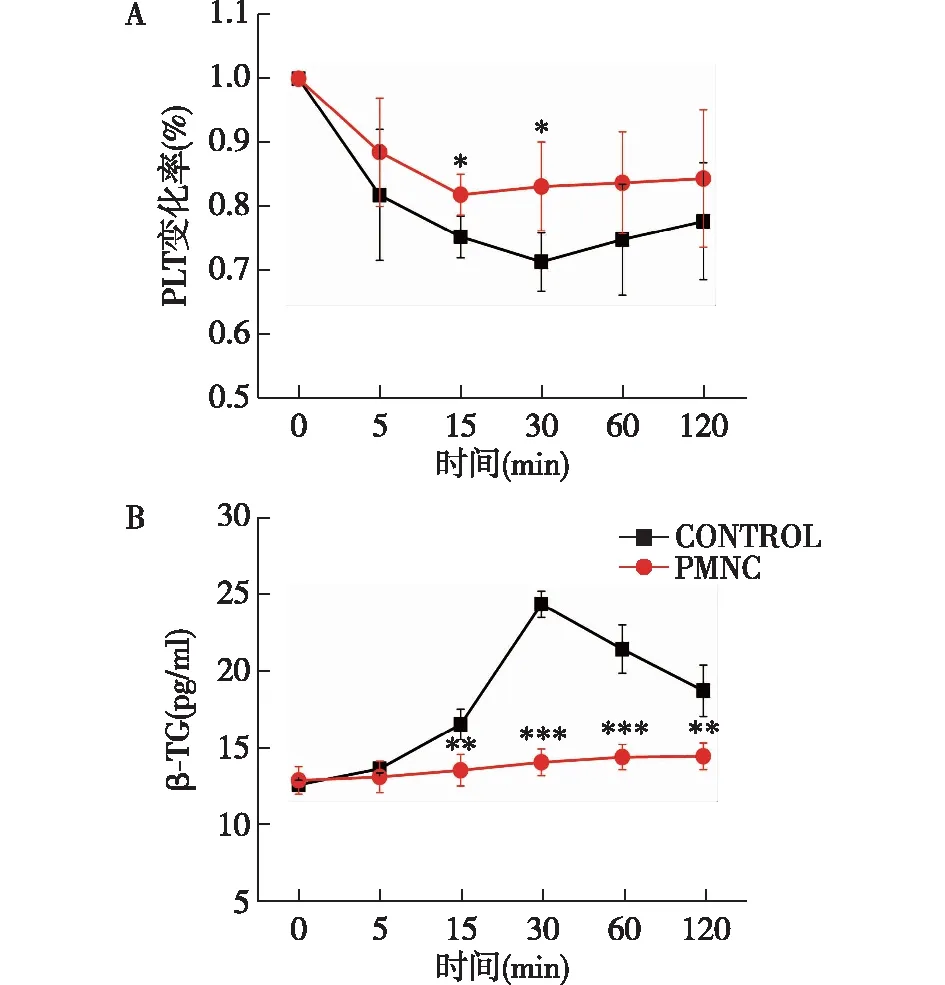
图5 体外循环中PLT下降率和β-TG浓度变化PLT:血小板;β-TG:β血小板球蛋白;CONTROL:无涂层组;PMNC聚合物涂层组和无涂层组比较,*P<0.05,**P<0.01,***P<0.001
白细胞吸附与激活如图6A所示,ECC开始后两组WBC计数均下降,30 min时无涂层组和PMNC聚合物涂层组WBC下降率分别为41%和8%,组间比较有统计学差异,120 min时两组WBC均基本恢复至ECC前水平。C5a和IL-8分别是补体和WBC激活的标志物之一,ECC 15 min时,无涂层组C5a和IL-8浓度急速上升达峰值,分别是ECC前的3.71倍和4.99倍,而PMNC聚合物涂层组C5a和IL-8浓度则无明显变化,两组比较有明显差异(图6B、C)。
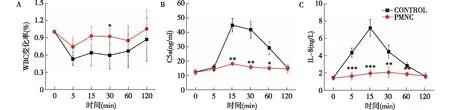
图6 体外循环中WBC、C5a、IL-8变化WBC:白细胞计数;C5a:补体片段5a;IL-8:白细胞介素8;CONTROL:无涂层组;PMNC聚合物涂层组和无涂层组比较,*P<0.05,**P<0.01,***:P<0.001
红细胞及血红蛋白(Hb)吸附在整个ECC过程中, PMNC聚合物涂层组RBC变化率、红细胞压积(HCT)、Hb等相关指标均无明显变化,与无涂层组相比亦没有差异(图7)。以上说明PMNC聚合物涂层并不增加红细胞消耗或者不会引起溶血,安全性较好。
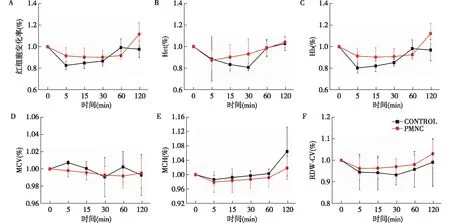
图7 ECC中红细胞及相关指标变化ECC:体外循环;Hct:红细胞压积;Hb:血红蛋白;MCV:平均红细胞体积;MCH:平均血红蛋白含量;RDW-CV:红细胞宽度CV值
讨 论
透析器膜接触血液后,会迅速激活凝血反应、补体反应和炎症反应,在膜表面形成血栓并堵塞透析膜微孔,严重影响透析效果甚至使血液透析无法顺利进行。本研究将仿细胞膜结构PMNC聚合物涂敷在CA膜表面,并通过体内外实验揭示了PMNC聚合物涂层具有优异的稳定性,可以显著抑制纤维蛋白原吸附,并减少血小板和白细胞的黏附及激活,从而提高CA膜透析器的血液相容性。
研究表明,吸附Fib是透析器凝血的始动因素[11-14]。本研究发现,PMNC聚合物涂层可以使CA膜对Fib的吸附量下降82%。TAT是凝血反应的早期产物,检测血浆中的TAT浓度可以反映ECC的凝血状态[15]。在ECC实验中无涂层组TAT浓度上升明显,而PMNC聚合物涂层组TAT始终无明显变化。ECC 120 min后无涂层透析器可见较多凝血纤维束,而PMNC聚合物涂层改性透析器则几乎没有血栓形成。由此推测PMNC聚合物涂层可能通过显著抑制Fib吸附,从而减轻CA膜表面的凝血反应。
血小板聚集和活化是凝血过程中的关键环节,β-TG是血小板活化的标志物之一。在本研究中无涂层组PLT计数在ECC 30 min时下降了13%,与Verbeelen等[16]的研究结果类似,而PMNC聚合物涂层组PLT计数仅下降了1%。无涂层组β-TG浓度在ECC 30 min时达峰值较ECC前升高了1.95倍,而PMNC聚合物涂层组β-TG浓度仅轻度上升。既往研究发现使用聚砜膜透析器透析4h能使血液中β-TG浓度升高至少7.4倍[17]。由此可见,聚砜膜对血小板的活化程度似乎较CA膜更强,而PMNC聚合物涂层能够减轻CA膜表面对血小板的聚集和活化。
当血液与透析膜接触时,即可发生补体激活[18]。本研究中PMNC聚合物涂层组C5a浓度较无涂层组明显降低,说明PMNC聚合物涂层可以显著抑制CA膜对补体的激活,然而Cheung等[19]却发现肝素涂层能够增强CA膜对补体的激活,似乎说明在免疫抑制方面PMNC聚合物涂层更优于肝素涂层,但是仍需要更多的实验数据来支持。研究表明,补体激活后产生的C3a和C5a可以促进白细胞黏附于膜表面并被激活释放组织因子等影响凝血反应[20-25]。IL-8是WBC激活的标志物。本研究发现,在ECC中无涂层组WBC下降和IL-8浓度上升程度均显著高于PMNC聚合物涂层组。据此推测PMNC聚合物涂层可能通过抑制补体激活从而减少CA膜对WBC的吸附和激活。
由于透析器膜材料具有生物不相容性,在血液透析过程中常使用肝素防止凝血,有出血风险的患者则使用枸橼酸局部抗凝。一项前瞻性研究比较血液透析时使用肝素和枸橼酸抗凝对生物相容性的影响,结果发现肝素组C5a浓度轻度升高、WBC无明显变化,而枸橼酸组C5a浓度显著升高、WBC明显下降[26]。由此可见,肝素可以抑制透析膜引起的补体激活及WBC减少,而枸橼酸对补体和WBC的影响较小,能够更客观地反映膜材料的血液相容性,所以在本研究ECC过程中使用枸橼酸抗凝。
小结:仿细胞膜结构PMNC聚合物涂层具有优异的稳定性,能够抑制CA膜表面对纤维蛋白原的吸附、对血小板和白细胞的黏附及激活,显著提高透析器的生物相容性,以上结果为进一步将PMNC聚合物涂层应用于医疗器械的表面改性提供了重要的实验依据。

