儿童X-连锁肾上腺脑白质营养不良39例临床特征分析
韦紫倩 林晓滨 李淑梅 蔡燕娜 邵咏贤 程 静 梅慧芬 郑锐丹 梁翠丽 刘鸿圣 江 华 江敏妍 刘 丽
广州医科大学附属广州市妇女儿童医疗中心(广东广州 510623)
X-连锁肾上腺脑白质营养不良(X-linked adre-noleukodystrophy,X-ALD)是一种由过氧化物酶体遗传缺陷引起的脂质代谢性疾病,呈X-连锁隐性遗传。编码过氧化物酶膜蛋白(ATP binding cassette subfamily D member 1,ABCD 1)基因ABCD 1位于Xq28[1],其发生变异时,肾上腺脑白质营养不良蛋白(adrenoleukodystrophy protein,ALDP)生成缺陷,无法将极长链脂肪酸(very long-chain fatty acids,VLCFAs)转运进过氧化物酶内进行β氧化,从而在脑白质、肾上腺皮质等组织器官中堆积[2],引起脑白质脱髓鞘、肾上腺功能不全等病理变化。本文回顾分析39例X-ALD患儿的临床资料,分析其临床特征、治疗及预后。
1 对象和方法
1.1 研究对象
回顾分析2011年至2018年广州市妇女儿童医疗中心确诊的X-ALD 患儿的临床资料。研究对象入选标准:①<18岁;②符合X-ALD诊断标准;③获取家长和/或患儿知情同意。排除标准:①血浆VLCFAs未见升高;②行ABCD 1基因变异分析为阴性者;③X-ALD女性携带者。
X-ALD诊断依据[3-4]:①进行性神经系统受累症状,如步态不稳、认知障碍、视力下降等;②肾上腺皮质功能减退症,如皮肤色素沉着、皮质醇水平降低、促肾上腺皮质激素(ACTH)水平升高;③血浆VLCFAs异常升高;④头颅磁共振成像(MRI)显示脑白质脱髓鞘病变;⑤基因分析提示ABCD1基因存在致病变异;⑥符合X-连锁隐型遗传模式。其中,符合①~⑥者确诊为儿童脑型X-ALD,符合②③⑤⑥者确诊为单纯肾上腺型X-ALD。根据致病基因ABCD1碱基变异类型,将儿童脑型X-ALD患者分为碱基替换组及缺失、重复组两组。
1.2 方法
1.2.1 临床资料收集 收集患儿的发病年龄、确诊年龄、临床表现、实验室检查、头颅MRI检查、ABCD1基因变异分析、治疗与随访等资料。
1.2.2 实验室检查 对疑似X-ALD 患儿进行检查的项目包括血浆VLCFAs、血浆皮质醇、ACTH 和血气、电解质。血浆VLCFAs包括二十六烷酸(C26:0)、二十四烷酸(C24:0)和二十二烷酸(C22:0),另外还计算C22:0与C26:0比值(C26:0/C22:0)和C24:0与C22:0比值(C24:0/C22:0),并将其作为筛查指标。VLCFAs 采用同位素标记气相色谱-质谱联用定量法(gas chromatographic mass spectrometric,GC-MS)检测,血浆皮质醇、ACTH由化学发光分析仪测量。
1.2.3 基因分析 采集患儿外周血2 mL,采用聚合酶链式反应(PCR)扩增ABCD 1基因编码区,利用ABI 3730 DNA分析仪对PCR产物进行直接测序,所得结果与NCBI 上的ABCD 1序列进行比对,并利用Polymorphism Phenotyping v2(PolyPhen-2,http://genetics.bwh.harvard.edu/pph 2/)分析新发变异的 致病性。1.2.4 Loes 评分 根据1994 年Loes 等[5]针对脑型X-ALD 患者建立的Loes 评分,对头颅MRI 白质病变累及部位,如胼胝体、脑桥、丘脑、枕叶、额叶等进行疾病严重程度评分。采用Loes评分对脑型患儿大脑的萎缩程度、白质病变范围以及位置进行评估。
1.3 统计学分析
采用SPSS 21.0统计软件进行数据分析。符合正态分布的计量资料以均数±标准差表示;非正态分布计量资料以中位数(四分位数范围)表示,两组间比较采用Wilcoxon秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
纳入39例患儿,其中儿童脑型X-ALD 27例,单纯肾上腺型X-ALD 12例。中位发病年龄6.0(4.0~7.0)岁,中位确诊年龄6.0(5.0~8.0)岁。儿童脑型X-ALD中位发病年龄6.0(5.3~7.8)岁,中位确诊年龄7.0(6.0~8.0)岁;单纯肾上腺型X-ALD中位发病年龄3.0(1.0~6.0)岁,中位确诊年龄5.0(2.8~7.5)岁。其中2例单纯肾上腺型X-ALD患儿经过数年演变成儿童脑型X-ALD。
2.2 临床表现
27例儿童脑型X-ALD 患儿主要表现为:①运动功能障碍,包括步态异常17例、抽搐7例、肢体乏力3例、运动发育迟缓1例;②认知功能损害,表现为学习成绩下降、记忆力下降、注意力不集中、反应迟钝的智力减退16例,性格改变8例;③视听功能损害和语言障碍,包括视力下降或视物模糊15例、听力下降9例、书写困难5例,表现为语速减慢、吐字不清等语言表达能力下降12例。12例单纯肾上腺型X-ALD患儿,10例表现为皮肤色素沉着,2例无明显临床表现。27例儿童脑型患儿首发与确诊时的临床症状有变化,其中有步态异常患儿由33.3%增至63.0%,智力减退者由37.5%增至59.3%,视力下降或视物模糊者由37.5%增至55.6%,语言表达能力下降者由16.7%增至44.4%。此外有听力下降、皮肤色素沉着、性格改变、抽搐、书写困难、肢体乏力者均增加。
2.3 实验室检查
39例X-ALD患儿C26:0水平均升高,20例C24:0升高;所有患儿C26:0/C22:0和C 24:0/C 22:0 均较正常值升高。27例儿童脑型及2例单纯肾上腺型演化为儿童脑型患儿C 26:0/C 22:0 中位数 0.07 μmol/L(正常值<0.013 μmol/L),C 24:0/C22:0中位数2.15 μmol/L(正常值<1.04 μmol/L)。
2.4 影像学检查
27例儿童脑型X-ALD 患儿均有脑白质受累,头颅MRI表现为受累部位T2WI呈高信号,病变区域为对称性,主要累及胼胝体、幕上白质区(包括额、顶、枕、颞叶)、视觉通路,听觉通路、投射纤维所在区域和小脑。12例单纯肾上腺型患儿,除2例演化为儿童脑型者外,其余无头颅影像学改变。由影像科医师对患儿进行Loes评分[5]。在脑型(含2例由肾上腺型演化者)患儿中,Loes评分9分以下25例,9分以上3例,1例患儿影像学检查结果缺如。
2.5 基因检测
39例X-ALD患儿均行ABCD1基因检测。在29例脑型(含2例由肾上腺型演化者)患儿中,碱基替换17例,缺失11例,重复1例;在10例单纯肾上腺型患儿中,碱基替换5例,缺失3例,插入2例。所有患儿中发现3 个新发变异,分别为c.578C>G(p.Prp193Arg)、c.1615 A>C(p.Met 539 Leu*)和c.2_5 dupTGCC(p.Pro 2=fs*),均未见报道,未被X-ALD 数据库(www.x-ald.nl)收录。通过Polyphen 2 软件预测,c.578C>G和c.1615A>C很可能致蛋白质功能受损;c.2_5dupTGCC可使终止密码子提前出现,形成截短蛋白,影响ALDP蛋白质合成,推测可能致病。
2.6 基因型与临床表型分析
在脑型患儿(含2例由肾上腺型演化者)中,18例为碱基替换组(其中1例影像学检查结果缺失),Loes评分为6.00(4.00~7.75)分;11例为缺失、重复组,Loes 评分3.00(1.00~5.00)分,两组间Loes 评分差异有统计学意义(Z=2.19,P=0.028),碱基替换组患儿的Loes评分高于缺失、重复组。
2.7 治疗及预后
39例患儿均给予氢化可的松替代治疗,2例出现继发性癫痫给予安定、卡马西平等对症处理,5例行异基因造血干细胞移植(allogenic hematopoictic stem cell transplantation,HSCT)治疗。对患儿的随访包括间隔6个月的定期复诊和电话追踪,截至2020年10月。9例患儿死亡,其中2例于行HSCT后死亡;30例存活。接受HSCT 治疗的患儿中,3例术后病情平稳,2例于术后2个月和1年死亡;4例移植术后血浆 VLCFA 较前下降,但未恢复至正常水平,2例神经系统症状较术前有加重,2例病情平稳。见表1。
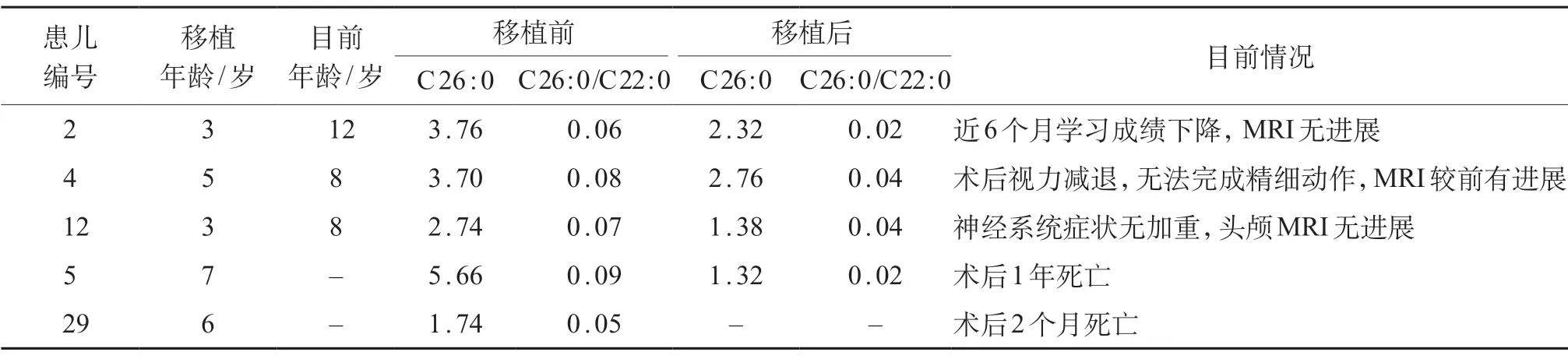
表1 脑型患儿移植前后情况
3 讨论
根据发病年龄、临床表现,X-ALD分为7种类型,包括儿童脑型、青少年脑型、成人脑型、肾上腺脊髓神经病型(adrenomyeloneuropathy,AMN)、单纯肾上腺型、无症状型以及女性杂合子。本研究39例患儿均为男童,首诊时有27例为儿童脑型X-ALD,12例为单纯肾上腺型X-ALD。单纯肾上腺型X-ALD患儿间隔3~6个月检查头颅MRI,其中2例于确诊后1年和3年出现不同程度神经系统受累,由单纯肾上腺型X-ALD向儿童脑型X-ALD转变。儿童脑型X-ALD平均发病年龄与平均确诊年龄相近(仅相差4个月);单纯肾上腺型X-ALD中位发病年龄与中位确诊年龄相差2年,提示该临床表型起病隐匿,容易被忽视。这是因为儿童脑型X-ALD常以认知、视力、运动障碍为首发表现,表现为学习成绩下降、注意力不集中、口齿不清、走路步态异常,甚至出现反复抽搐,引起家长重视而就医;但单纯肾上腺型X-ALD 仅以皮肤黏膜色素沉着为主要表现,部分患儿曾因此至皮肤科就诊。一旦发生神经系统病变,病程即呈进行性发展,本研究儿童脑型X-ALD首发症状和确诊时临床表现存在差异,在短时间内神经系统受累症状均有不同程度加重,表明儿童脑型X-ALD病情进展迅速。
因X-ALD 的临床症状不典型,且进展速度快,因此临床医师需提高警惕,对出现类似症状者作排除性诊断[6]。对于皮肤色素沉着者,或出现视、听觉损害,认知、运动障碍者,需仔细行神经系统体检及皮质醇、ACTH、VLCFAs、头颅影像学检查。ABCD1基因变异导致ALDP 缺陷,使VLCFAs 不能转运进入过氧化物酶体进行β-氧化进一步分解代谢,故细胞和血浆内VLCFAs 增高,尤以C 24:0 和C 26:0增高明显。因此,脑型X-ALD 患者头颅MRI 表现较典型,大多表现为胼胝体压部、幕上白质区、视通路的对称性脱髓鞘改变,而单纯肾上腺型X-ALD 脑部无脱髓鞘改变,但应每3 个月复查头颅MRI,以早期识别单纯肾上腺型X-ALD 向脑型X-ALD 转变 可能[3]。
ABCD1基因分析为确诊X-ALD的金标准[7]。本研究39例X-ALD 患儿均发现基因变异,同时发现3个新发变异。c.578 C>G(p.Pro 193 Arg),造成第193号位的非极性氨基酸脯氨酸变为极性氨基酸精氨酸,氨基酸性质改变影响过氧化物酶ALDP的功能,导致VLCFAs堆积[7];c.1615A>C(p.Met539Leu*)变异,造成539 号蛋氨酸被亮氨酸取代,蛋氨酸可以通过S腺苷甲硫氨酸提供活性甲基,减少ALDP的活性甲基从而致病;c.2_5dupTGCC(p.Pro2=fs*)移码变异可使终止密码子提前出现,形成截短蛋白,推测截短蛋白将降低ALDP 酶活性[8],但需进一步功能学验证。此外,由于X-ALD为X-连锁隐性遗传,因此对于确诊患者,若有同胞兄弟,需积极筛查,同时对患儿父母提供遗传咨询[9]。
既往文献报道,不同碱基变异类型的特征性代谢产物C26:0水平有统计学差异,插入或缺失变异组的C 26:0 水平显著高于碱基替换组[10]。本研究分析了ABCD 1基因变异类型和Loes 评分之间的关系。变异类型为碱基替换的儿童脑型X-ALD 患儿,发病和确诊年龄均比缺失、重复组晚,Loes 评分亦高。可以推测,由于非碱基替换组的变异大多导致终止密码子提前出现,形成截短蛋白,后者可能残存部分ALDP 活性,因此神经系统受损相对较轻;同时由于缺失、重复组的发病年龄相对较早,比碱基替换组患儿发病提早1年,最终导致Loes评分相对较低,存在HSCT的适应证。
X-ALD治疗主要为对症治疗和HSCT[11]。对于单纯肾上腺型X-ALD,由于存在肾上腺皮质功能低下,可予氢化可的松替代治疗;早期儿童脑型X-ALD,即Loes评分低于9分者,可行HSCT治疗。随访研究发现,早期HSCT可降低血液及脑组织中VLCFA浓度,延缓病情进展,提高X-ALD患儿生存率及生活质量。但中晚期儿童脑型X-ALD 以及脊髓神经病型X-ALD,目前尚无有效方法阻止病情进展[12-14]。

