不同类型胰腺导管内乳头状黏液性肿瘤的MRI表现
祁光蕊 陈俊波 胡开艳
胰腺导管内乳头状黏液性肿瘤(intraductal papillary mucinous neoplasm,IPMN)是一种罕见的胰腺导管上皮来源的良性、交界性或低度恶性肿瘤,主要发生于主胰管或分支胰管[1],可以有或没有乳头状突起。IPMN根据病灶累及部位不同分为3种类型:主胰管型、分支型及混合型[2]。经内镜逆行性胰胆管造影术(endoscopic retrograde cholangiopa ncreatography,ERCP)可以通过内镜直接观察到病灶的乳头状结构及分泌的黏液,很长时间以来一直作为IPMN诊断的金标准[3]。但ERCP是有创检查,不适合作为诊断的首选检查方法;而高分辨率MRI检查方法简便,可清晰显示扩张胰导管内的乳头状结构,对IPMN的定性诊断有较大价值。本文分析IPMN的MRI表现,以期为临床对IPMN进行影像诊断并指导治疗提供参考。
1 临床资料
1.1 一般资料 回顾性分析2015年3月至2018年12月宁波市鄞州区第二医院收治的经病理学检查确诊IPMN的患者19例,男14例,女5例;年龄30~74岁,平均年龄60.6岁。其中主胰管型5例,分支型13例,混合型1例。临床表现无明显症状偶然发现8例,右上腹胀痛5例,全身乏力4例,体重下降、脂肪泻2例。
1.2 MRI检查方法 MRI检查设备为康达Apsaras 1.5T超导MRI扫描仪。扫描序列:(1)T1WI采用基于肝脏容积加速采集(LAVA)序列,重复时间(TR)4.25 ms,回波时间(TE)1.94 ms,层厚 5 mm,无层间距,视野 320 mm×320 mm~440 mm×440 mm,矩阵 224×320。对比剂钆-二乙烯胺五乙脂(Gd-DTPA)0.1 ml/mg,注射速率2 ml/s,经肘正中静脉由高压注射器注入,然后以同样流速注射20 ml 0.9%氯化钠注射液冲洗。注射对比剂后22、55、180 s分别行动脉期、静脉期及延迟期扫描。(2)横断面抑脂呼吸触发T2WI序列,TR 5454.5 ms,TE 75 ms,层厚7.5 mm,层间距8.5 mm,视野350 mm×350 mm,矩阵224×28[4]。(3)厚层块二维磁共振胆管成像(magnetic resonance cholangiopancreatography,MRCP)序列,TR 186 ms,TE 2.9 ms,层厚 4.5 mm,层间距 5.5 mm,视野350 mm×350 mm,矩阵288×288。
1.3 MRI诊断标准 (1)主胰管明显扩张,测量其最宽处,判断主胰管扩张的标准为胰头>5 mm,胰体>4 mm,胰尾>3 mm[5];(2)判断有无壁结节,及壁结节大小、是否有强化;(3)胰腺实质萎缩,判断萎缩的标准为胰头<20 mm,胰体或胰尾<10 mm[6];(4)其他情况:胰管内多数无钙化,胰腺实质多数不钙化。
1.4 结果 19例IPMN患者中主胰管型5例,主胰管扩张有的呈弥漫性,也有的呈节段性,有1例扩张主胰管内未见明显乳头状结构;在T1WI上扩张胰管呈低信号,T2WI上呈高信号。分支型13例,位于胰头8例,胰尾4例,胰体部1例;分支型病灶呈多囊状改变,T1WI呈低信号,T2WI呈高信号,其内可见分隔样改变,分隔在T1、T2上均呈低信号。MRI增强扫描18例患者可见胰管内轻中度强化的肿瘤结构,呈长T1长T2信号,也可以有多个乳头状肿瘤影。MRCP显示主胰管明显扩张,分支型病灶显示与主胰管相通。1例混合型主胰管及分支胰管内均可见肿瘤结构。典型主胰管型IPMN患者MRI表现见图1,典型分支型IPMN患者MRI表现见图2。

图1 1例男性62岁典型主胰管型胰腺导管内乳头状黏液性肿瘤(IPMN)患者MRI表现[a:T1WI增强图像,示主胰管不同程度扩大,管壁有张力,内见呈等信号中度强化肿瘤结节影(箭头所示);b:T1WI增强图像,示主胰导管扩张,内见多个等信号的中度强化的结节影(箭头所示)]
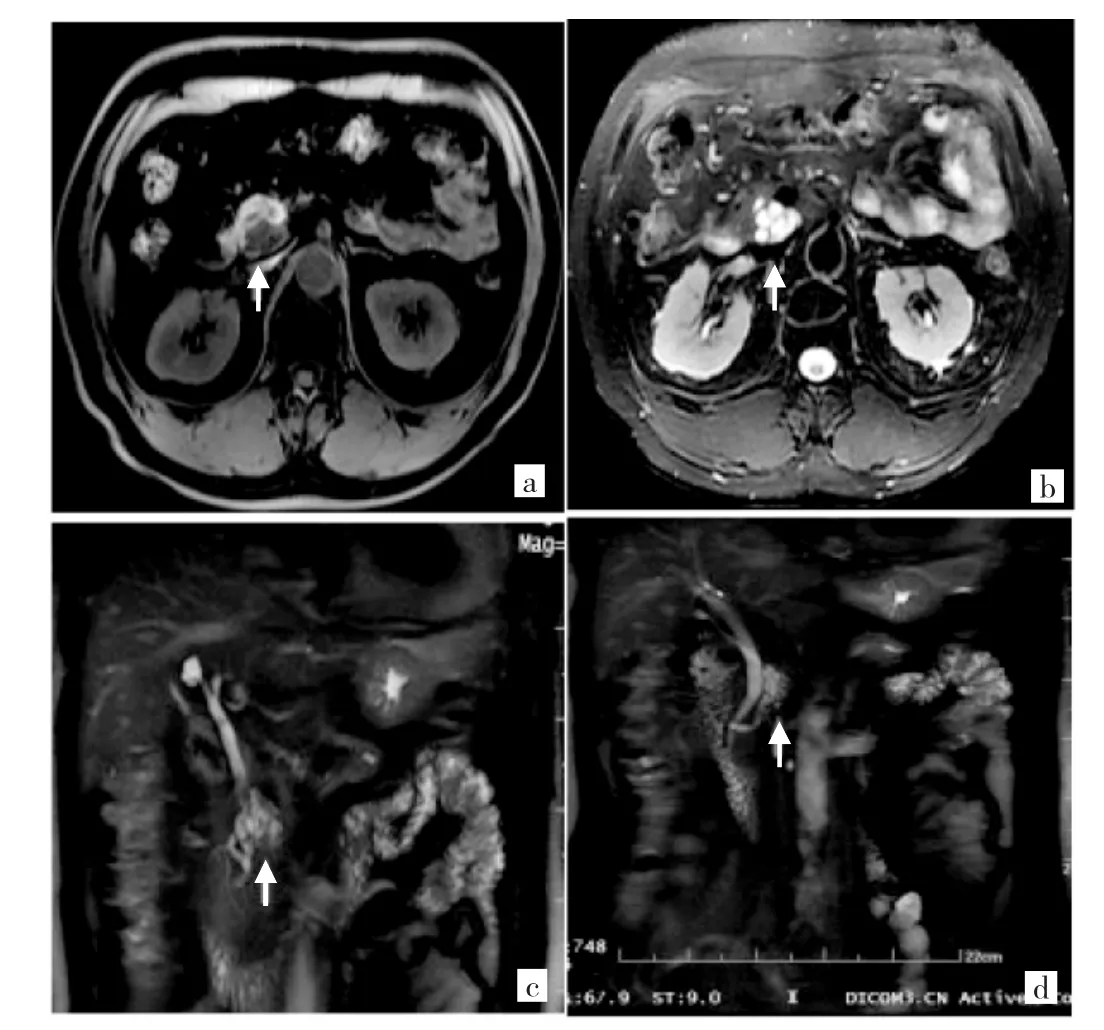
图2 1例男性69岁典型分支型胰腺导管内乳头状黏液性肿瘤(IPMN)患者MRI表现[a:T1WI图像,分支型IPMN,胰头钩突部显示多囊状低信号影,边界较清晰,分隔呈低信号(箭头所示);b:同一层面的T2WI图像,病灶呈多囊状高信号,其内分隔稍低信号;c、d:磁共振胰胆管成像图片,病灶与主胰管相通(箭头所示)]
2 讨论
IPMN是胰腺导管上皮来源的良性、交界性或低度恶性肿瘤,较罕见,男性多于女性,50~70岁常见,约占胰腺囊性肿瘤的10%左右[7]。IPMN由日本学者首先发现,并对此病进行了影像学描述。由于IPMN常产生大量黏液而引起胰管明显扩张,并且可见其内的乳头状肿瘤结构,1996年WHO将其命名为IPMN。IPMN多数无典型临床表现,甚至长期无症状,多数患者为偶然发现。本研究中19例患者中偶然发现的为8例;临床表现缺乏特异性,多表现为腹胀、腹部隐痛、腰背部放射痛等[8]。其中,中上腹痛较常见,本研究19例患者中上腹部隐痛5例;其他症状包括腹泻、浑身酸痛、体重减轻等,本组患者中腹泻2例,其余均是因其他疾病发生偶然发现的。患者随着病程迁延进展及胰管梗阻的加重,导致胰腺实质萎缩,胰腺分泌功能逐渐减退,出现脂肪泻和体重减轻。主要治疗方法是手术切除,即使是交界性的肿瘤,预后也较好。
IPMN的病理改变十分复杂,但最基本的病理改变是胰腺导管内的乳头状肿瘤结构分泌黏液导致主胰管及分支胰管不同程度扩张。根据肿瘤的发生部位将IPMN分为3型,类型不同,影像学表现完全不同。分支型:较常见,一般单发,也有多发病例;分支型良性居多,病灶多发生于胰头钩突部。本组13例患者中有8例位于胰头,4例位于胰尾部,1例位于胰体部;MRI常表现为多房或者单房囊性肿块,多房常见,呈分叶状、哑铃状、球星或葡萄状,多囊状病灶是由多个直径1~2 mm的小囊汇合而成,单囊型多是由一个囊组成,单囊病灶囊通常较多囊者大。由于病灶多数是良性,所以病灶边界清晰,邻近的主胰管常出现扩张改变,对IPMN的诊断有提示意义。增强扫描囊壁、分隔和壁结节可见强化,结节的强化程度略高于囊壁。MRCP能清楚显示胰管扩张的程度,并可显示病灶与胰管的关系,与胰管相通这也是分支型IPMN的诊断要点。主胰管型相对少见,并且有恶性倾向,主要表现是主胰管扩张,扩张胰管有明显张力,管壁光滑连续,少有串珠样改变,胰管内多数不会出现钙化;局限性扩张的胰管可发生于胰腺任何部位,并且胰腺体部和尾部常见,胰头较少见;胰管内分泌的液体较黏稠,所以信号稍欠均匀并且略高于水的信号;扩张胰管内可见壁结节,增强扫描壁结节呈轻至中度强化,壁结节可以单发也可以多发;常常出现胰腺实质的萎缩。混合型IPMN常常同时具备主胰管型和分支型IPMN两种类型的影像学表现,即主胰管明显扩张,并可见多囊状的囊性结构;混合型IPMN主胰管扩张可以是弥漫性,也可表现局限性,其中局限性可呈现多个不连续的节段扩张。所以,熟练掌握各种类型IPMN的MRI表现,对此病的诊断有很大帮助。
IPMN临床上罕见,并且与其他常见疾病鉴别有一定困难,所以早期发现并作出正确诊断对疾病的预后有着至关重要的作用。Kawaguchi等[9]指出,当肿瘤直径>3 cm、乳头样肿瘤结构直径>0.5 cm是IPMN为恶性的一个主要征象。本研究19例患者中有1例主胰管直径为1 cm,胰管内肿瘤结节0.7 cm,手术切除后病理学检查结果为恶性。
分支型IPMN表现为多囊性结构,常与囊腺瘤、假性囊肿及囊腺癌等胰腺囊性病变表现类似[10],容易误诊。微囊型浆液性囊腺瘤是分支型IPMN最难鉴别的疾病,两者都可表现为多囊状结构,微囊性浆液性囊腺瘤好发于老年女性,其内信号更低,和主胰管不相通,其中心呈纤维瘢痕样改变,并且多数中心纤维瘢痕内钙化是其重要征象,而IPMN病灶中心无钙化,所以中心纤维分隔是否钙化也是两者一个主要鉴别点。黏液性囊腺瘤常见于中年女性,多见于胰腺体尾部,单囊多见,也可表现为多囊状,单囊病灶囊腔多较大,多数直径>2 cm,重要的是病灶不与主胰管相通。黏液性囊腺癌也是IPMN的一个主要鉴别疾病,当黏液性囊腺癌的实性成分少且有分隔时,与浆液性囊腺瘤及IPMN鉴别困难,当其实性成分较多时,因其为恶性病变,边缘多模糊,强化较明显,并且有时会有邻近脏器及结构的侵犯,与IPMN较易鉴别。胰腺假性囊肿多呈单囊,也可表现多囊状,重要是同主胰管不相通,极少数可与主胰管相通,但囊壁多较薄,边界较清晰,囊肿壁可钙化,其内信号多数较均匀,没有乳头状肿瘤结构,多有急性胰腺炎或胰腺外伤病史,结合病史可鉴别。
主胰管型IPMN主要表现为主胰管弥漫扩张,也可以节段性或多节段性扩张,所以主胰管型IPMN常常要与慢性胰腺炎、胆总管下段结石、胰头癌及胆总管下段癌导致的胰管扩张疾病相鉴别。IPMN和慢性胰腺炎两者均表现为主胰管的扩张和胰腺实质的萎缩[11],有时鉴别有一定的困难。有学者认为年龄、性别、饮食习惯等是诊断IPMN的重要参考因素,IPMN发病年龄一般略晚于慢性胰腺炎,有急性胰腺炎病史及长期饮酒、吸烟史的多考虑慢性胰腺炎[12]。在影像学上,慢性胰腺炎MRI显示胰管扩张多呈串珠状,形态不规则,并且胰管及胰腺实质多有钙化灶,有胰腺炎的病史;而IPMN胰管多呈现连续扩张、有张力,很少钙化;两者结合历史资料及病史可鉴别。胆总管下段结石、胰头癌及胆总管癌都是因为胆总管下段堵塞,引起上游胰管扩张,仔细观察MRI影像可发现梗阻原因,这类疾病导致的胰管扩张在解除梗阻原因后扩张的胰管可逐渐恢复。
综上所述,MRI检查可清晰显示IPMN的囊壁、壁结节及扩张胰管,MRCP可清楚显示扩张的胰管,并且通过多平面重建显示病灶与胰管的关系,对该病的确诊有十分重要的指导意义。

