新冠病毒核酸检测系统的性能验证及评价
韶 萌,刘春霞
(南通大学附属瑞慈医院检验科,南通 226010)
自2019 年12 月以来,世界各地陆续爆发了新型冠状病毒(coronavirus disease 2019,COVID-19)感染。该病毒为β 属冠状病毒,为有包膜的RNA 病毒[1],与重症急性呼吸综合征冠状病毒(severe acute respiratory syndromes coronavirus,SARS-CoV)高度同源,传染性强于SARS-CoV[2]。感染症状常表现为干咳、发热和乏力,严重的可发展为急性呼吸窘迫综合征、脓毒血症休克、难以纠正的代谢性酸中毒和出凝血功能障碍及多器官功能衰竭等。国家卫生健康委陆续发布了8 个版本的COVID-19 诊疗指南,均将病原学检测作为COVID-19 诊断的确诊指标,逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)是在日常工作中使用最广泛的检测方法[3]。为评估江苏硕世生物科技股份有限公司的核酸检测试剂使用乐普96 通道PCR 仪(Lepgen-96)检测结果是否能满足临床需求,本文依照中国合格评定国家认可委员会(China National Accreditation Ser vice for Conformity Assessment,CNAS)发布的CNASGL039《分子诊断检验程序性能验证指南》[4]进行了性能验证实验,并做出评估。
1 材料与方法
1.1 实验材料 本实验使用了卫生部2020 年第2次COVID-19 核酸检测室间质评活动发放的样本,江苏省临床检验中心2020 年第3 次COVID-19核酸检测室间质评活动发放的样本,样本均为基因工程方法制备的病毒样颗粒模拟样本。江苏硕世生物科技股份有限公司提供的含ORF1ab 基因、N 基因及内标片段的病毒样颗粒的阳性对照品。核酸提取及纯化试剂(批号:20201105)及核酸检测试剂盒(批号:20201119)均由江苏硕世生物科技股份有限公司生产。实时荧光PCR 仪为乐普科技Lepgen-96。
1.2 检测方法及结果判读 参照产品说明书,循环参数为:50 ℃10 min;97 ℃1 min;97 ℃5 s;58 ℃30 s,共45 个循环,并进行实时荧光检测。根据扩增曲线判读结果:ORF1ab 基因和N 基因通道Ct≤37且有明显指数增长期,结果判为阳性;37
1.3 验证方法和指标
1.3.1 阴、阳性符合率 10 例阳性样本采用卫生部室间质评及江苏省室间质评样本8 例,试剂阳性对照2 例;10 例阴性样本采用卫生部室间质评及江苏省室间质评样本各1 例,健康人咽拭子样本8 例,参照试剂盒产品性能指标阳性符合率100%,阴性符合率100%则符合指标。
1.3.2 精密度评价 使用1 例强阳性样本,1 例弱阳性样本每日重复检测5 次,连续检测5 d,共测定25 次。根据检测结果,分别计算2 例样本Ct 值的标准差(standard deviation,SD)及变异系数(coefficient of variation,CV),如CV<5%,则精密度符合要求。
1.3.3 最低检出限 依照试剂盒产品性能指标最低检出限≤350 copies/mL 的说明,使用定值为500 copies/mL 的江苏省室间质评样本与无核糖核酸酶水按7∶3 的比例混合,配置浓度为350 copies/mL的样本重复检测5 次,阳性检出率为100%,则符合要求。
1.3.4 特异性验证 将加入白色念珠菌菌株的样本保存液,加入金黄色葡萄球菌菌株的样本保存液及包含MRAS、HCoVOC43、HCoVHKU1、HCoV229E、HCo-VNL63RNA 病毒样颗粒(浓度均>1.0×104IU/mL)的江苏省室间质评样本复管3 次进行检测。均无扩增曲线则符合产品指标。
1.3.5 干扰物质 将一份弱阳性样本分为4 份,190 μL/份。实验组3 份分别加入新鲜血液(选取血红蛋白100 g/L 的样本,混合后血红蛋白质量浓度为5 g/L)、苯福平、阿奇霉素各10 μL。另有一份加入10 μL 无核糖核酸酶水作为对照。提取后重复检测3 次,实验组与对照组Ct 值的绝对偏差≤1.6 为符合要求[5]。
1.4 统计学方法 使用Excel 软件进行统计与计算。精密度采用CV 表示,计数资料采用率(%)表示,计量资料采用表示,P<0.05 为差异有统计学意义。
2 结 果
2.1 阴、阳性符合率 10 例阳性样本均有明显扩增曲线,且Ct 值<37。其中定值为200 copies/mL 的样本,ORF1ab 基因和N 基因Ct 值分别为36.56、35.11。阳性符合率为100%。10 例阴性样本均无扩增曲线,阴性符合率为100%。
2.2 精密度评价 强阳性样本ORF1ab 基因与N基因Ct 均值分别为22.47、23.58,CV 为1.26%、1.3%。弱阳性样本ORF1ab 基因与N 基因Ct 均值分别为34.15、34.31,CV 为1.24%、1.06%。CV 值均<5%,结果符合要求,见表1。
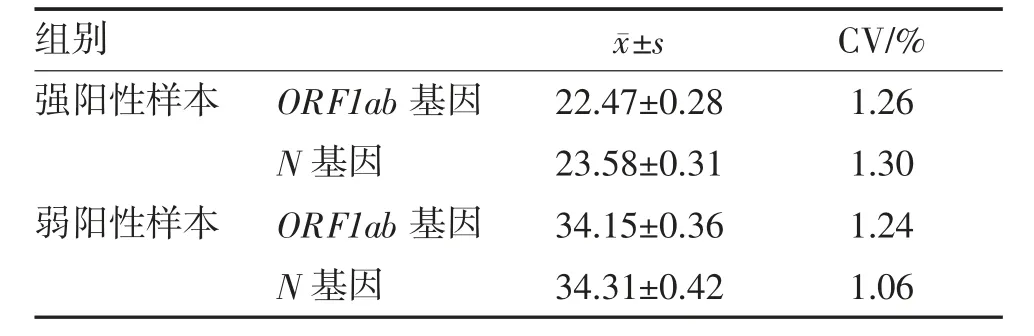
表1 两种样本精密度结果
2.3 最低检出限 重复检测浓度为350 copies/mL的样本5 次,Orf1ab 基因和N 基因均有明显扩增曲线且Ct 值<37,阳性检出率为100%,符合厂家性能指标,见图1A。
2.4 特异性验证 3 次复管在阴阳性对照管结果均正常的情况下,白色念珠菌样本、金黄色葡萄球菌样本及包含MRAS、HCoVOC43、HCoVHKU1、HCoV229E、HCoVNL63RNA 病毒样颗粒的样本均无扩增曲线,证明以上几种病原微生物均不存在交叉反应。
2.5 干扰物质 实验管与对照管的ORF1ab 基因、N 基因Ct 差值均<1.6,证明血红蛋白、苯福平及阿奇霉素不会对新冠病毒核酸结果产生明显干扰,验证结果符合要求。图1B~D 为3 次干扰实验的扩增曲线,表2 所示为通过计算得出的结果。

表2 干扰实验各组ORF1ab 基因及N 基因结果

图1 ORF1ab 和N 基因扩增曲线图
3 讨 论
始于2019 年底的新冠肺炎疫情是新中国成立以来,传播速度最快、感染范围最广、防控难度最大的重大突发公共卫生事件[6]。为防止疫情反复,国家卫生健康委在2020 年6 月8 日发布的《关于加快推进新冠病毒核酸检测的实施意见》中指出:要落实加快提升检测能力所需的人员、设备和资金,对重点人群要做到应检尽检[7]。依据文件要求,各级医疗机构陆续开展了COVID-19 的RT-PCR 检测,直接造成了美国应用生物、罗氏等常用的知名品牌实时荧光定量PCR 仪供应短缺,保有量相对较少的各种品牌PCR 扩增仪开始大量投入使用。黄玉兰等[8]发现扩增仪与试剂匹配性不好可能影响实验结果。采购新仪器,保证其检验结果能满足临床需求成为新仪器投入使用的必要先决条件。
COVID-19 核酸检测性能验证实验有助于新冠核酸检测的实验室质量管理,提高实验结果的可靠性。另外在控制检测结果的同时也需注意,日常使用的鼻咽拭子标本阴性结果并不能完全确定未感染COVID-19,普通棉签拭子的核酸检出率明显低于带病毒保存液的植绒拭子;咽拭子标本的阳性检出率也低于深咳痰液标本[9]。COVID-19 核酸结果结合临床及影像学结果综合判断,对疑似患者的确诊有重要意义[10]。
本研究通过使用乐普科技Lepgen-96 PCR 仪对硕世生物的新冠核酸试剂盒进行性能验证实验,证实了在该套系统下阴、阳性符合率为100%;弱阳性及强阳性标本的精密度均CV<5%;最低检出限与试剂盒注明的≤350 copies/mL 相符;与白色念珠菌,金黄色葡萄球菌、MRAS、HCoVOC43、HCoVHKU1、HCoV229E、HCoVNL63RNA 均不存在交叉反应;血红蛋白、苯福平及阿奇霉素不会明显干扰实验结果。结果表明使用乐普科技Lepgen-96 PCR 仪及硕世生物新冠核酸试剂盒对COVID-19 核酸进行检测符合率高,重复性好,最低检出限、特异性及抗干扰能力均能符合产品性能说明,可以满足临床需求。

