人脐带间充质干细胞生物急性毒性评测*
吴姚钰,沈 熙,宋 伟,吴 坚
(南通大学医学院组织学与胚胎学系,南通 226001)
干细胞是一类具有自我更新和多向分化潜能的原始细胞。干细胞在生物学领域被广泛研究,其在再生医学和治疗方面的潜力越来越受到关注[1-3]。干细胞治疗从实验室的基础研究发展至逐渐应用于临床的疑难病症[4-5]。目前,国内的各大三甲医院和科研院校积极合作,开展干细胞临床治疗研究。为了规范临床级人间充质干细胞制剂的质量,国家陆续出台了多项政策,其中《干细胞制剂质量控制及临床前研究指导原则》做了详细的规定。本研究检测领航干细胞再生医学工程有限公司提供的人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUCMSCs)悬液制剂的凝血性和溶血性,并通过尾静脉注射到小鼠体内,观察hUCMSCs 生物急性毒性反应,为进一步研究其慢性毒性、成瘤性、异常免疫反应等生物学安全问题,提供前期的数据支持。
1 材料与方法
1.1 体外凝血性实验
1.1.1 实验动物 新西兰兔(邳州市东方养殖有限公司),雄性,2 000 g。
1.1.2 主要材料和仪器 兔血,枸橼酸钠(草本源生物),CaCl2、凝血酶原时间(prothrombin time,PT)测定试剂盒、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)测定试剂盒(长岛生物)等。
1.1.3 实验分组 hUCMSCs 组:浓度为1×107/mL hUCMSCs,按低、中、高不同容量(0.1、0.25、0.5 mL)分别加入不同体积(2.4、2.25、2.0 mL)生理盐水,各取20 μL。生理盐水组:20 μL 生理盐水。自然凝血组:20 μL 非抗凝新鲜兔血。
1.1.4 PT 测定 新鲜兔血与3.8%枸橼酸钠按9∶1混合,3 000 r/min 离心15 min,取上层血浆,即贫血小板血浆。各取0.1 mL 分别加入各组样本,37 ℃孵育3 min,加入37 ℃预温PT 试剂0.2 mL,记录凝固时间,即为PT 值。
1.1.5 APTT 测定 同上法获得贫血小板血浆。各取0.1 mL 分别加入各组样本及37 ℃预温APTT 试剂0.1 mL,37 ℃孵育5 min,加入37 ℃预温0.025 mol/L CaCl2溶液0.1 mL,记录凝固时间,即为APTT 值。
1.2 体外溶血性实验
1.2.1 实验动物 新西兰兔(邳州市东方养殖有限公司),雄性,2 000 g。
1.2.2 主要材料和仪器 兔血、酶标仪(Biotek)等。
1.2.3 实验分组 浓度为1×107/mL hUCMSCs,按低、中、高不同容量(0.1、0.25、0.5 mL)分别加入不同体积(2.4、2.25、2.0 mL)生理盐水和2.5 mL 的2%兔红细胞混悬液中,同时以生理盐水和灭菌蒸馏水分别作为阴性和阳性对照。
1.2.4 实验步骤 取新鲜抗凝兔血2 mL,3 000 r/min离心5 min。弃上清,加入5 mL 生理盐水,吹散管底红细胞,3 000 r/min 离心5 min。重复以上步骤,直至离心后上清液透亮,取底部压积红细胞加入适量生理盐水,制备2%红细胞悬液。
将各组样品置于37 ℃恒温箱孵育0.5 h 后,加入2.5 mL 预热的2%红细胞悬液,37 ℃恒温箱继续孵育1 h,2 000 r/min 离心5 min,分别吸取上清于96 孔板中,100 μL/孔,使用酶标仪在545 nm 波长处检测吸光度值。溶血率=(样品吸收-阴性对照吸收)/(阳性对照吸收-阴性对照吸收)×100%。溶血率≥5%视为溶血。
1.3 体内急性毒性实验
1.3.1 实验动物 南通大学实验动物中心培育的ICR 小鼠,23~25 g,每组各时间点雌雄各半,各5 只。
1.3.2 主要材料和仪器 胰岛素注射针(尾静脉注射用)、软蜡(熔点50~52 ℃)、硬蜡(熔点56~58 ℃)、苏木精、伊红、石蜡切片机、正置显微镜(Leica)等。
1.3.3 实验分组 生理盐水组、hUCMSCs 高(1×108/kg)、中(2×107/kg)、低(2×106/kg)剂量组。
1.3.4 动物模型制备 经尾静脉注射hUCMSCs。饲养于屏障环境实验室,使用许可证号为SYXK(苏)2017-0046。连续观察2 周,记录动物的行为、毛色、呼吸、排便等,2 周后处死,取各系统主要脏器行石蜡包埋、切片、HE 染色观察。研究方案获南通大学实验动物伦理委员会批准。
2 结 果
2.1 hUCMSCs 未引起凝血异常 各组PT、APTT 比较差异均无统计学意义(均P>0.05)(表1),表明hUCMSCs未影响机体的凝血机制。
表1 各组PT、APTT 比较(,n=6)
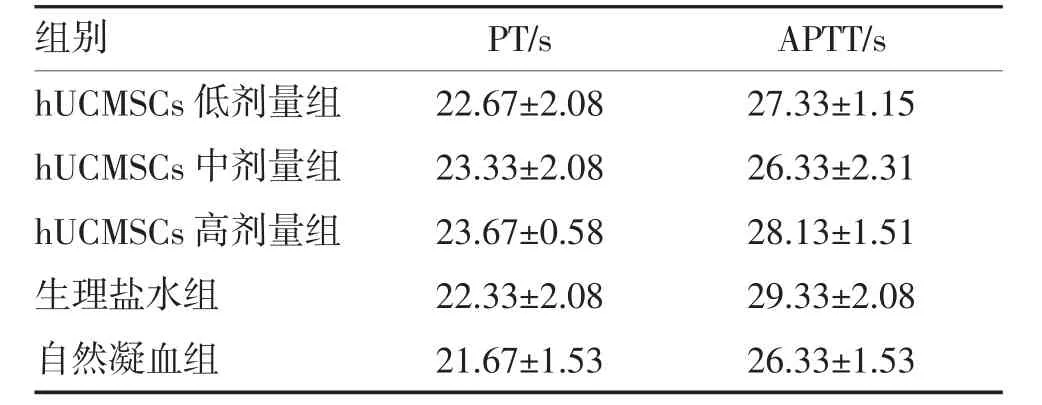
表1 各组PT、APTT 比较(,n=6)
2.2 hUCMSCs 未引起溶血反应 体外溶血性实验结果表明,低、中、高浓度的hUCMSCs 对兔血的溶血率均<5%(图1),说明均未引起溶血反应。
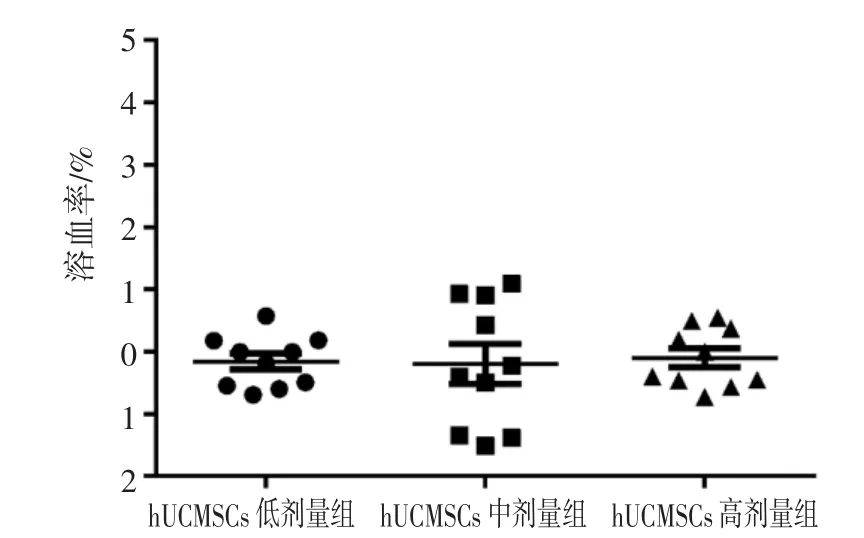
图1 不同剂量hUCMSCs 溶血性检测
2.3 hUCMSCs 未引起急性毒性反应 ICR 小鼠经尾静脉注射hUCMSCs 后,各组动物在观察期内,体质量稳步增加,毛色鲜亮,呼吸均匀,排便干燥成颗粒状,行为正常,未见消瘦、呼吸困难、焦躁、萎靡、稀便等不良症状。2 周后取各系统的主要器官经石蜡包埋、切片、HE 染色观察,均未见炎症、坏死、肿瘤等病理变化(图2)。
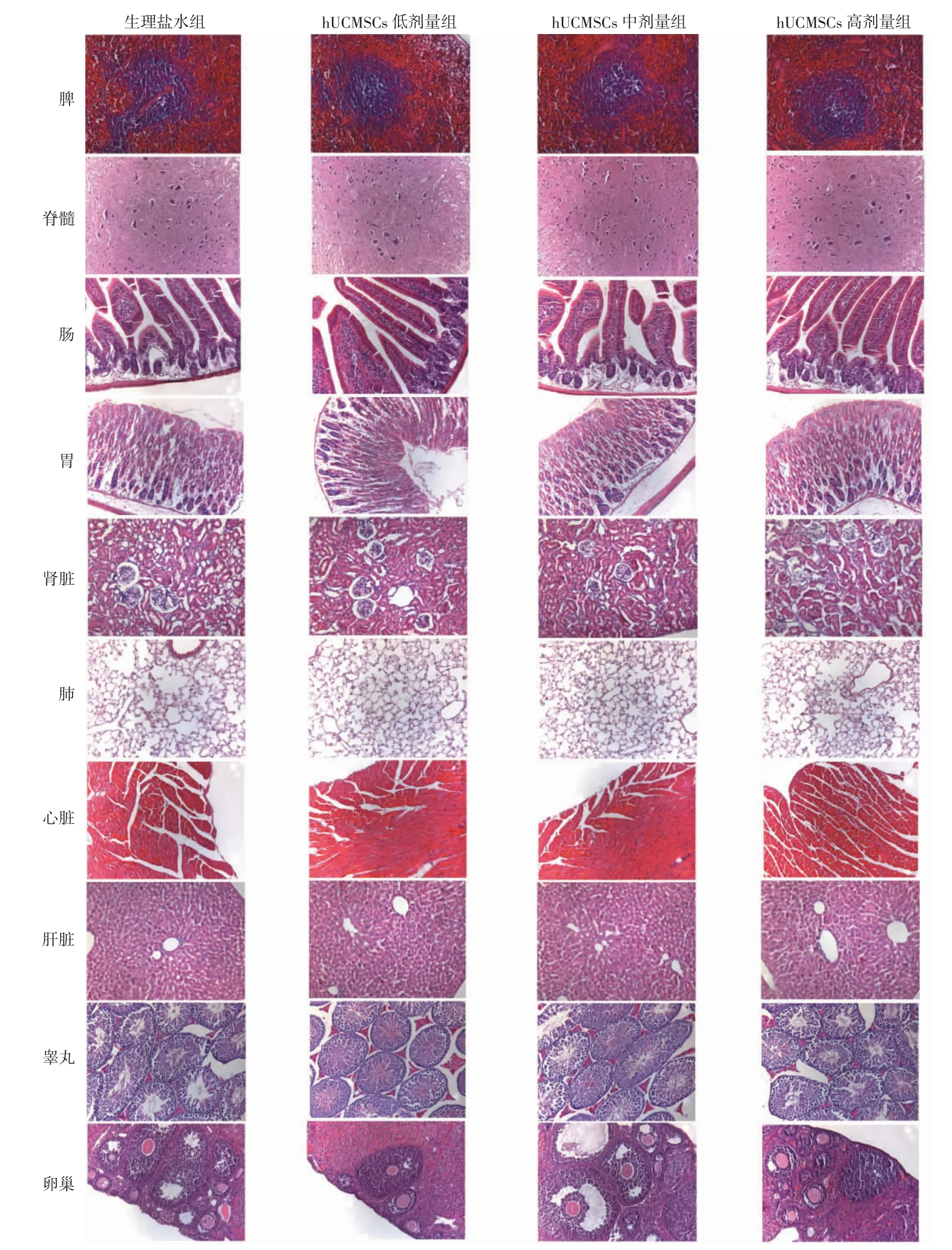
图2 经尾静脉注射hUCMSCs 2 周后小鼠各系统主要器官的HE 染色(200×)
3 讨 论
国内干细胞实行双轨制,已有119 家机构74 个干细胞临床研究项目完成临床备案,几乎涉及临床的各个领域。间充质干细胞可从骨髓、羊水、脐带、脂肪等多种组织中获得[6]。在干细胞临床备案的项目中,涵盖了各种类型的间充质干细胞,而其中hUCMSCs 占比最大(43%),这与组织采集简单,易消毒、干细胞数量多、细胞易于纯化等特点密切相关。hUCMSCs 来源于人脐带的胶质组织[7],与其他来源的干细胞相比,具有免疫原性低、非侵入性采集、生物学性能稳定、增殖快,且不存在伦理问题等优势[8-10],故备受关注。因此,hUCMSCs 是一种更有前途的细胞治疗方法。
用于临床疾病治疗的hUCMSCs 绝大多数都不是来源于患者自身,不同来源及不同实验室制备的hUCMSCs 在质量方面必定存在着很大的差异,在临床治疗前必须进行全面的安全性评估。本研究体内实验之前,首先用兔血检测了hUCMSCs 的凝血性和溶血性,结果表明hUCMSCs 未引起凝血异常和溶血反应。在基本排除hUCMSCs 进入体内不会引发血栓或溶血的基础上,再进行体内毒性实验。动物体内毒性实验是临床应用前必须要做的完全性评价,目的是观察全身性毒性反应,主要是动物有无不良生理反应甚至死亡,全身各器官有无不良病理变化。而刚进入体内时,浓度最高,反应也最大,因此本实验检测的是hUCMSCs 在小鼠体内急性毒性反应,观察2周内小鼠的生理状态,2 周后取材观察各器官的病理变化。细胞进入体内的方法是通过尾静脉注射,可以使hUCMSCs 到达更多的器官,特别是血供丰富的脏器,如心、肝、脾、肺、肾等[11]。目前临床上hUCMSCs拟输入剂量为1×106个细胞/kg 体质量[12],作为安全性评价实验,所用剂量应远大于临床使用剂量,因此本研究选择低(2×106/kg)、中(2×107/kg)、高(1×108/kg) 3个剂量组,最高剂量是临床用量的100 倍。低、中、高剂量的hUCMSCs 通过尾静脉注射到小鼠体内,2 周内各组动物均无死亡,未表现出不正常的生理反应。2 周后对各系统主要器官取材、石蜡包埋、切片、HE染色,显微镜下未见明显病理改变。
综上所述,hUCMSCs 在体外未引起凝血或溶血异常,经尾静脉注射后,对ICR 小鼠各系统主要器官无明显刺激性作用,动物无不良反应。结果初步表明领航干细胞再生医学工程有限公司制备的hUCMSCs 制剂对动物未造成急性毒性反应,为以后进行慢性毒性、成瘤性、异常免疫反应等生物学安全检测提供了前期的实验依据。

