玻璃化冷冻对小鼠卵巢组织DNA 甲基化的影响*
彭灵娜,孙 华,丁莹莹,王生存,郭 丰,***
(1 南通大学附属医院生殖医学中心,南通 226001;2 南通大学实验动物中心)
目前恶性肿瘤患者呈现越来越年轻化的趋势。得益于肿瘤治疗的进展,越来越多的肿瘤患者可达到长期生存,然而大部分肿瘤治疗方法可导致性腺功能减退甚至丧失生育功能,因此对于肿瘤治疗后的生育力的保存日益得到关注。化疗和放疗是肿瘤治疗的重要手段,但卵巢组织对细胞毒性药物非常敏感,许多药物被归类为性腺功能障碍高风险的药物[1]。化疗的主要药物环磷酰胺是以剂量依赖的方式损害卵母细胞和颗粒细胞[1]。盆腔放疗作为妇科恶性肿瘤治疗的有效辅助手段也可能导致卵巢功能损害,<2 Gy 的卵巢放射量足以破坏约50%的原始卵泡,而当剂量增大至20 Gy 时整个卵巢的功能将会完全丧失[2]。恶性肿瘤的治疗势必会导致早发性卵巢功能不全(premature ovarian insufficiency,POI),最终致使女性丧失生育能力。因此,癌症治疗前的生育力保存非常必要。
女性患者的生育力保存主要包括卵子冷冻、胚胎冷冻和卵巢组织冷冻,现阶段卵子冷冻与胚胎冷冻技术已经成熟,而卵巢组织冷冻保存尚处于实验阶段。自2004 年J.DONNEZ 等[3]报道了首例慢速冷冻卵巢组织复苏后经自体移植得到活产婴儿,目前这项技术已经带来了超过130 例的活产儿[4]。传统的卵巢组织冷冻方法为慢速冷冻,与玻璃化冷冻相比,其耗时长且需要较为昂贵的设备[5]。玻璃化冷冻技术现已被广泛地运用于配子和胚胎的冷冻保存,其方法较为简单,能够减少细胞内冰晶的形成[5-7],减少原始卵泡中的DNA 碎片[8],更好地保护了卵巢的间质细胞[8-11]。
表观遗传学是指在不改变基因核酸序列的情况下,发生的可遗传的基因表达改变,其调控的基本机制包括DNA 甲基化、组蛋白修饰和RNA 的逆转录[12]。而DNA 甲基化是重要的表观遗传学修饰,可使某些基因失活引起DNA 构象的改变,影响DNA 稳定性及DNA 与蛋白质相互作用的方式。而异常的甲基化模式会导致发育异常或某些癌症的发生。DNA 甲基化是由DNA 甲基转移酶(DNA methyltransferase,DNMT)所催化的,甲基化可随DNA 的复制遗传给后代,DNA 复制后,DNMT 可将新合成的未甲基化位点进行重新的甲基化。DNMT 催化甲基从S-腺苷甲硫氨酸转移至DNA。在哺乳动物中,已报道DNMT家族的5 个成员:DNMT1、DNMT2、DNMT3a、DNMT3b 和DNMT3L,但只有DNMT1、DNMT3a 和DNMT3b 具有甲基转移酶活性[13]。DNMT1 是维持甲基化酶,主要负责维持DNA 复制期间的甲基化模式,DNMT3a 和DNMT3b 为从头甲基化酶,有助于在胚胎和生殖细胞中产生从头DNA 甲基化模式[14]。母系表达的H19 基因位于小鼠7 号染色体远端的许多印记基因附近,该区域的其他基因有父系表达的Igf2 和Ins2 基因以及母系表达的p57KIP2、Kvlqt1 和Mash2 基因[15]。H19 基因编码一种非翻译mRNA,可以抑制胎儿和胎盘的发育[16]。有关胚胎配子玻璃化冷冻对表观遗传学的影响已有多篇报道[17-19]。卵巢组织结构复杂,所含细胞种类繁多,目前还没有统一的卵巢玻璃化冷冻方案,玻璃化冷冻是否对卵巢表观遗传产生影响仍存在争论。本研究旨在探讨玻璃化冷冻方法对小鼠卵巢的组织学和超微结构的影响以及 对DNMT1、DNMT3a、DNMT3b 和H19 的mRNA表达的影响。
1 材料和方法
1.1 实验动物 8 周龄无特定病原体(specific pathogen free,SPF)级C57BL/6J 雌性小鼠,均由南通大学实验动物中心提供,实验动物饲养环境为SPF级屏障设施配套IVC 笼盒,12 h 明和12 h 暗的光周期,饲喂全价营养配合饲料,高温高压灭菌饮水自由饮用。本实验方案由南通大学实验动物伦理委员会批准。
1.2 主要试剂 蔗糖、二甲基亚砜(dimethyl sulfoxide,DMSO)、乙烯乙二醇(ethylene glycol,EG)均购自Sigma-Aldrich 公司;血清蛋白(human serum albumin,HSA)、G-MPOS 缓冲液为Vitrilife 产品(Sweden);实验所采用的实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qRT-PCR)试剂盒购自上海生工公司。
1.3 主要设备 眼科剪、显微手术镊均购自德国Eppendorf 公司,SMZ745 体视显微镜和普通光学显微镜购自日本尼康公司,液氮罐、分光光度计、普通PCR 仪均购自德国Thermo Scientific 公司,Stepone real-time PCR 仪购自美国ABI 公司。
1.4 实验方法
1.4.1 卵巢组织收集 将8 周龄的C57BL/6J 雌性小鼠随机分为冷冻组和对照组,小鼠脱颈椎处死后,快速打开腹腔,找到并取出卵巢组织,置于磷酸缓冲盐溶液(phosphate buffered saline,PBS)中,去除周围脂肪组织。冷冻组的卵巢组织进行玻璃化冷冻保存,对照组的新鲜卵巢组织用于即刻实验。
1.4.2 卵巢组织的玻璃化冷冻保存与复苏 使用本实验室的卵巢组织冷冻复苏方法[20],此方法可有效地保存卵巢组织,复苏移植后可成功存活。将卵巢组织置于冷冻液1 中平衡5 min,再移入冷冻液2 中直至完全下沉,转移到1.5 mL 的冻存管中,快速投入液氮罐中进行冷冻保存。冷冻保存至少2 个月以上取出复苏,复苏液1 中1 min,复苏液2 中5 min,置于PBS 中备用。
1.4.3 卵巢组织HE 染色 将卵巢组织固定于4%多聚甲醛溶液中,12 h 后用三蒸水充分换洗,经70%、80%、90%及无水乙醇梯度脱水后于二甲苯中透明,于已融化的石蜡中浸蜡包埋,5 μm 切片,45 ℃温水中漂片,贴于载玻片上,63 ℃烘片。依次置于二甲苯,无水乙醇,90%、80%及70%乙醇中脱蜡,苏木精染色20 min,盐酸乙醇分化30 s,伊红染色30 s,经梯度乙醇及二甲苯脱水透明,中性树胶封固。
1.4.4 卵巢组织电镜切片的制备 将卵巢固定于3%戊二醛溶液中,48 h 后用PBS 充分换洗,于10 g/L四氧化锇中固定1 h,PBS 冲洗,30%~100%丙酮梯度脱水,环氧丙烷浸泡5 h,Epon812 定向包埋,半薄切片光学定位,超薄切片机切片,片厚50 nm,贴附于载网上,用醋酸铀及枸橼酸铅双重染色,透射电镜观察卵巢细胞超微结构。
1.4.5 qRT-PCR 将卵巢组织置于Trizol 中提取组织中的总RNA,按照Takara 逆转录试剂盒说明书进行cDNA 的合成,反应条件如下:42 ℃2 min,37 ℃15 min,85 ℃加热5 s,得到的cDNA 置-20 ℃保存。qRT-PCR 试剂盒购自上海生工公司,20 μL 扩增体系为:cDNA 模板5 μL,Mix 10 μL,10 μmol/L 上下游引物(表1)各0.6 μL,DEPC 水3.8 μL。PCR 扩增程序:95 ℃预变性10 min,95 ℃变性10 s,55 ℃退火30 s,共45 个循环。
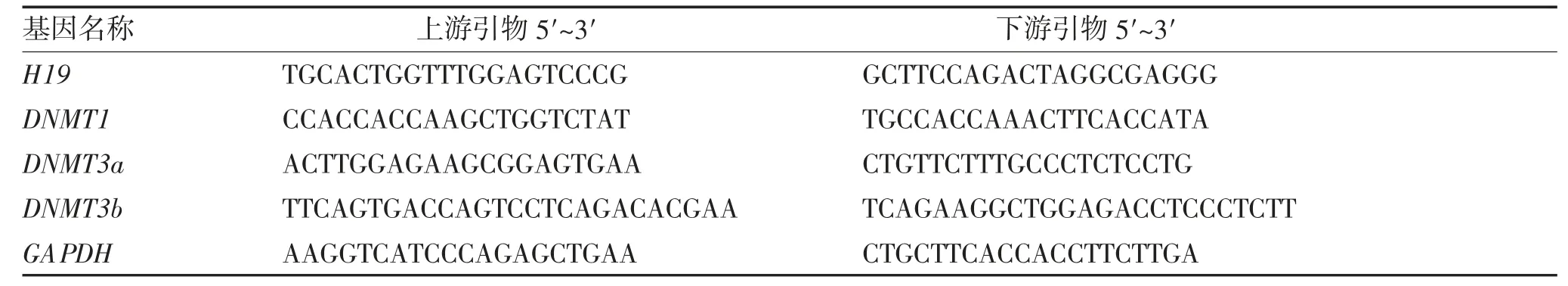
表1 实时荧光定量PCR 引物
1.4.6 统计学方法 qRT-PCR 反应结束后根据所得的Ct 值计算各mRNA 的相对表达量。以GAPDH为内参,各基因的相对表达量以2-△△Ct表示。使用SPSS 22.0 软件进行统计分析,各组数据不符合正态分布,采用非参数检验(K-W 秩和检验),以P<0.05为差异有统计学意义。
2 结 果
2.1 卵巢组织HE 染色 冷冻组卵巢的形态与对照组相似,小鼠卵巢中可见大小不等的各级卵泡,卵泡形态规则,卵泡腔较大且卵泡液丰富,颗粒细胞排列紧密,卵母细胞形态规整,核仁明显,卵巢皮质下可见较多的始基卵泡和初级卵泡,黄体细胞丰富,偶见闭锁卵泡(图1A~B)。总之,冷冻保存复苏后的卵巢组织形态保存的较为完整。
2.2 卵巢组织的超微结构 冷冻组卵巢组织及卵泡超微结构显示,卵巢细胞结构完整,细胞胞质及间质中可见大量的线粒体、脂滴及其他细胞器,尤其是参与细胞有氧呼吸的重要细胞器——线粒体的结构与对照组卵巢组织非常相似(图1C~D)。超微结构上未观察到冷冻复苏过程带来的明显损伤。
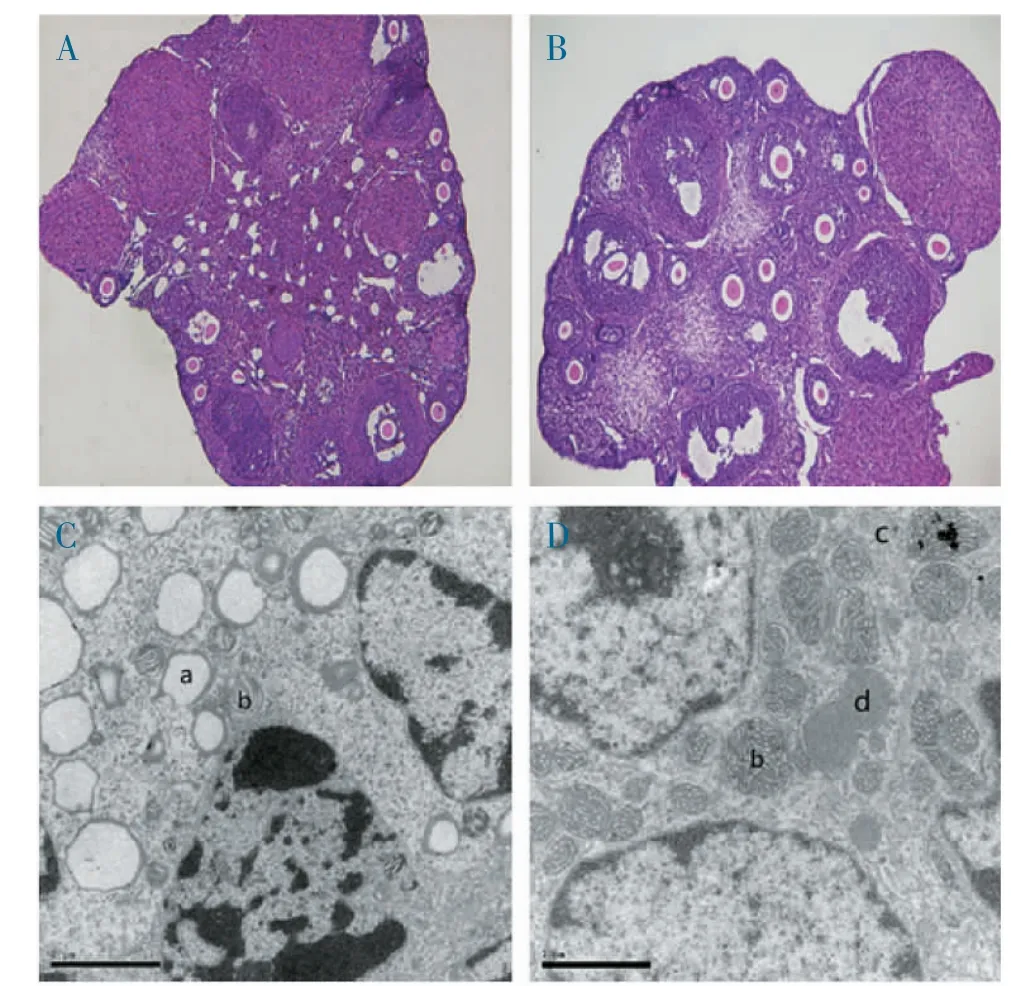
图1 光镜及电镜下卵巢组织
2.3 卵巢组织DNA 甲基转移酶及H19 基因的相对表达 为了解卵巢组织玻璃化冷冻复苏是否影响基因组DNA 的甲基化水平,通过qRT-PCR 检测了3种DNMT 及H19 基因的表达,结果显示冷冻组卵巢中DNMT1、DNMT3a 和DNMT3b 的表达高于对照组,但差异均无统计学意义(均P>0.05);H19 基因的相对表达量较对照组稍有下降,但两者亦无统计学差异(P>0.05),见图2。
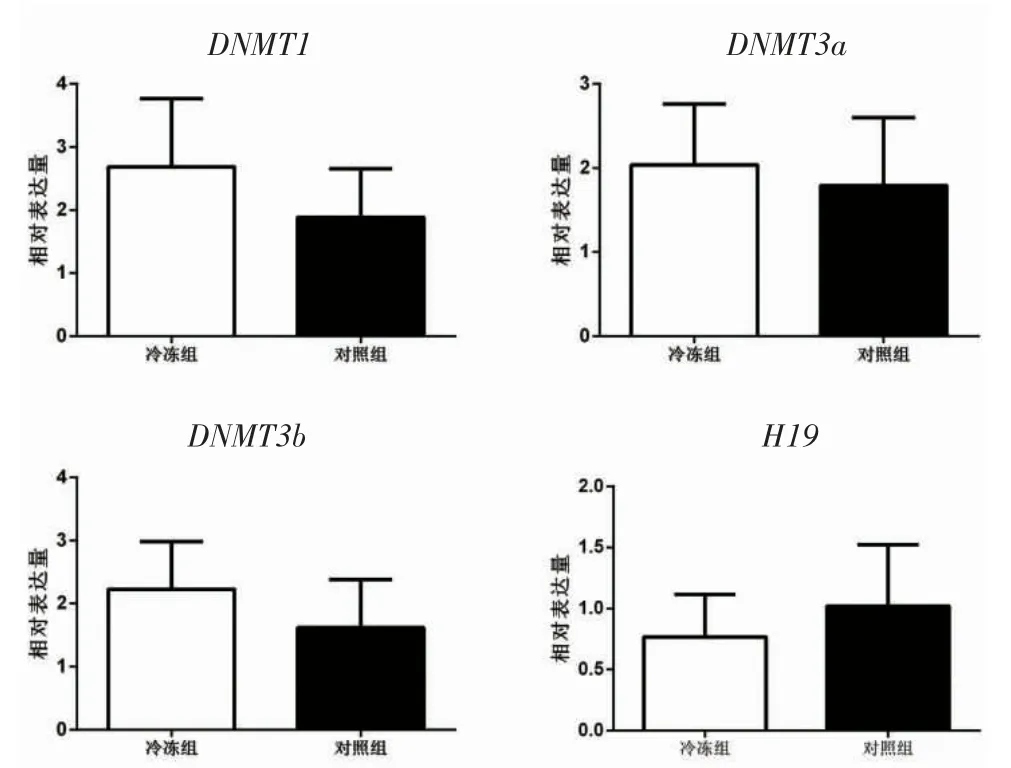
图2 卵巢组织DNMT 及H19 基因的相对表达水平
3 讨 论
相较于卵母细胞冷冻和胚胎冷冻,卵巢组织冷冻具有以下独特的优势:首先,对于卵母细胞冷冻保存,将卵巢组织进行冷冻保存有利于保护卵泡发育的天然微环境,更利于复苏后卵细胞的继续发育。其次,卵巢组织冷冻保存尤其适用于青春期前和没有配偶的肿瘤患者,因其无需额外的卵巢刺激,不需要推迟癌症的治疗。最后,卵巢组织冷冻保存除具有保存女性生育能力外,还可恢复女性的内分泌功能。2010 年S.SILBER 等[21]首次将玻璃化冷冻技术用于卵巢组织冷冻,尽管目前尚无玻璃化冷冻卵巢组织的活产婴儿出生,但玻璃化冷冻青春前期的小鼠卵巢组织并进行同种异体移植,结果显示小鼠恢复了青春期及生育能力[22]。虽然冷冻保存技术与手术的可行性已有大量研究[3-4,21-22]支持,但在冷冻过程中,可能会因冷冻保护剂(如DMSO、EG 等)的浓度、温度及暴露时间对细胞产生毒性[23-24]。目前对于冷冻保存卵巢组织的安全性问题研究较少。
DNA 甲基化作为重要的表观遗传学修饰之一,由DNA 甲基转移酶催化。在哺乳动物中,DNA 甲基化模式在配子发生和胚胎早期就已经建立,DNA 甲基化对于基因的沉默、基因组的印记及X 染色体的失活非常重要[25]。多种人类疾病也与DNA 的异常甲基化状态有关,如癌症、脆性X 和Rett 综合征[13,26]。玻璃化冷冻是否影响卵母细胞或胚胎的表观遗传学尚无统一意见。支持者认为由于卵母细胞或胚胎玻璃化冷冻引起的表观遗传学变异可能会遗传给后代[27-29],且会使后代患有其他疾病的风险升高[19]。R.THALER 等[14]认为作为玻璃化冷冻的重要成分DMSO 改变了胚胎干细胞的表型,从而影响了全基因组DNA 甲基化的水平。M.IWATANI 等[30]研究发现随着DMSO 浓度的增加DNMT3a mRNA 的表达量也相应增加。但也有不同观点,T.TRAPPHOFF 等[7]研究了卵泡冷冻对卵子发育成熟、DNA 完整性和甲基化水平的影响,发现玻璃化冷冻会导致短暂的DNA 断裂增加、延缓卵泡发育,但卵母细胞的生长成熟、纺锤体和染色体构成与对照组无明显差异,玻璃化冷冻也不增加印记基因的突变水平。李尚等[31]认为玻璃化冷冻对基因组甲基化模式或相关基因mRNA 表达水平无明显影响,对DNA 甲基化不同的研究结果可能与冷冻保护剂的种类和浓度、冷冻复苏操作方法及使用的培养基不同有一定的关系。
卵巢组织玻璃化冷冻与DNA 甲基化的研究不多,H.Y.WANG 等[22]研究了玻璃化冷冻10 日龄的小鼠卵巢组织,发现其Snrpn-DMR 区域的甲基化谱没有改变。黄丽丽等[32]研究显示无论是程序化冷冻还是玻璃化冷冻均不能对人卵巢组织中印记基因胰岛素样生长因子2/H19CpG 岛甲基化程度及表达产生影响。但Z.Y.HE 等[33]研究显示玻璃化冷冻卵巢组中滤泡DNA 甲基转移酶蛋白减少,导致了启动子区域的超甲基化使得Grb10 的表达增加。本研究观察到玻璃化冷冻方法可完好地保存卵巢组织,解冻复苏后不影响卵巢组织的超微结构,各细胞及细胞器保存完整;qRT-PCR 结果显示玻璃化冷冻的卵巢与新鲜的卵巢相比,DNMT1、DNMT3a、DNMT3b 及H19基因的表达均没有明显变化。
本研究尚存在一些不足之处:由于课题经费的限制,没有对玻璃化冷冻的卵巢组织进行全基因组DNA 甲基化水平的检测,这将是以后的研究重点。对于复苏后的卵巢组织中主要遗传物质——卵母细胞的结构及其表观遗传学的变化也值得探索。
本研究表明玻璃化冷冻对卵巢组织的结构、DNMT 及H19 基因的表达无明显影响。卵巢冷冻保存的目的是日后移植回体内恢复机体内分泌功能和生殖功能并获得子代,安全的卵巢冷冻是子代健康的前提,所以玻璃化冷冻卵巢组织的DNA 甲基化状态尚需更多深入细致的研究。

