肺癌患者HIF-1α 过表达及其靶向干预对VEGF 的调控作用*
时 杨,赛文莉,黄海涛,吴广洲,姚登福***
(1 南通大学第四附属医院胸外科,盐城 224001;2 南通大学附属医院临床医学研究中心;3 南通大学第二附属医院胸外科)
基础及临床资料[1-2]已证明实体肿瘤内缺氧诱导因子(hypoxia-inducible factor,HIF)过表达,以调控下游血管生成相关因子活化,促新血管形成,在肿瘤进展过程中发挥重要作用。HIF 主要调节氧稳态,为生理或病理性低氧反应关键转录因子,常氧时抑癌基因VHL(von Hippel-Lidau)产物pVHL,为缺氧依赖性蛋白引导HIF-1α 多聚泛素化,在转录水平调控细胞增殖、血管新生、激活多种缺氧反应基因表达,与肿瘤生长、浸润、转移和预后等密切相关[3-4]。肺癌最主要的特征是癌细胞难以调控方式生长,过度增殖致组织耗氧量增加,激活缺氧反应性基因表达,诱导新血管生成,提供氧气满足癌细胞能量代谢和转移等[5]。然而,肺癌组织中HIF-1α 的表达情况及其调控血管内皮生长因子(vascular endothelial growth factor,VEGF)的作用机制尚不清楚。本文以组织芯片(tissue microarray,TMA)和免疫组织化学法分析肺癌组织中HIF-1α 和VEGF 表达、细胞定位及与临床病理特征的关系;并构建靶向HIF-1α 基因转录的干扰质粒转染肺癌细胞,观察对下游VEGF 的调控作用。
1 材料与方法
1.1 肺癌组织 收集南通大学第四附属医院在2017 年1 月—2018 年12 月间住院肺腺癌患者术后癌和非癌组织标本各60 份,男38 例,女22 例;年龄26~76 岁,其中≤60 岁19 例,>60 岁41 例。所有组织均按肺癌病理织学(H&E 染色)检查证实为腺癌,均有完整住院记录和随访资料,符合肺癌诊疗规范,按肺癌标准核实诊断。本研究经南通大学第四附属医院医学伦理委员会批准。
1.2 肺癌细胞株 肺BEAS-2B 细胞、肺癌SPC-A-1、NCI-H1650、A549 和NCI-H1975 细胞均购自中国科学院上海细胞所。经筛选HIF-1α 高表达株后,将癌细胞设空白对照组(空白组)、阴性对照组(mRNAineg 组,阴性组)和HIF-1α mRNA 干扰组(mRNAi组,干扰组)进行研究。
1.3 TMA 肺腺癌患者术后癌及非癌组织蜡块依据病理学检查于石蜡切片上标记,以TMA 机细针打孔法在涂多聚赖氨酸载玻片上制作圆柱形、整齐排列的TMA,孔径1.5 mm,芯间距0.2 mm,芯片于塑料盒固定55 ℃10 min,蜡溶解前取出冷却,4 ℃保存。切片前夹在切片机上修正组织,-20 ℃冰袋贴蜡块5 min,4 μm 切片于凉水展开后,移至45 ℃水浴2 min,贴片60 ℃,3 min,58 ℃18 h,-20 ℃保存。
1.4 免疫组织化学染色 TMA、水化、双氧水阻断、高压加热法修复抗原和动物血清封闭。采用武汉博士德生物工程有限公司的免疫组织化学分析试剂盒分析肺癌及非癌组织HIF-1α 或VEGF 表达。兔抗人VEGF(1∶1 000)或HIF-1α 抗体(1∶500,英国Neo-Markers 公司)于4 ℃过夜,加0.01 mol/L 磷酸缓冲盐溶液(phosphate buffered saline,PBS)(pH=7.5)洗涤后,加生物素标记二抗,置室温10 min 后以PBS 洗涤,加链霉素抗生物素蛋白/过氧化酶,室温10 min,PBS洗涤;加新配制四盐酸二氨基联苯胺溶液显色,水洗,苏木精复染,无水乙醇脱水、封片。于光学显微镜下观察,摄片。以0.01 mol/L PBS(pH=7.5)替代第一、第二抗体作为对照。以棕黄色或棕褐色的HIF-1α或VEGF 表达,任选5 个高倍视野(400×)/片计数阳性细胞,按阳性细胞所占比例分为<10%、10%~25%、>25%~50%和>50%;强度分别为阴性(-)、弱阳性(+)、中等阳性(++)和强阳性(+++)。
1.5 干扰质粒构建 按HIF-1α mRNA 序列(NM_001530)[6]以Invitrogen miRNA 软件设计4 对短发夹RNA 寡聚单链DNA,从中筛选出一对最有效序 列:5′-TGCTGTAAAGCATCAGGTTCCTTCTTGTTTTGGCCACTGACTGACAAGAAGGACTGATGCTT -TA-3′和5′-CCTGTAAAGCATCAGTCCTTCTTGTCAGTCAGTGGCCAAAACAAGAAGGAACCTGATGC -TTTAC-3′,其中划线部分为靶区序列,上下游为茎环结构。按照BLOCK-iTTMPolII-miR RNAi 表达载体试剂盒(Invitrogen,上海)操作,将HIF-1α mRNAioligo 插入pcDNATM6.2-GW/EmGFP 表达载体,以不含干扰序列pcDNATM6.2-GW/EmGFP 作为阴性对照。
1.6 细胞转染与干扰效率 肺Beas-2B 细胞,肺癌SPCA-1、NCI-H1650、A549 和NCI-H1975 细胞复苏,以RPMI 1640 培养基(南京凯基及美国Corning公司),CO2及100%湿度培养,取对数生长期细胞设干扰、阴性和空白组;各组分别加靶向HIF-1α 干扰质粒、阴性质粒、空白对照及FuGENE HD 转染试剂培养。转染前24 h 每孔加2 mL 细胞悬液,加转染试剂和干扰载体与转染试剂形成复合物,培养,转染后24、48 和72 h,将A549 细胞(5×105)接种,加无抗生素培养基24 h 后细胞密度至全孔80%;将干扰或阴性组RPMI 1640 稀释6 μL Engreen 转染试剂(北京英格恩生物科技有限公司)混匀,室温5 min,将干扰和阴性质粒转染A549 细胞,设空白对照,24 h 后荧光显微镜观察效率。HIF-1α mRNA 以QuickGene 试剂在FUJIFILM 核酸仪制备后,以ReverAidTMFirst Strand cDNA Synthesis Kit(Fermentas,美国)合成cDNA,以引物5′-CCACTGCCACCACTGATGAA-3′(nt 2 254~2 273)和5′-TTGGTGAGGCTGTCCGACTT-3′(nt 2 412~2 431)终产物为178 bp;β-actin 为内参,其引物序列为:5′-ATTGCCGACAGGATGCAGA-3′和5′-GAGTACTTGCGCTCAGGAGGA-3′,置Roche LightCycler480ⅡPCR 仪中,在95 ℃5 min 预变性后,以95 ℃10 s;60 ℃30 s;72 ℃30 s,循环40 次,4 ℃保存。计算相对干扰效率=2-△△Ct。
1.7 细胞增殖分析 干扰、阴性和空白组细胞以细胞计数试剂盒8(cell counting kit-8,CCK-8)(日本同仁化学研究所)分析法,在转染开始0、24、48、72 h 分析细胞增殖(n=5),于多功能酶标仪测吸光度(A450),计算均值。
1.8 细胞迁移分析 将细胞消化、离心后,以1×105个/孔细胞重悬于100 μL RPMI 1640 培养基中,加入Transwell 小室的上腔室,下腔室中加入600 μL含10%胎牛血清(fetal bovine serum,FBS)培养基孵育12 h。之后4%多聚甲醛固定迁移到小室下表面细胞以结晶紫染色。倒置显微镜摄片,每室随机选择5 个视野并对染色细胞进行计数(n=5)。
1.9 细胞侵袭分析 将基质胶和RPMI 1640 培养基按1∶20 混匀,每孔50 μL 包被Transwell 小室底部膜的内室面。之后将1×105个/孔细胞重悬于100 μL无血清培养基中,加入Transwell 小室上腔室,下腔室中加入600 μL 含10%FBS 的培养基孵育48 h。4%多聚甲醛固定迁移到小室下表面细胞以结晶紫染色。倒置显微镜拍摄染色的细胞,每室随机选择5个视野并对染色细胞进行计数(n=5)。
1.10 酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)分析 以ELISA 法定量检测细胞培养液中HIF-1α 和VEGF 浓度,按HIF-1α 和VEGF 检测试剂盒(ADL,美国)使用说明书进行测定。以标准液制备检测标准曲线,分设标准、待测和空白孔,标准孔加系列浓度标准品,空白孔加空白对照液,待测孔加细胞培养上清液,酶标板加覆膜,于37 ℃2 h 后弃液体,加检测溶液A 后加膜,37 ℃1 h 后弃液体,洗液浸2 min 弃液体,加检测溶液B覆膜,37 ℃30 min,弃液,加显色液覆膜37 ℃,加终止液后测吸光度(A450),依据标准曲线,计算HIF-1α和VEGF 浓度。
1.11 免疫印迹分析 从细胞中制备蛋白,以上海碧云天生物技术公司的BCA 试剂检测蛋白浓度,制备十二烷基磺酸钠-聚丙烯酰胺(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)凝胶,蛋白经SDS 处理与上样缓冲液(Biosharp 公司,上海)混匀,加样在PAGE 中恒压80 V×35 min 后100 V×60 min 电泳结束后,取出凝胶转膜,加鼠抗人HIF-1α(1∶500,Abbkine,美国),4 ℃过夜,漂洗,加辣根过氧化物酶标记的羊抗鼠IgG 抗体(1∶1 000,Abbkine,美国)二抗孵育2 h,漂洗、增强化学发光法显色并摄像。
2 结 果
2.1 肺癌组织HIF-1α 和VEGF 表达的免疫组织化学分析 构建癌或非癌TMA,点阵排列整齐,无掉片、移位,无扭曲。经免疫组织化学分析,肺癌及非癌组织HIF-1α 呈棕黄色颗粒状,定位胞质和细胞核,癌灶组织中表达均匀,坏死区及浸润区的边缘见HIF-1α 呈增强表达(图1A),癌边缘组织明显增加,其强度高于对照的非癌组织(图1B)。肺癌及非癌组织VEGF 表达呈棕褐色,胞质和胞核中表达均匀(图1C),非癌组织VEGF 显色较淡,癌组织VEGF 表达强度高于对照非癌组织(图1D)。肺癌组HIF-1α 阳性率为88.3%(53/60),显著高于自身对照非癌组的10.0%(6/60)(χ2=70.553,P<0.001);癌组织中/强阳性表达(++~+++)占83.3%,非癌组织阴/弱阳性表达(-~+)占93.3%;肺癌组VEGF 阳性率90.0%(54/60) 显著高于非癌组的13.3%(8/60)(χ2=67.575,P<0.001),癌组织中/强阳性表达占86.7%,非癌组织阴/弱阳性表达占91.7%。
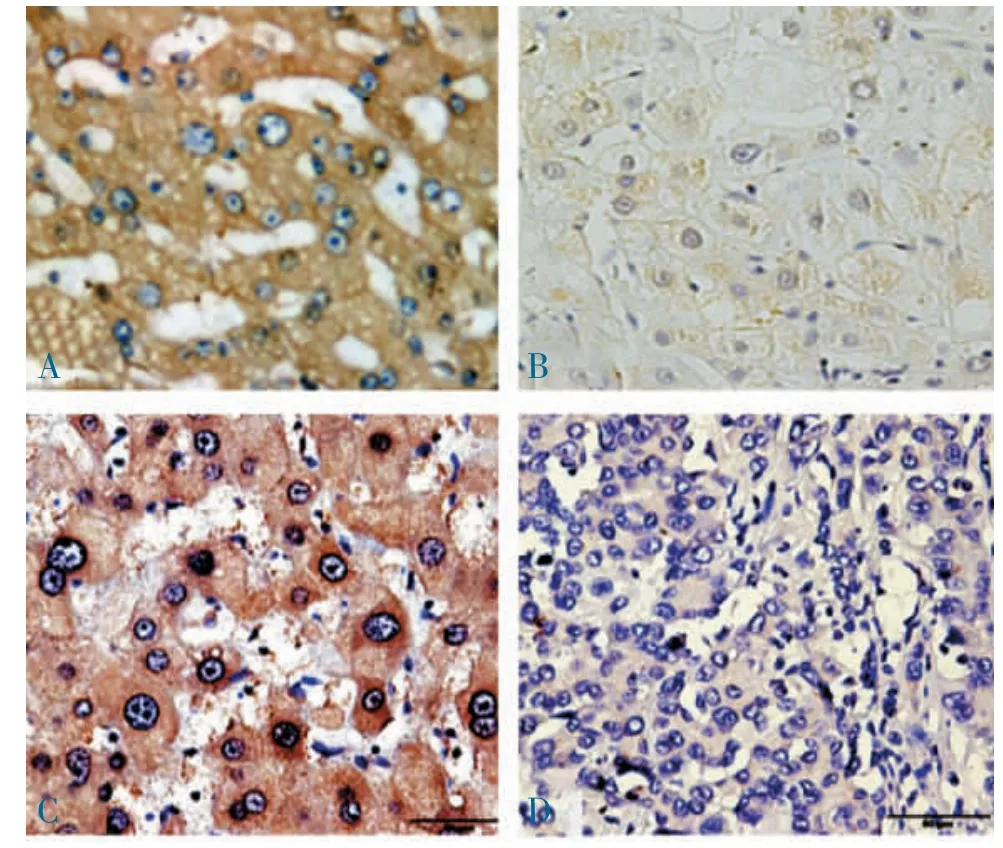
图1 肺癌及非癌组HIF-1α 和VEGF 表达的免疫组织化学分析(400×)
2.2 肺癌组织HIF-1α 和VEGF 表达的临床病理学特征 肺癌组织HIF-1α 和VEGF 表达的主要临床特征见表1。在60 例癌组织HIF-1α 和VEGF 阳性表达与肺癌TNM 分期高、分化程度差、伴有淋巴结转移或远处转移等显著相关(P<0.05)。

表1 肺癌组织HIF-1α 与VEGF 表达的临床病理学特征(n=60)
2.3 肺癌细胞HIF-1α 的表达 HIF-1α 在肺Beas-2B 细胞及肺癌SPCA-1、NCI-H1650、A549 和NCI-H1975 细胞的表达水平见图2。培养的细胞生长良好,以Western Blot 法分析不同细胞株中HIF-1α 表达(图2A);各细胞株HIF-1α/β-actin 比率(图2B)及HIF-1α mRNA 差异(图2C),显示肺Beas-2B细胞HIF-1α 表达量最少,肺癌SPCA-1 和NCIH1650 细胞HIF-1α 中等表达;肺癌A549 及NCIH1975 细胞HIF-1α 过表达。本文将A549 细胞用于后续研究。

图2 不同肺癌细胞中HIF-1α 的表达
2.4 干扰HIF-1α 转录对VEGF 的调控作用 构建特异的HIF-1α mRNA 干扰质粒转染A549 细胞后,对HIF-1α 基因转录、蛋白及下游VEGF 影响见图3。干扰HIF-1α 基因(图3C)影响癌细胞增殖,明显高于空白组(图3A)和阴性对照组(图3B);免疫印迹法证实干扰组HIF-1α 显著抑制(图3D),转染24、48、72 h 后,HIF-1α mRNA(2-△△Ct,图3E)抑制率分别为13.2%(P=0.007)、60.8%(P<0.001)、87.1%(P<0.001);且培养液中VEGF 减少,分别抑制25.4%(P<0.01),45.8%(P<0.001)、54.3%(P<0.001,图3F)。

图3 干扰肺癌A549 细胞HIF-1α 转录对VEGF 表达的影响
2.5 HIF-1α 转录干扰影响肺癌细胞的生物学功能干扰质粒转染A549 细胞后显著影响癌细胞的增殖(图4A),干预组细胞增殖(图4B)明显低于阴性对照组(图4C)和空白组(图4D),随着时间延长,效果越明显。干扰HIF-1α基因转录影响A549 细胞侵袭和迁移能力(表2)。与空白组相比,干扰组侵袭和迁移细胞数明显减少。
表2 干预HIF-1α mRNA 影响肺癌A549 细胞侵袭和迁移能力(,n=5)

表2 干预HIF-1α mRNA 影响肺癌A549 细胞侵袭和迁移能力(,n=5)

图4 干扰HIF-1α mRNA 转录影响A549 细胞的增殖能力
3 讨 论
肺癌是最常见的恶性肿瘤以及癌症相关死亡的主要原因,患者早期症状不明显,诊断难,预后差。肺癌仍以手术为主,放、化疗为辅的综合治疗,但因癌细胞转移和耐药等原因,其疗效欠佳,寻找新靶点和改进治疗策略倍受关注[7-8]。肺癌的发生发展涉及原癌基因激活、抑癌基因失活以及凋亡相关基因异常,机制复杂[1]。HIF-1α 是HIF-1 的特异性活性调节亚基,常氧时HIF-1α 合成与降解维持稳定,低于检出极限;在缺氧的微环境中,肺癌相关基因表达调控靶基因的异常转录,HIF-1α 活化产生大量促血管生成因子诱导肿瘤新血管生成,使癌细胞生长获得更多氧气和营养物质,同时癌细胞也更具侵袭性而影响患者的放、化疗[2-3]。本文通过分析肺癌组织HIF-1α 和VEGF 表达及相互关系,并靶向A549 细胞HIF-1α mRNA 转录,初步探讨了HIF-1α 对肺癌新血管形成的调控作用。
肺癌组织代谢旺盛,在缺氧状态下HIF-1α 异常活化与下游的缺氧反应元素结合加速新血管生成,以满足癌细胞的生长需求,利于肺癌细胞浸润、转移,使癌细胞更具侵袭性。对人肺癌组织的免疫组织化学分析,显示癌组织HIF-1α 呈棕黄色过表达,中等及强阳性表达病例>80%,非癌组织<7%。同时癌组织VEGF 中/强阳性表达>86%,非癌组约9%。肺癌组织HIF-1α 和VEGF 均呈过表达,与患者瘤体大、肿瘤分化程度差、伴有淋巴结或远处转移等,组间差异有统计学意义;与TNM 分期、瘤体大、淋巴结转移或伴有远处转移、分化程度差等显著相关,表明肺癌组织微环境氧浓度严重低下,诱发HIF-1α加速活化,以利于肺癌生长与转移[9-10]。
分子靶向药物的临床使用已改善了肺癌的治疗,但在很大程度上仅仅局限于携带特定的基因突变子集,靶向新血管生成在实体肿瘤的治疗技术研发更有吸引力、更普遍[11-12]。在一线及二线治疗中,使用抗VEGF 贝伐单抗或抗血管内皮生长因子受体雷莫芦单抗与化疗联合均可延长总生存期。靶向血管生成是有效的,但血管生成潜在信号通路多,加之肺癌异质性抗血管生成的疗效有限[13-15]。寻找针对肺癌新血管生成分子靶标,从分子水平逆转血管重建,可抑制肺癌的生长与转移。在多株肺癌细胞中均见HIF-1α 高表达,以特异性短发夹核酸干扰A548 细胞中HIF-1α mRNA 转录,显示可显著下调VEGF 的表达并可明显降低癌细胞增殖、侵袭和迁移能力。提示干预癌细胞HIF-1α 基因转录,既可调控下游VEGF表达,也可抑制癌细胞增殖与转移等生物学行为。
综上所述,肺癌仍是最常见的恶性肿瘤,在多病因及多中心的不断发展过程中,组织低氧状态下HIF-1α 的异常活化起重要作用。肺癌组织及细胞HIF-1α 和VEGF 过表达,以特异性干扰HIF-1α mRNA质粒转染A549 细胞,既可阻断肺癌生长或转移的营养和氧气供给,有效抑制癌细胞增殖,又可下调VEGF 表达降低癌细胞的侵袭、迁移能力,提示靶向HIF-1α 基因转录有望成为肺癌治疗的潜在靶标,为研发新靶向治疗技术提供实验依据。然而靶向HIF-1α mRNA 治疗及联合抗血管生成药物[16],尚需要更多基础及临床验证。
——一道江苏高考题的奥秘解读和拓展

