低剂量ALA-PDT 上调miR-23a 减轻UVB 诱导的成纤维细胞凋亡*
施智男 ,程佳伟,陶金成,张 琳,谷 丽,周 舒,顾丽群,花 卉***
(1 南通大学附属南通第三医院皮肤性病科,南通 226006;2 南通大学医学院;3 江苏省南通市第一人民医院皮肤性病科)
当人体皮肤过度暴露于太阳光的照射可引起皮肤的损伤。光损伤可分为急性和慢性光损伤。急性光损伤主要表现为红斑、水肿、色素沉着。而慢性光损伤主要表现为光老化,甚至诱导皮肤恶性肿瘤的发生。引起皮肤损伤的日光主要是紫外线。紫外线可分为3 种:长波紫外线(ultraviolet A,UVA)、中波紫外线(ultraviolet B,UVB)、短波紫外线(ultraviolet C,UVC)。紫外线波长越长,其穿透能力就越强。能够穿越大气层的主要是UVA、UVB。UVA 通过诱导活性氧(reactive oxygen species,ROS)的产生和积聚,间接损伤DNA,UVB 照射则直接损伤DNA,产生环丁烷嘧啶二聚体(cyclobutane pyrimidine dimers,CPDs)和6-4光产物(6-4 photoproducts,6-4PPs)等细胞产物,而及时快速地清除细胞产物可减少细胞的凋亡,改善皮肤光损伤[1-2]。虽然UVB 大部分都被大气层吸收,但同等剂量的UVB 和UVA 照射皮肤,UVB 产生的损伤是UVA 的1 000 倍,是造成DNA 损伤的主要原因[3-4]。因此,如何预防UVB 辐射造成的损伤是防治皮肤光损伤的重要研究方向。
5-氨基酮戊酸光动力疗法(5-aminolevulinic photodynamic therapy,ALA-PDT)是一种很常见的无创治疗方法,主要由光敏剂、光源和氧构成,在病变组织部位给予大量的外源性5-氨基酮戊酸(5-aminolevulinic acid,ALA),病变部位吸收产生大量的光敏性物质原卟啉Ⅸ,在病变细胞中蓄积,使用特定波长的光源激活原卟啉Ⅸ,将光能转化为单态氧、氧自由基等活性氧物质从而发挥功能[5]。在临床工作中普遍运用的是高剂量ALA-PDT。这种治疗方法已经成熟应用于尖锐湿疣、皮肤肿瘤的治疗[6-7]。L.H.GOLDBERG等[8]研究发现ALA-PDT 可以治疗多发性光化性角化病并预防皮肤癌的发生,但具体机制仍不清楚。也有研究[9-10]发现使用低剂量ALA-PDT 可明显改善光老化的皮肤,达到嫩肤的效果。但关于低剂量ALAPDT 与UVB 诱导的急性光损伤的研究较少。
近年来,随着高通量测序、生物信息学的发展,针对miRNA、lncRNA、circRNA 等非编码RNA 的研究越来越成熟。miRNA 属于非编码小RNA,由19~24 个核苷酸构成,通过与靶基因3′非翻译区结合,参与mRNA 转录后的调控,可参与调控细胞发育、分化、凋亡、增殖等细胞功能[11]。
本课题组前期研究[12]发现低剂量的ALA-PDT预处理可活化p53,诱导DNA 的SOS 损伤修复反应,加速清除UVB 诱导的CPDs,减少角质细胞凋亡,对皮肤具有光保护作用。国内学者[13-14]报道,miR-23a 的表达水平与紫外线诱导的细胞凋亡率有关,过表达miR-23a 可减轻细胞凋亡,减轻光损伤。但是对低剂量ALA-PDT 处理后的miR-23a 表达水平尚不清楚。本研究使用低剂量ALA-PDT 预处理人成纤维细胞,予UVB 照射,检测miR-23a 的表达水平和细胞凋亡情况。
1 材料和方法
1.1 材料来源 新鲜儿童包皮由南通大学附属南通第三医院泌尿外科提供;该研究已通过南通大学附属南通第三医院的伦理审核(批准文件序列号:E2019001);DMEM(Dulbecco′s modified Eagle medium)培养基购自Gibco 公司;Lipo8000TM转染试剂、青霉素-链霉素溶液、Annexin V-FITC 凋亡检测试剂盒、胰蛋白酶购自碧云天生物科技公司;ALA 由上海复旦张江医药生物公司提供;miR-23a 引物、miR-23a inhibitor、miR-23a inhibitor control、U6 均由广州锐博生物技术有限公司提供;UVB 辐射灯、紫外线辐射强度仪由上海希格玛高技术有限公司生产。FACSCaliburTM流式细胞仪由美国BD 公司生产;LED 光谱治疗仪购自徐州科诺医学仪器设备有限公司;实时定量聚合酶链式反应(real time quantitative polymerase chain reaction,qRT-PCR)仪(型号:CFX Connect)购自Bio-Rad 公司。
1.2 实验方法
1.2.1 细胞提取、培养 儿童包皮放入含有磷酸缓冲盐溶液(phosphate buffered saline,PBS)的离心管中,去除PBS,碘附浸泡9 min,用含有1%青霉素-链霉素溶液的PBS 反复冲洗至无明显血迹;分离去除包皮皮下组织,剪成0.4~0.5 cm2大小;用含1%青霉素-链霉素溶液的PBS 冲洗3 次;去除PBS,加入0.5%Dispase 酶消化液,置于4 ℃冰箱中过夜;取出后去除表皮,用0.1%胶原酶消化液浸泡真皮部分,在细胞培养箱中放置50 min,取出后加入含10%胎牛血清及1%青霉素-链霉素溶液的完全培养基,使用吸管反复吹打,200 目过滤网过滤细胞;过滤后的细胞悬液1 000 r/min 离心5 min,去除上清液,加入完全培养基,吹打后放入细胞瓶中混匀,在37 ℃、含5%CO2饱和湿度的细胞培养箱中培养;在细胞密度达到90%时进行传代,使用3~6 代的人成纤维细胞进行实验。
1.2.2 ALA-PDT 预处理 使用DMEM 培养基溶解ALA 配置成1 mmol/L 浓度的溶液,孵育人成纤维细胞4 h,除去培养基,PBS 清洗细胞,覆盖少量PBS防止细胞干涸,置于光动力治疗仪下,使用635 nm的红光辐射,距离10 cm,功率为50 mW/cm2,照射剂量为9 J/cm2,照射180 s,完成后去除PBS,加入完全培养基,置于37 ℃、含5%CO2饱和湿度的细胞培养箱中继续生长。
1.2.3 UVB 辐射 取75%融合度的成纤维细胞,去除培养基,加少量PBS,置于UVB 辐射灯下,灯管距离培养皿15 cm,UVB 辐射强度仪检测荧光灯辐射强度,辐射剂量=时间×辐射强度。完成后吸尽PBS,加入完全培养基,置于细胞培养箱中继续培养24 h。
1.2.4 实验分组 对照组为正常生长的人成纤维细胞,未予其他处理;UVB 组细胞予UVB 60 mJ/cm2照光;ALA-PDT+UVB 组先予ALA-PDT(1 mmol/L,9 J/cm2)处理后培养24 h,然后使用60 mJ/cm2剂量的UVB 照射。
1.2.5 qRT-PCR 去除培养基,每皿加入1 mL Trizol,吹打收集细胞至EP 管中,室温放置5 min,每管中加入200 μL 氯仿,颠倒混匀15 s,12 000 g 4 ℃离心10 min,吸取上层无色水相至新的EP 管,加入相等体积异丙醇,颠倒混匀,室温放置10 min,12 000 g 4 ℃离心10 min,去除上清,加入1 mL 75%乙醇溶液,7 500 g 4 ℃离心5 min,吸尽液体,收干后检测RNA 浓度。将测得的RNA 产物加入10 μL 的Poly(A) Tailing 反应体系,37 ℃反应1 h。然后制备20 μL逆转录体系,42 ℃反应1 h,72 ℃孵育10 min,得到所需cDNA。最后制备20 μL qRT-PCR 反应体系,反应程序:95 ℃反应10 min,循环1 次;95 ℃反应2 s、60 ℃反应20 s、70 ℃反应10 s,循环40 次。上述反应程序按照广州锐博生物技术有限公司miRNA qRT-PCR 试剂盒使用说明进行实验。
1.2.6 细胞转染 转染前24 h 进行细胞接种,每孔细胞数700 000 个,等待细胞密度达70%,去除培养基,更换新鲜完全培养基。清洁离心管中先后加入DMEM 培养基、适量稀释后miR-23a inhibitor、miR-23a inhibitor control 和Lipo8000TM转染试剂,轻轻混匀,室温放置20 min,加入至培养皿中培养。
1.2.7 流式细胞检测 收集各组细胞培养液至对应离心管中,PBS 轻柔冲洗贴壁细胞,加入适量胰酶消化,收集细胞至对应离心管中,1 000 r/min 离心5 min,弃除上清液,用PBS 轻轻重悬细胞,1 000 r/min 离心5 min,使用Annexin V-FITC 凋亡检测试剂盒进行细胞染色。室温避光放置20 min,使用流式细胞仪进行检测。Annexin V(+)/PI(+)为晚期凋亡,Annexin V(+)/PI(-)为早期凋亡,总凋亡率为两者相加之和。
2 结 果
2.1 ALA-PDT 预处理增强miR-23a 表达 采用qRT-PCR 法检测对照组、UVB 组、ALA-PDT+UVB组的miR-23a 表达情况,相较于对照组,UVB 组的miR-23a 表达量增加,而经ALA-PDT 处理后,miR-23a 的表达量较UVB 组明显增高(P<0.05)(图1)。
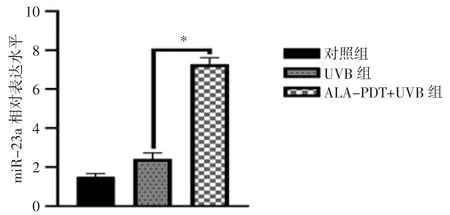
图1 qRT-PCR 分析miR-23a 在各组中的表达(*P<0.05)
2.2 抑制miR-23a 可降低ALA-PDT 预处理对UVB诱导的细胞凋亡的抑制 为了进一步验证ALAPDT 预处理对miR-23a 的调控作用,构建了miR-23a 抑制物的小干扰RNA。将这些寡核苷酸序列转染到人成纤维细胞中,首先验证了miR-23a 抑制物可抑制miR-23a 的表达,miR-23a-inhibitor 组与对照组比较差异有统计学意义(P<0.05)(图2),然后进行功能实验。分组为对照组、UVB 组、ALA-PDT+UVB组、ALA-PDT+miR-23a-inhibitor+UVB 组、ALAPDT+inhibitor-control+UVB 组。通过流式细胞仪定量检测,UVB 组凋亡率为(24.8±1.81)%,ALA-PDT+UVB 组细胞凋亡率显著下降(15.62±2.24)%,两组比较差异有统计学意义(P<0.05);ALA-PDT+miR-23ainhibitor+UVB 组细胞凋亡率(25.81±2.53)%,与ALAPDT+UVB 组相比差异有统计学意义(P<0.05),见图3。

图2 qRT-PCR 检测miR-23a 在各组中的表达(*P<0.05)
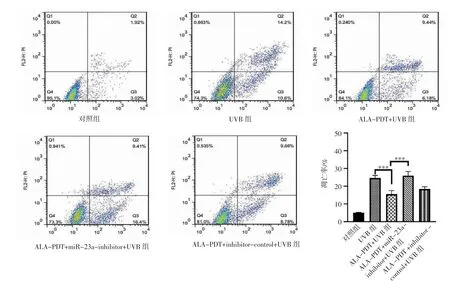
图3 流式细胞术检测凋亡率(***P<0.001)
3 讨 论
miR-23a 主要作用的靶基因有FUT9、ETNK1、STK4、RAB39B、TOP1、CASP7 等,分别参与物质代谢、信号转导、细胞增殖、DNA 复制、细胞凋亡等细胞功能调控,而发挥作用的差异主要与靶细胞的特性有关[15]。在不同的靶细胞中,miR-23a 通过调控多种靶基因和信号通路参与发挥促凋亡和抗凋亡的作用。J.MAO 等[16]在心机梗死的治疗中发现,miR-23a可以通过调控Caspase-7 参与肿瘤坏死因子α 诱导的间充质干细胞凋亡,过表达的miR-23a 可以保护骨髓间充质细胞的凋亡,通过移植间充质干细胞过表达miR-23a 可以缩小心肌梗死的范围。研究[17]表明,在动脉粥样硬化疾病中,过表达miR-23a 可通过抑制转录因子HSP90 抑制NF-κB 通路降低巨噬细胞和泡沫细胞的凋亡,减轻症状。但是同样在冠心病中,miR-23a 与冠心病的风险程度呈正相关[18]。而在有关结肠癌的报道[19]中,miR-23a 可通过APAF-1/Caspase-9 途径抑制氟尿嘧啶诱导的细胞凋亡,这也是miR-23a 与凋亡相关性的表现。
miR-23a 在皮肤光损伤中也发挥着重要的调控作用,且已被多次作为重要的治疗靶点进行报道。在紫外线照射引起的急性光损伤中,UVB 照射后,细胞DNA 受损,生成CPDs 和6-4PPs,p53 通路被激活,细胞周期阻滞,当生成的光产物不能被及时修复清除,则会通过细胞凋亡方式来清除受损细胞。而过表达miR-23a 可抑制UVB 诱导的Caspase-7 和Caspase-3 活化,调控内源性的凋亡通路,加快CPDs的清除速度,最终减少UVB 诱导的细胞凋亡[14]。研究[2,20]发现黄芩苷预处理可诱导miR-23a 过表达,通过减轻生长抑制、细胞周期阻滞,加速光产物CPDs的清除,加快DNA 损伤修复、p53 蛋白表达和降低细胞凋亡率,发挥光保护的作用。本课题组之前研究[12]已证明低剂量ALA-PDT 预处理产生的低剂量的ROS,通过激活p53 通路提前诱导保护性的DNA 损伤修复,加快CPDs 产物的清除,减少凋亡,减轻UVB 导致的皮肤光损伤,但具体的调控机制仍需进一步探究。本研究发现,低剂量ALA-PDT 预处理人成纤维细胞可显著提高miR-23a 的表达水平,而UVB 诱导的细胞凋亡则明显减少,当miR-23a 的表达被抑制时,低剂量ALA-PDT 预处理减轻凋亡的作用也被抑制。这与上述文献中关于miR-23a 在急性光损伤细胞模型中的表达变化以及发挥光保护作用有着类似的结果。这可能就是低剂量ALA-PDT预处理调控miR-23a 改善UVB 所诱导的细胞凋亡的机制。在最新的研究中我们也试图从低剂量ALA-PDT 调控凋亡通路进行验证。另外也有报道[21]在光老化过程中,miR-23a 可以调控细胞自噬,减轻紫外线辐射导致的皮肤光老化现象。是否在急性光损伤中也存在类似的调控机制,值得进一步研究。
综上所述,本研究发现低剂量ALA-PDT 预处理可上调miR-23a 减轻UVB 诱导的成纤维细胞凋亡,为低剂量ALA-PDT 预处理防护UVB 损伤提供新的研究依据和研究方向,但具体的分子机制有待于进一步研究。

