猪RNase L与PRRSV nsp4缺失突变体的构建及其互作研究
于莹,李均同,丛晓燕,齐静,刘思当,郑乾坤,孙文博,王爱国,郑龙祥,吴香菊,*,杜以军*,单虎
(1. 青岛农业大学动物医学院,山东 青岛 266000;2. 山东省畜禽疫病防治与繁育重点实验室/山东省农业科学院畜牧兽医研究所,山东 济南 250100;3. 山东农业大学动物科技学院,山东 泰安 271018;4. 得利斯集团有限公司,山东 诸城 262216)
猪繁殖与呼吸综合征(procine reproductive and respiratory syndrome, PRRS)是由猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus, PRRSV)引起的一种高度接触性传染病,通过呼吸道、胎盘、生殖道传播,通常表现为各年龄段猪的呼吸困难以及母猪的生殖衰竭,如晚期流产、死产和木乃伊化,致死率可高达80%~100%[1],目前仍然是世界范围内养猪业的主要威胁。PRRS于20世纪80年代末,几乎同时在北美和欧洲出现,然后在几年内迅速传播到世界其他地区。在1991年和1992年分别于荷兰和美国出现[2]。1996年在爱荷华州和美国其他州暴发了“急性PRRS”[3]。2006年高致病性PRRSV(HP-PRRSV)在中国以未知的方式大规模暴发,传播到了10多个省(自治市或自治区),感染了超过200万头猪,造成约40万死亡病例。该病具有唯一的感染宿主,而且一般伴随混合与继发性感染。
非结构蛋白nsp4是PRRSV编码的一种蛋白酶,可以下调免疫反应[4]。通过切割受体或接头分子IPS-1(interferon-β promoter stimulator 1)、NEMO(NF-κB essential modulator)或IκB的催化亚基IΚΚα显著抑制I型干扰素的产生,对IFN-β启动子的激活具有抑制作用。研究表明nsp4激活caspase-3、-8和-9诱导细胞凋亡,并且该诱导凋亡活性依赖于nsp4的丝氨酸蛋白酶活性。PRRSV nsp4的晶体结构[5]揭示了该蛋白由3个结构域组成,包括2个类糜蛋白酶β结构域和1个额外的C-末端α/β结构域,分别位于1~69 aa结构域Ⅰ,89~153 aa结构域II和157~199 aa结构域Ⅲ[6],其中结构域Ⅰ和Ⅱ形成典型的糜蛋白酶样两管折叠。C-末端结构域Ⅲ对于蛋白水解活性是必不可少的,可能参与微调复制酶多蛋白水解[7]。nsp4的活性位点位于结构域Ⅰ和Ⅱ之间,包含典型的催化三联体His39、Asp64和Ser118[8]。
核糖核酸内切酶L(RNase L)是一种由干扰素诱导产生的抗病毒蛋白(antiviral protein, AVP),参与机体内的特异性、非特异性免疫。RNase L结构包含3个结构域:N-端锚定蛋白重复区、蛋白激酶同源区、C-端核糖核酸酶区[9]。活化的RNase L切割单链RNA,包括病毒RNA和细胞RNA[10]。2-5A依赖的RNase L可以降解核糖体中的rRNA[11]。RNase L还可以诱导细胞凋亡等。本课题组前期探究到sRNase L具有抗PRRSV活性并筛选到sRNase L与PRRSV nsp4互作[12-13],Silverman等[14]研究发现R462Q的突变也终止了RNase L与2-5A结合区域的翻译,抑制了2-5A对RNase L的激活。Dong等[15]证明RNase L突变体W632A、D661A、R667A和H672A缺乏核糖核酸酶活性。Nakanishi等[16]试验证明Tyr712和Phe716对RNA的结合和切割功能起到重要的作用。本研究将分别构建sRNase L突变体、缺失体及nsp4的截短体,通过免疫共沉淀试验筛选两者的互作区段及位点,为深入探究sRNase L与nsp4互作抗PRRSV机制奠定基础,并为PRRSV感染的防控提供新的思路和方法。
1 材料与方法
1.1 材料
人胚胎肾上皮细胞(HEK-293T)、pXJ41-Flag-sRNase L、pXJ41-HA-nsp4和空载体pXJ41由本实验室保存。
1.2 主要试剂
DNA Marker DL5000、DNA Marker DL2000、Prime STAR HS DNA Ploymerase等购自TaKaRa宝生物工程(大连)有限公司;pfu Ultra High Fidelity DNA Ploymerase购自Stratagene公司;限制性内切酶HindⅢ、KpnⅠ、DpnⅠ、EcoRⅠ、XhoⅠ及T4 DNA Ligase购自Fermentas公司;质粒小提试剂盒、DNA回收试剂盒购自北京天根生物工程有限公司;WesternBright Sirius化学发光检测试剂盒购自Advansta公司;细胞裂解液、Western blot一抗稀释液购自碧云天公司;转染试剂Lipofectamine®3000购自Invitrogen公司;NC膜购自Bio-RAD公司;青链霉素混合液、Flag-beads、PMSF、Tween-20、cocktail购自Sigma公司;Opti-MEM、高糖型DMEM细胞培养基、胰蛋白酶购自Gibco公司;辣根过氧化物酶(HRP)标记羊抗鼠抗体、辣根过氧化物酶(HRP)标记羊抗兔抗体购自武汉博士德公司;DH5α感受态细胞购自北京全式金生物技术有限公司;血清购自BI公司;β-actin抗体购自Santa Cruz公司;兔源HA抗体、鼠源HA抗体、兔源Flag抗体、鼠源Flag抗体购自Sigma公司。
1.3 引物设计
根据文献报道,结合载体pXJ41的酶切位点,设计了3对含HA标签序列扩增nsp4 3个结构域的特异性引物;4对含Flag标签序列扩增RNase L突变体的特异性引物;1对含Flag标签序列扩增RNase L缺失体的特异性引物;以实验室保存的HA-nsp4、Flag-RNase L为模板,进行PCR扩增,引物送北京擎科生物技术有限公司合成,引物信息如表1所示。

表1 PCR引物及序列
1.4 pXJ41-Flag-sRNase L突变体的PCR扩增
以pXJ41-Flag-sRNase L质粒为模板,用Flag-sRNase L突变体上下游引物进行PCR扩增,反应体系为25 μL:pXJ41-Flag-sRNase L 100 ng,dNTP 1.5 μL,10×pfu buffer 2.5 μL,Flag-sRNase突变体上下游引物各0.7 μL,pfu Ultra High Fidelity DNA Ploymerase 0.5 μL,ddH2O补足25 μL。PCR反应条件为95 ℃预变性2 min;95 ℃变性20 s,58 ℃退火20 s,72 ℃延伸7 min,25个循环;72 ℃延伸7 min。PCR产物进行1.0%琼脂糖凝胶电泳。
1.5 pXJ41-Flag-sRNase L突变体重组质粒的构建及鉴定
用DpnⅠ酶切pXJ41-Flag-sRNase L突变体PCR扩增产物,将酶切产物转化到DH5α感受态细胞中,37 ℃过夜培养16 h,挑取单菌落接种于含有氨苄西林抗性的LB培养基中,37 ℃,200 r/min过夜培养,第2天提取质粒,送北京擎科生物科技有限公司测序。
1.6 缺失体Flag-sRNase L 1~586aa的PCR扩增
以pXJ41-Flag-sRNase L为模板,以Flag-sRNase L 1~586 aa-Fwd和Flag-sRNase L 1~586 aa-Rev作为上下游引物,PCR扩增缺失体Flag-sRNase L1~586 aa基因,PCR反应体系为25 μL:pXJ41-Flag-sRNase L 100 ng,dNTP 2 μL,5×Prime STAR Buffer 5 μL,Flag-sRNase L 1~586 aa-Fwd和Flag-sRNase L 1~586 aa-Rev各0.7 μL,Prime STAR HS DNA Ploymerase(2.5 U/μL)0.25 μL,ddH2O补足25 μL。PCR反应条件为98 ℃预变性2 min;98 ℃变性10 s,57 ℃退火30 s,72 ℃延伸3 min,30个循环;72 ℃延伸7 min。PCR产物进行1.0%琼脂糖凝胶电泳。
1.7 HA-nsp4截短体的PCR扩增
以pXJ41-HA-nsp4为模板,分别以HA-nsp4-D1/D2/D3-Fwd和HA-nsp4-D1/D2/D3-Rev作为上下游引物,PCR扩增HA-nsp4截短体基因,PCR反应体系为25 μL:pXJ41-HA-nsp4 100 ng,dNTP 2 μL,5×Prime STAR Buffer 5 μL,HA-nsp4-D-Fwd和HA-nsp4-D-Rev各0.7 μL,Prim STAR HS DNA Ploymerase(2.5 U/μL)0.25 μL,ddH2O补足25 μL。PCR反应条件为98 ℃预变性2 min;98 ℃变性10 s,57 ℃退火30 s,72 ℃延伸2 min,30个循环;72 ℃延伸7 min。PCR产物进行1.0%琼脂糖凝胶电泳。
1.8 重组质粒的构建及鉴定
用KpnⅠ和Hind Ⅲ分别双酶切缺失体Flag-sRNase L 1~586aa、HA-nsp4截短体基因和pXJ41载体的胶回收产物,分别将缺失体Flag-sRNase L 1~586aa基因和HA-nsp4截短体基因与pXJ41载体用T4 DNA Ligase 16 h过夜连接。次日,将连接产物转化到DH5α感受态细胞中,37 ℃过夜培养,挑取单菌落接种于含有氨苄西林的LB固体培养基中,37 ℃,200 r/min过夜培养,第2天提取质粒,进行KpnⅠ和Hind Ⅲ双酶切鉴定。鉴定为阳性的质粒送北京擎科生物科技有限公司测序。
1.9 转染
HEK-293T细胞在6 cm圆盘中进行培养,待细胞密度达到104个/mL时,利用Lipofectamine®3000转染试剂将2.5 μg的HA-nsp4分别与的2.5 μg的pXJ41、pXJ41-Flag-sRNase L、pXJ41-Flag-sRNase L R460A、pXJ41-Flag-sRNase L R675A、pXJ41-Flag-sRNase L Y720A、pXJ41-Flag-sRNase L F724A、缺失体pXJ41-Flag-sRNase L 1~586 aa按Lipofectamine®3000说明书共转染到细胞中;将2.5 μg的pXJ41-Flag-sRNase L分别与2.5 μg的pXJ41、pXJ41-HA-nsp4-D1、pXJ41-HA-nsp4-D2、pXJ41-HA-nsp4-D3按Lipofectamine®3000说明书共转染到HEK-293T细胞中。
1.10 免疫共沉淀(Co-IP)及Western blot
转染24 h后,将6 cm圆盘置冰上,弃上清,用 PBS洗2遍后加500 μL细胞裂解液裂解细胞,20 min后将样品收集到1.5 mL EP管中,4 ℃ 12 000 r/min离心10 min,取60 μL上清与上样缓冲液混合煮沸10 min标记为input样品,用于鉴定蛋白表达情况。剩余上清加入Flag-beads,4 ℃旋转孵育4 h,孵育结束后,4 500 r/min离心2 min弃上清,用1 mL细胞裂解液重悬,重复洗5遍,弃上清后与上样缓冲液混合煮沸15 min标记为免疫共沉淀样品(IP样品),用于检测互作情况。
将样品进行SDS-PAGE并转印到NC膜上。用5%脱脂奶粉室温封闭2 h,IP样品分别用一抗稀释液稀释的兔抗HA、兔抗Flag作为一抗;input样品分别用鼠抗HA、鼠抗Flag、鼠抗β-actin抗体作为一抗,4 ℃下过夜孵育,二抗室温下孵育1 h,用化学发光显色试剂盒WesternBright Sirius进行显色,BIO-RAD凝胶成像仪进行曝光。
2 结果与分析
2.1 目的基因的扩增
通过PCR扩增获得pXJ41-Flag-sRNase L R460A、pXJ41-Flag-sRNase L R675A、pXJ41-Flag-sRNase L Y720A、pXJ41-Flag-sRNase L F724A、缺失体Flag-sRNase L 1~586 aa、HA-nsp4-D1、HA-nsp4-D2、HA-nsp4-D3基因。扩增产物经过1.0%琼脂糖凝胶电泳检测到大小为6 525 bp(pXJ41-Flag-sRNase L)(图1A)、6 525 bp(pXJ41-Flag-sRNase L突变体)(图1A)、2 256 bp(Flag-sRNase L)(图1B)、1 782 bp(缺失体Flag-sRNase L 1~586aa)(图1B)、639 bp(HA-nsp4)(图1C)、267 bp(HA-nsp4-D1)(图1C)、317 bp(HA-nsp4-D2)(图1C)、177 bp(HA-nsp4-D3)(图1C)的特异性扩增片段,与预期片段大小相符。

A. pXJ41-Flag-sRNase L、pXJ41-Flag-sRNase L R460A、pXJ41-Flag-sRNase L R675A、pXJ41-Flag-sRNase L Y720A、pXJ41-Flag-sRNase L F724A基因的PCR扩增产物;B. Flag-sRNase L、缺失体Flag-sRNase L 1~586 aa基因的PCR扩增产物;C:HA-nsp4、HA-nsp4-D1、HA-nsp4-D2、HA-nsp4-D3基因的PCR扩增产物
2.2 pXJ41-Flag-sRNase L突变体质粒构建及鉴定
重组质粒pXJ41-Flag-sRNase L各突变体测序结果表明质粒pXJ41-Flag-sRNase L R460A、pXJ41-Flag-sRNase L R675A、pXJ41-Flag-sRNase L Y720A、pXJ41-Flag-sRNase L F724A构建成功(图2)。

A. pXJ41-Flag-sRNase L R460A;B. pXJ41-Flag-sRNase L R675A;C. pXJ41-Flag-sRNase L Y720A;D. pXJ41-Flag-sRNase L F724A
2.3 pXJ41-HA-nsp4截短体质粒构建及鉴定
重组质粒pXJ41-HA-nsp4-D1、pXJ41-HA-nsp4-D2、pXJ41-HA-nsp4-D3经EcoRⅠ/XhoⅠ双酶切后得到预期大小片段(图3A),测序结果表明质粒pXJ41-HA-nsp4-D1、pXJ41-HA-nsp4-D2、pXJ41-HA-nsp4-D3构建成功。
2.4 缺失体pXJ41-Flag-sRNase L 1-586aa质粒构建及鉴定
重组质粒缺失体pXJ41-Flag-sRNase L 1~586 aa经KpnⅠ/Hind Ⅲ双酶切后得到预期大小片段(图3B),测序结果表明质粒缺失体pXJ41-Flag-sRNase L 1~586 aa构建成功。
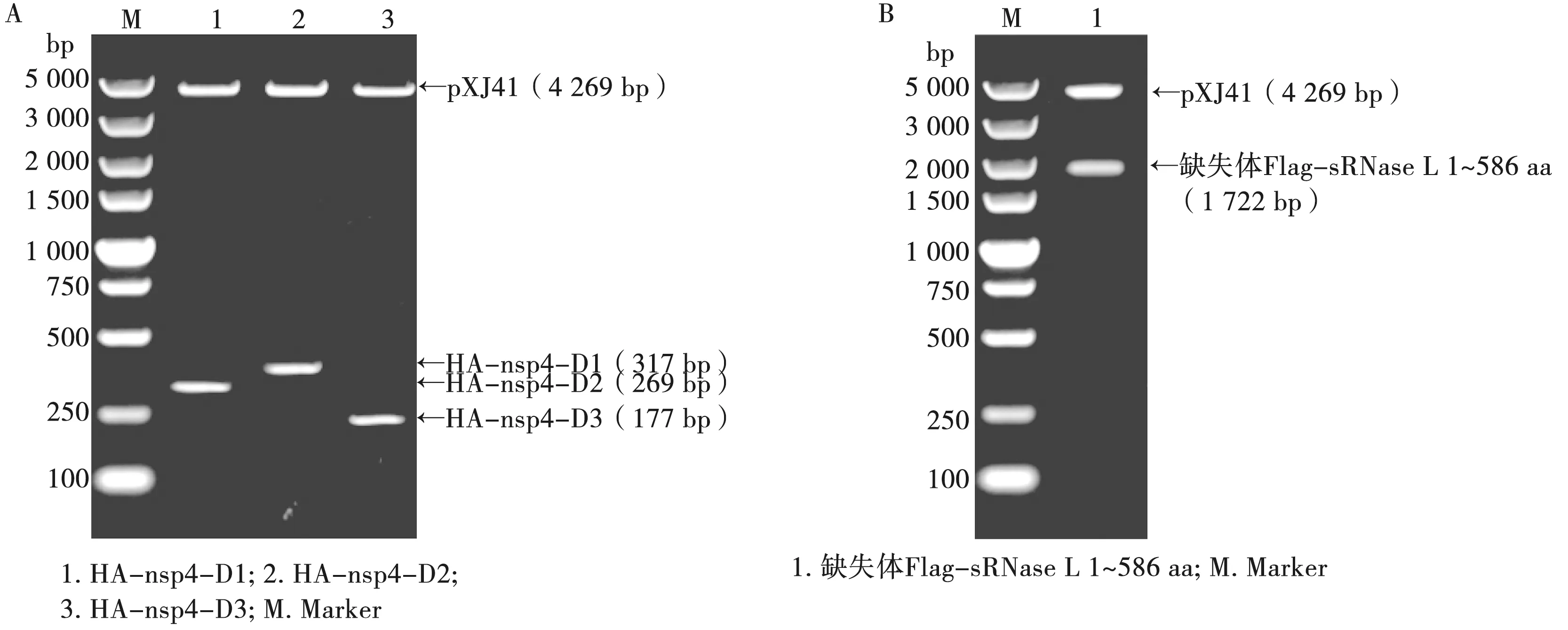
A. pXJ41-HA-nsp4-D1、pXJ41-HA-nsp4-D2、pXJ41-HA-nsp4-D3双酶切鉴定;B. 缺失体pXJ41-Flag-sRNase L 1~586 aa双酶切鉴定
2.5 免疫共沉淀筛选与nsp4互作的sRNase L位点及区段
pXJ41-HA-nsp4分别与pXJ41-Flag-sRNase L R460A、pXJ41-Flag-sRNase L R675A、pXJ41-Flag-sRNase L Y720A、pXJ41-Flag-sRNase L F724A、缺失体pXJ41-Flag-sRNase L 1~586aa、pXJ41-Flag-sRNase L、pXJ41共转染到HEK-293T细胞中,pXJ41-Flag-sRNase L R460A、pXJ41-Flag-sRNase L R675A、pXJ41-Flag-sRNase L Y720A、pXJ41-Flag-sRNase L F724A、缺失体pXJ41-Flag-sRNase L 1~586aa、pXJ41-Flag-sRNase L以及pXJ41-HA-nsp4质粒均成功表达;免疫共沉淀结果显示, pXJ41-Flag-sRNase L R460A、pXJ41-Flag-sRNase L R675A、pXJ41-Flag-sRNase L Y720A、pXJ41-Flag-sRNase L F724A、pXJ41-Flag-sRNase L分别与pXJ41-HA-nsp4发生了相互作用,但缺失体pXJ41-Flag-sRNase L 1~586aa未与nsp4发生互作,表明sRNase L第3结构域(587~744aa)为与nsp4互作区段,但不包括第675位精氨酸、第720位酪氨酸、第724位苯丙氨酸。见图4。

A. IP样品用兔源HA抗体做Western blot检测nsp4互作条带;B. IP样品用兔源Flag抗体做Western blot检测sRNase L条带;C. Input样品直接做Western blot检测sRNase L、sRNase L突变体、缺失体的表达情况;D. Input样品直接做Western blot检测nsp4的表达情况
2.6 免疫共沉淀筛选与sRNase L互作的nsp4区段
将pXJ41-Flag-sRNase L分别与pXJ41、pXJ41-HA-nsp4-D1、pXJ41-HA-nsp4-D2、pXJ41-HA-nsp4-D3共转染到HEK-293T细胞中。pXJ41-HA-nsp4-D1、pXJ41-HA-nsp4-D2、pXJ41-HA-nsp4-D3以及pXJ41-Flag-sRNase L质粒均成功表达;免疫共沉淀结果显示,pXJ41-HA-nsp4-D1与pXJ41-Flag-sRNase L发生了相互作用。见图5。
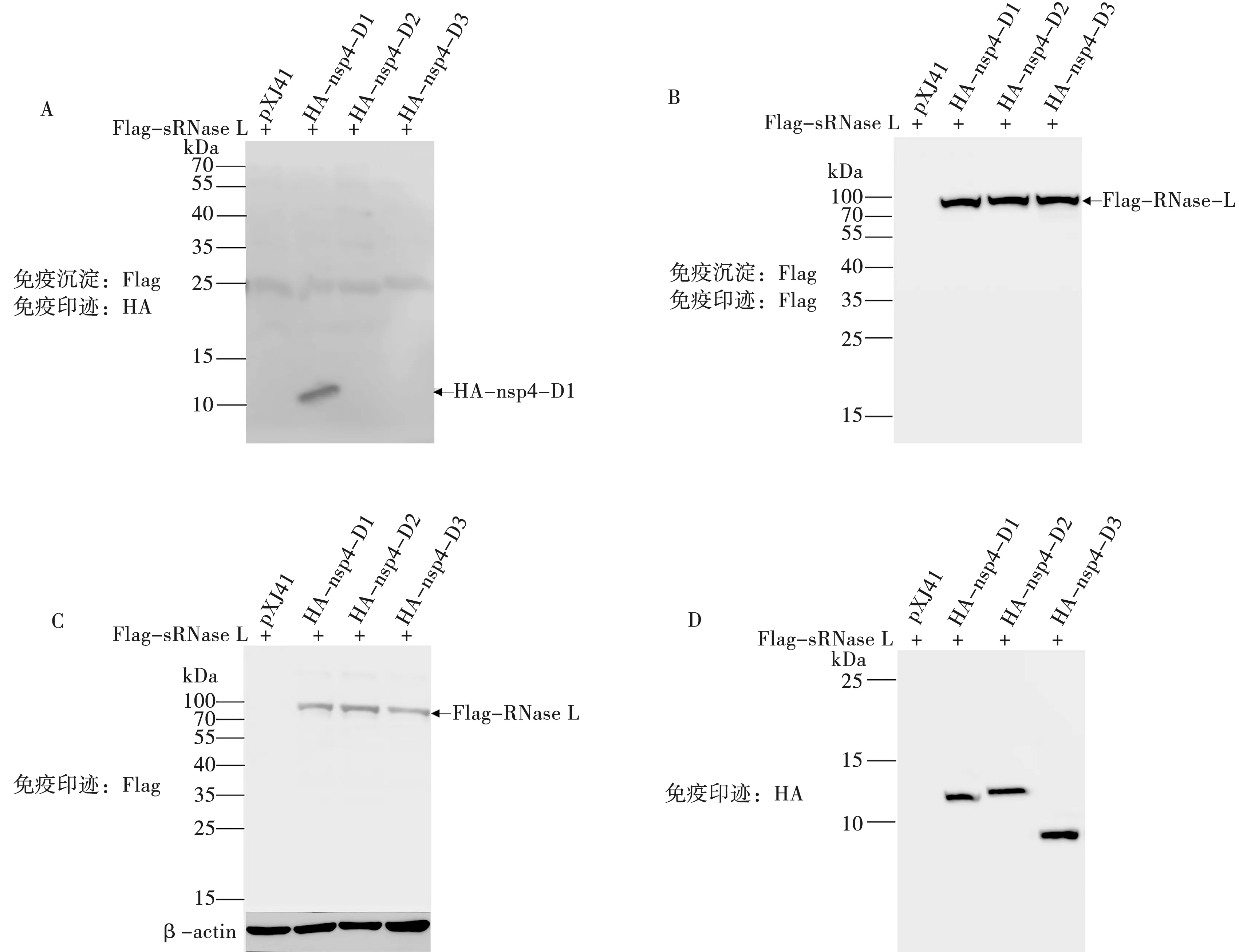
A. IP样品用兔源HA抗体做Western blot检测nsp4截短体互作条带;B. IP样品用兔源Flag抗体做Western blot检测sRNase L条带;C. Input样品直接做Western blot检测sRNase L的表达情况;D. Input样品直接做Western blot检测nsp4截短体的表达情况
3 讨论
PRRSV是目前影响世界养猪业最重要的病毒之一, nsp4参与了宿主的先天免疫应答,与病毒的免疫调节能力密切相关。nsp4蛋白酶具有3C样丝氨酸蛋白酶(3CLSP)活性[17]。本研究将sRNase L与hRNase L进行同源性比对,根据序列比对结果设计引物,利用本实验室保存的pXJ41-Flag-sRNase L质粒,构建得到质粒pXJ41-Flag-sRNase L突变体、缺失体pXJ41-Flag-sRNase L 1~586 aa;根据nsp4三个结构域设计引物,利用实验室保存的pXJ41-HA-nsp4质粒,构建得到质粒pXJ41-HA-nsp4-D1、pXJ41-HA-nsp4-D2、pXJ41-HA-nsp4-D3,在HEK-293T细胞中进行转染,通过SDS-PAGE和Western blot检测证实pXJ41-Flag-sRNase L突变体、缺失体pXJ41-Flag-sRNase L 1-586 aa、pXJ41-HA-nsp4-D1、pXJ41-HA-nsp4-D2、pXJ41-HA-nsp4-D3表达成功。
本研究将nsp4分成分别包含3个结构域的截短体pXJ41-HA-nsp4-D1(1~80 aa)、pXJ41-HA-nsp4-D2(60~156 aa)、pXJ41-HA-nsp4-D3(157~204 aa),通过Co-IP证实pXJ41-Flag-sRNase L能够与pXJ41-HA-nsp4-D1发生互作,其余2个结构域的截短体(pXJ41-HA-nsp4-D2、pXJ41-HA-nsp4-D3)均不能与sRNase L发生互作,说明nsp4的第一个结构域(pXJ41-HA-nsp4-D1)是与sRNase L发生互作的必要条件。图4A、图5A结果显示,免疫共沉淀后出现的条带为pXJ41-HA-nsp4和pXJ41-HA-nsp4-D1蛋白的大小,说明pXJ41-Flag-RNase L与pXJ41-HA-nsp4之间不是通过共价键结合的。
RNase L是一种内切单链RNA的核糖核酸酶,这种核酸酶只有很低的序列特异性[18]。目前人的RNase L(hRNase L)已研究比较透彻。Silverman等[14]研究发现R462Q的突变也终止了RNase L与2-5A结合区域的翻译,抑制了2-5A对RNase L的激活。Dong等[15]证明RNase L突变体W632A、D661A、R667A和H672A缺乏核糖核酸酶活性。Nakanishi等[16]试验证明Tyr712和Phe716对RNA的结合和切割功能起到重要的作用。sRNase L活性位点尚无报道,sRNase L和hRNase L氨基酸同源性为79.2%,且已报道的hRNase L活性位点在sRNase L序列中高度保守,我们根据hRNase L活性位点构建了对应的pXJ41-Flag-sRNase L R460A、pXJ41-Flag-sRNase L R675A、pXJ41-Flag-sRNase L Y720A、pXJ41-Flag-sRNase L F724A,Co-IP证实sRNase L第3结构域(587~744 aa)为与nsp4互作区段,但不包括第675位精氨酸、第720位酪氨酸、第724位苯丙氨酸。本研究确定与nsp4互作的sRNase L的区段为第3结构域(587~744 aa),并将与sRNase L互作的nsp4区段缩小到1~60 aa,为进一步探究sRNase L与nsp4互作抗PRRSV机制奠定了坚实的基础。

