胎牛子宫类器官及内膜上皮细胞的分离培养
赵英博,张君涛,贺来增,张帆,李怡屏,李娟娟,闫鹏辉,张志平,邓立新
(河南农业大学动物医学院,河南 郑州 450046)
随着养牛业的产业化和集约化发展,生殖系统疾病也越来越多,繁殖性能下降导致巨大损失。目前,常见的生殖系统疾病主要包括胎衣不下、卵巢囊肿、子宫内膜炎和阴道炎等,严重影响产业的健康发展,其中子宫疾病急剧上升,引起了众多学者的关注。子宫是奶牛生殖系统的组成部分,主要包括外层浆膜、中层子宫肌层和内层子宫内膜,其中子宫内膜是子宫干细胞的存在部位[1],在动物的发情、妊娠和分娩等过程中发挥着重要作用[2-4]。因此,建立成熟的子宫内膜上皮细胞体外培养体系对于研究子宫内膜生理和病理具有重要意义[5]。
类器官是源于干细胞或祖细胞的衍生结构[6],具备类似完整器官的三维结构和生理学功能。类器官培养方法的建立为组织的正常发育和疾病致病机理的研究提供了平台[7]。目前,已经建立了多种类器官的培养方法,如胃[8]、肠[9]、肾脏[10]、肝脏[11]和脑[12]等。然而对子宫类器官的研究很少,而且主要通过细胞混合培养或细胞支架等方法研究人子宫类器官[13-14],国内对于这一方面的研究更是鲜有报道。国内对于子宫的研究多局限于体外模型和细胞方面,并已对人[15]、羊[16]、牛[17]等多种子宫内膜进行体外上皮细胞培养,已建立相应的培养技术,但子宫细胞由于局限性[18],市面尚未有相关细胞系。本试验通过组织学检查选取完整的子宫内膜组织,比较不同月龄的子宫类器官培养率,以子宫类器官为基础分离培养子宫内膜上皮细胞,提高子宫内膜上皮细胞的培养效率,为建立完善的子宫内膜上皮细胞模型提供借鉴。
1 材料与方法
1.1 材料
1.1.1 试验动物
4~6月龄南阳黄牛胎牛,购于河南省郑州市肉牛屠宰场。
1.1.2 主要试剂
DMEM/F 12培养基(Hyclone);血清(杭州四季青);胰蛋白酶(Aladdin);非必需氨基酸(Gibco公司);两性霉素B、庆大霉素(Coolaber);PBS粉末、转铁蛋白、青链霉素混合液、丙酮酸钠(Solarbio);Wnt 3a[Mouse](Abcam);表皮生长因子(EGF)[Human](Bio-Techne);R-spondin-1[Human]、Noggin[Human](MCE);抗体角蛋白18(KRT18)[Rabbit](Bioss)、异硫氰酸荧光素(FITC)[Rabbit](Bioss)。
1.1.3 工作液配制
PBS液:1 U/mL青链霉素、2.5 μg/mL两性霉素B、2.5 μg/mL庆大霉素的0.01 mol/L PBS。
细胞培养液:1 U/mL青链霉素、2.5 μg/mL两性霉素B、2.5 μg/mL庆大霉素、5 μg/mL转铁蛋白、1 μmoL/mL丙酮酸钠、0.1 μmoL/mL非必须氨基酸、10%血清的DMEM/F12。
类器官培养液:156 ng/mL EGF、62.5 ng/mL Noggin、62.5 mg/mL Wnt3a、62.5 ng/mL R-spondin-1、10%血清的DMEM/F12。
胰酶:0.25 g胰蛋白酶和0.04 g EDTA溶于100 mL PBS中。
1.2 方法
1.2.1 胎牛子宫形态观察
胎牛离体后,无菌操作下获取胎牛子宫, PBS液清洗3遍,将子宫从中间分开,暴露子宫内侧,观察胎牛子宫结构。
1.2.2 子宫类器官培养
无菌操作下对胎牛子宫进行处理,分离子宫内膜组织,剪碎为1~2 mm组织块,用PBS液进行清洗,挑选组织再次清洗。组织转移至离心管中,反复吹打,2 000 r/min离心5 min,弃去上清,转移至含PBS液的培养皿中,在解剖镜下挑选组织块,转移至含200 μL类器官培养液的96孔板中,放入37℃、5% CO2培养箱中培养,观察出芽情况。各选取3头4~6月龄的牛胎儿子宫,比较类器官出芽率。
1.2.3 子宫类器官和组织块分离培养原代子宫内膜上皮细胞比较
类器官分离原代子宫内膜上皮细胞:取完整的类器官转移至含细胞培养液的培养皿中,吹打分离出芽组织为细小组织块, 2 000 r/min离心5 min,弃去上清,加入新的细胞培养液,转移至细胞培养瓶中,置37 ℃、5% CO2培养箱中培养,观察培养情况。培养后观察液体情况,约每48 h更换新的培养液。
组织块分离培养原代子宫内膜上皮细胞:取1.2.2中剪碎离心后的组织块,再次添加细胞培养液,2 000 r/min离心5 min,弃去上清,重新加入少量细胞培养液,将其转移至细胞培养瓶中,置于37 ℃、5% CO2培养箱中培养,观察培养情况。培养后观察液体情况,大约每48 h需要更换新的培养液,长时间未贴壁组织块应及时清理。
1.2.4 细胞纯化与传代
当组织周围有细胞向外延伸生长,形成细胞集落,用PBS液清洗2遍,胰酶消化2 min进行纯化,加入2 mL细胞培养液终止消化,弃去,重新加入细胞培养液培养。观察细胞培养情况,可对培养细胞进行多次纯化。细胞贴满底部之后进行传代,用PBS清洗液清洗2遍,1 mL胰酶进行消化,待细胞起来80%以上后加入细胞培养液终止消化,转移至10 mL离心管中,2 000 r/min离心5 min,弃去旧细胞培养液,重新加入细胞培养液分离至2个新的细胞培养瓶中培养获得传代细胞。
1.2.5 细胞生长曲线
选取P3代细胞,将细胞消化离心之后,以1.2×104个/mL接种于24孔板中,每孔加入1 mL细胞培养液,放置于37 ℃、5% CO2培养箱中培养,细胞接种后每12 h用PBS液清洗细胞,胰酶消化后,用细胞计数板进行细胞计数。
1.2.6 细胞鉴定
胰酶消化细胞制成单细胞悬液,进行细胞爬片,贴壁后弃去培养液,用4%多聚甲醛固定30 min, PBS浸洗3次,每次5 min,用0.5% Triton X-100(PBS配制)处理15 min,PBS清洗3次,每次5 min;3% BSA室温孵育30 min,PBS清洗3次,每次5 min,加入一抗KRT18,封闭四孔板,4 ℃过夜,PBS清洗3次,每次放于摇床 5 min。加入二抗FITC,避光室温下孵育1 h,PBS清洗5次,每次放于摇床3 min。用DAPI进行复染,避光室温孵育15 min,PBS清洗3次,每次5 min,避光用荧光显微镜观察。
1.3 数据统计与分析
类器官采用SPSS25.0进行单因素方差分析,结果用“平均值±标准差”表示,且认为P<0.05时为差异显著。
2 结果
2.1 子宫形态染色
子宫内膜组织结构完整,内部呈1 mm的突起,表层覆盖内膜(图1)。

A. 子宫外观;B. 子宫黏膜
2.2 不同月龄胎牛子宫类器官培养
对4、5、6月龄的胎牛进行子宫类器官培养,每月龄选取胎牛3只,组织块进行类器官培养,可以看到组织块发生了形态学改变。48 h后,组织中的子宫相关干细胞经过增殖,向外围分布,突破组织隔膜形成透明圆形结构(图2A),120 h后开始形成芽状结构,随后芽状结构增多,形成类器官(图2B)。计算组织块出芽率,对4、5、6月龄平均出芽率进行统计学分析,显示在类器官培养中,4月龄相比于5、6月龄出芽率较高(P<0.05);5月龄相较于6月龄出芽率较高,但无统计学差异(表1)。

A.组织形成圆形结构;B. 4月龄胎牛组织出芽形成类器官;C. 5月龄胎牛组织出芽形成类器官;D. 6月龄胎牛组织出芽形成类器官
2.3 组织块和子宫类器官分离培养原代子宫内膜上皮细胞
组织块分离原代子宫内膜过程中,组织块分离法获得的组织块一般在第4天后贴壁(图3A),在第7天后观察到细胞在组织块周围生长(图3B)。类器官分离的组织一般在第4天之后即可观察到以出芽组织为中心,细胞向周围延伸生长(图3C),168 h后大部分空白处被细胞占据(图3D)。在观察细胞贴壁过程中,有部分的零散细胞进行贴壁生长,大部分为成纤维细胞,呈现梭形,且在组织块分离培养中多于类器官培养。组织块周围的细胞多呈多边形,且细胞间连接紧密,逐渐向外延伸。
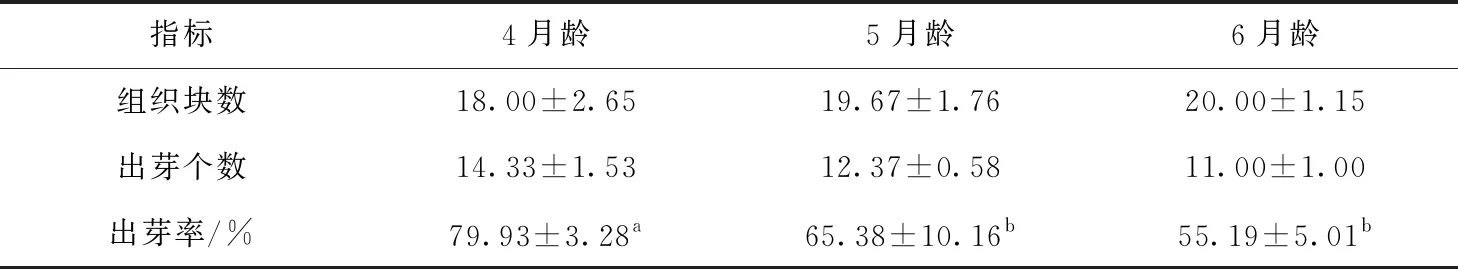
注:数据为平均数±标准差。小写字母不同表示差异显著(P<0.05),字母相同表示差异不显著(P>0.05)

A.组织块分离细胞第4天;B.组织块分离细胞第7天;C.类器官分离细胞第4天;D.类器官分离细胞第7天
2.4 细胞纯化传代培养
组织块分离法获得的细胞经纯化后进行传代培养,细胞形态较好,但外形仍然存在梭形和多边形,梭形部分较少(图4A),一般只能传至5代。类器官分离的细胞连接更为紧密,形成明显的“铺路石”样(图4B),且可以传至8代以上。

A.组织块分离纯化得到的P3代细胞;B.类器官分离纯化得到的P3代细胞
2.5 细胞生长曲线
2种方法培养的细胞均在初期生长缓慢,可能是由于细胞刚刚开始贴壁生长,大约1 d后开始进入快速生长期,60 h后,细胞数目趋于稳定,增殖速度缓慢。两种细胞的增殖速度相似,在60 h组织块分离法获得的细胞数目稍低于类器官分离的细胞数目,但并无较大区别(图5)。
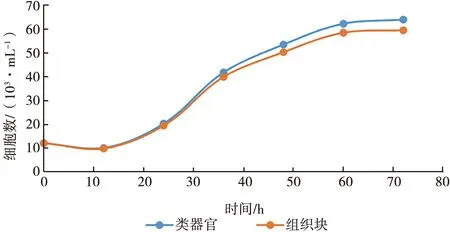
图5 细胞生长曲线
2.6 细胞免疫荧光鉴定
对2种分离方法获得的P3代子宫内膜上皮细胞进行免疫荧光鉴定。子宫内膜上皮细胞中存在特异性的角蛋白,而成纤维细胞不含有角蛋白[19-20]。DAPI染色下标记的椭圆形细胞核显示为蓝色荧光,只显示蓝色者为成纤维细胞,蓝绿色均显示者为子宫内膜上皮细胞。类器官培养法获得的子宫内膜上皮细胞数量更多,纯度更高,可达到95%以上。

A.组织块分离获得的细胞;B. 类器官分离获得的细胞
3 讨论
类器官的研究始于上世纪70年代,随着荷兰科学家Clevers及团队成功在体外构建富含Lgr5+肠道干细胞的三维结构即小肠类器官[21],类器官已成为时下研究的热点。三维类器官培养是研究胚胎发育和疾病进展的新型模型系统[22],与单一细胞类型的传统细胞培养相比,类器官可以作为研究发育、体内平衡和再生的模型,能够用于疾病建模,在器官水平上模拟病理[23],也可用在药物筛选、安全检测等相关研究,是对于在体动物试验和细胞试验的一个补充[24]。与Sugimoto等[25]培养组织类器官的培养相比较,本试验采用更加便捷、成本更低的方法尝试类器官培养。通过比较不同月龄类器官,显示4月龄胎牛更易获得子宫类器官,可能是由于胎龄不同引起基因表达差异[26],发育潜能不同,具体机制尚未了解,还需要更多的研究与验证。
目前,国内外众多学者将目光集中到子宫内膜的研究上,对子宫内膜细胞培养主要采用组织块分离法和酶消化法。组织块分离法相对操作较为简单,成本较低,能够较为容易获得子宫内膜上皮细胞。但组织块分离法培养所需时间较长,细胞容易重叠,出现空泡状,且子宫内膜上皮细胞和成纤维细胞交织生长[27],组织块分离培养的细胞不易纯化,较难获得高纯度的子宫内膜上皮细胞[28]。酶消化法培养周期较短,但由于培养的子宫内膜组织来源不同、操作方法和温度等因素影响,酶的消化时间并不统一,难以获得稳定的子宫内膜上皮细胞。本试验曾采用胰酶消化法进行相关培养,但难以控制消化时间,造成组织块并未消化完全,待组织块消化完毕后,在培养瓶中进行培养,经常出现大量细胞漂浮,造成试验成本增加。
类器官中含有多种细胞成分,因此试验尝试通过培养的类器官分离子宫内膜上皮细胞。在类器官分离后进行细胞培养时,48 h后即可观察到组织块已经贴壁;96 h后形成以组织块为中心,周围有大量细胞向外延伸生长;第7天细胞铺满大部分瓶底,细胞与细胞间连接紧密,可以进行传代培养。细胞的传代与纯化需要采用胰酶进行消化,但消化时间有所差别。子宫内膜上皮细胞培养中的成纤维细胞多来自牛子宫内膜的基质细胞[29],容易在培养过程中造成2种细胞交织在一起。因此,在细胞培养时,根据上皮细胞与成纤维细胞对胰酶耐受性的不同,选择差时消化法进行纯化[20]。胰酶消化能力较强,大约2 min,即可在显微镜下观察到大部分成纤维细胞悬浮变圆,而子宫内膜上皮细胞消化所需时间较长,大约需要5 min才开始悬浮,因此,在3~4 min时,加入新的培养液终止消化,弃去,重新加入新的培养液培养。传代培养时待大部分细胞悬浮即可立即终止消化,一般需要5~6 min。随着传代次数的增加,胰酶对细胞的使用次数增多,细胞能够对胰酶产生耐受性,需要在显微镜下观察细胞消化悬浮状态,根据悬浮情况调节消化时间。类器官分离细胞经纯化传代后,形态明显一致,呈“铺路石”样。
通过细胞计数对获得的细胞制定生长曲线,细胞初期生长缓慢,中期快速生长,之后细胞铺满大部分瓶底,生长速度减慢,符合正常细胞的分裂特性,显示细胞生长状态良好。最后,需要对获得的细胞进行免疫细胞化学染色最终鉴定。在免疫染色中使用标记物是一种既定的方法,用于确定细胞类型。细胞角蛋白是上皮细胞中的特异性蛋白,能够作为子宫上皮细胞标志物,鉴定上皮细胞[30]。通过使用角蛋白18抗体,对子宫内膜上皮细胞和基质细胞进行区分,角蛋白18染色显绿色,DAPI进行核染显蓝色,最后对结果进行整合,只有绿色和蓝色荧光均显示为上皮细胞,否则为基质细胞,结果显示95%以上细胞为子宫内膜细胞。
4 结论
通过胎牛子宫内膜组织成功分离和培养胎牛子宫类器官,而且4月龄的胎牛子宫类器官出芽率更高。从类器官出芽组织成功分离培养子宫内膜上皮细胞,且相较于组织块分离法周期较短、易于贴壁和纯化,细胞纯度更高,在体外培养时保持着较强的增殖活力。本试验为研究病毒、细菌、营养元素以及毒物等与子宫相互作用机理提供模型基础。

