神经内镜微创与小骨窗开颅显微手术治疗高血压脑出血及其不同部位血肿的疗效
赵朝辉,阳建国,钟兴明,汪一棋,蔡勇,费振海,张磊,杨涛,顾华
高血压脑出血是50~70岁中老年人群中常见的急危重症疾病,为高血压性动脉粥样硬化导致颅内血管破裂引发[1];易发生于男性中老年人,起病急骤,预后差。临床表现常为突发剧烈的头痛,伴恶心、呕吐、意识障碍和精神症状等;由于出血部位、出血量不同,高血压脑出血患者还可出现偏身运动、感觉障碍及呼吸、循环障碍、昏迷甚至死亡;伴随出现的并发症可影响到患者的生活质量[2-3]。对高血压脑出血的治疗,临床常用外科手术,通过小骨窗开颅显微血肿清除术或立体定向血肿穿刺引流术、神经内镜微创手术等方式进行颅内减压、血肿清除,挽救急危重症患者的生命,并恢复其神经功能[4-5]。临床研究显示,通过神经内镜行微创手术对高血压脑出血患者的创伤小、并发症少,且操作简单;随着微创手术技术和理念的不断深入发展已逐渐应用于各种颅脑疾病,有良好的临床应用价值[6]。湖州市第一人民医院神经外科2018年2月—2019年2月,随机采用神经内镜微创手术或小骨窗开颅显微手术治疗96例高血压脑出血患者。本研究对神经内镜微创与小骨窗开颅显微手术治疗高血压脑出血及其不同部位血肿的临床疗效进行分析探讨。现报告如下。
1 资料与方法
1.1 一般资料 根据电脑随机方式,将96例高血压脑出血患者分为小骨窗开颅显微手术组(开颅组)和神经内镜微创手术组(内镜组),每组48例;同时根据血肿是否位于基底节区深部,将各组患者又分为深部组和表浅组亚组。(1)开颅组:男29例,女19例;年龄48~69岁,平均年龄(56.38±5.69)岁;血肿量41~70 mL,平均血肿量(60.32±7.51)mL;病程2~11 h,平均(6.92±1.31)h;格拉斯哥昏迷量表(Glasgow coma scale,GCS)评分8~13分,平均(9.54±2.68)分;其中深部组25例、表浅组23例。(2)内镜组:男30例,女18例;年龄45~67岁,平均年龄(57.67±4.57)岁;血肿量43~69 mL,平均血肿量(59.68±8.23)mL;病程1~12 h,平均(6.94±1.46)h;GCS评分8~13分,平均(9.74±3.08)分;其中深部组21例、表浅组27例。两组患者的一般资料比较,差异均无统计学意义(均P>0.05),具有可比性。纳入标准[7]:(1)病因、诱发因素和临床表现均符合高血压脑出血的临床诊断标准;(2)通过头颅CT、MRI检查及实验室检查确诊(图1);(3)GCS评分>7分;(4)中线位移<1 cm;(5)瞳孔无变化;(6)年龄40~70岁。排除标准[8]:(1)有严重躯体疾病,如肺、肝、肾等疾病;(2)非高血压引起的脑出血;(3)脑干、脑叶出血引起的继发出血;(4)妊娠或哺乳期女性;(5)精神疾病患者。本研究通过医院伦理委员会审定且通过;患者或其家属均已签署知情同意书。
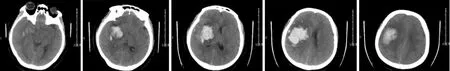
图1 内镜组患者术前头颅CT
1.2 方法
1.2.1 开颅组 开颅组患者实施显微镜下小骨窗开颅血肿清除术。通过头颅CT确定血肿最厚点和其距头皮最近点作直切口或弧形切口,长约9~15 cm;依次切开皮肤及帽状腱膜层,沿切口内侧切开和剥离骨膜。电钻颅骨钻孔,血管钳去除颅骨内板碎片,铣刀铣开颅骨,骨瓣大小约3 cm×4 cm~5 cm×6 cm,切开硬脑膜,避开脑部血管区及重要功能区。显微镜下切开皮质约1 cm,造瘘至血肿处,必要时牵开器良好暴露术野;清理血肿,双极电凝彻底止血。血肿处理后见无出血点,缝合硬脑膜,置硅胶引流管于硬膜外;放回骨瓣,缝合骨膜;依次缝合帽状腱膜、皮肤,切口再次消毒。为防止术中出现大出血,尽量避免术中操作时损伤血肿壁及侧裂血管,不强求清除附着在血肿壁上的少量血块;深部内侧型血肿更要避免盲目用电凝止血。术后进行抗脑水肿治疗,给予对症、支持和康复治疗。
1.2.2 内镜组 内镜组患者实施神经内镜微创血肿清除术。通过头颅CT定位在头皮上标记血肿体表投影范围及手术路径,尽量取与血肿长轴相对应的手术切口(图2)。避开脑部血管区及重要功能区,作4~6 cm直切口,露出颅骨;用电钻在颅骨定点位置钻一骨孔,铣刀铣开直径约2 cm左右颅骨。切开硬脑膜后,结合影像学检查,尽量设定能穿过血肿中心线的穿刺路径,以减少术中操作盲区,避免术中强行调整脑穿刺套管方向。当切口与血肿距离较远时,可先用脑穿针穿刺至血肿腔内以确定方向,采用脑穿刺套管穿刺至血肿腔内并拔除内芯,手柄固定穿刺套管,置入0°神经内镜(德国蛇牌神经内镜配合电视成像系统)。利用配套的电视和录像系统观察脑内血肿的位置、大小、范围等,在内镜直视下清除血肿;确认无出血点后,逐层依次缝合手术切口。术中避免损伤血肿附近脑组织,必要时留置引流管。患者术后送至ICU持续监护6~8 h,给予控制血压、降低颅内压、对症和基础营养支持治疗。
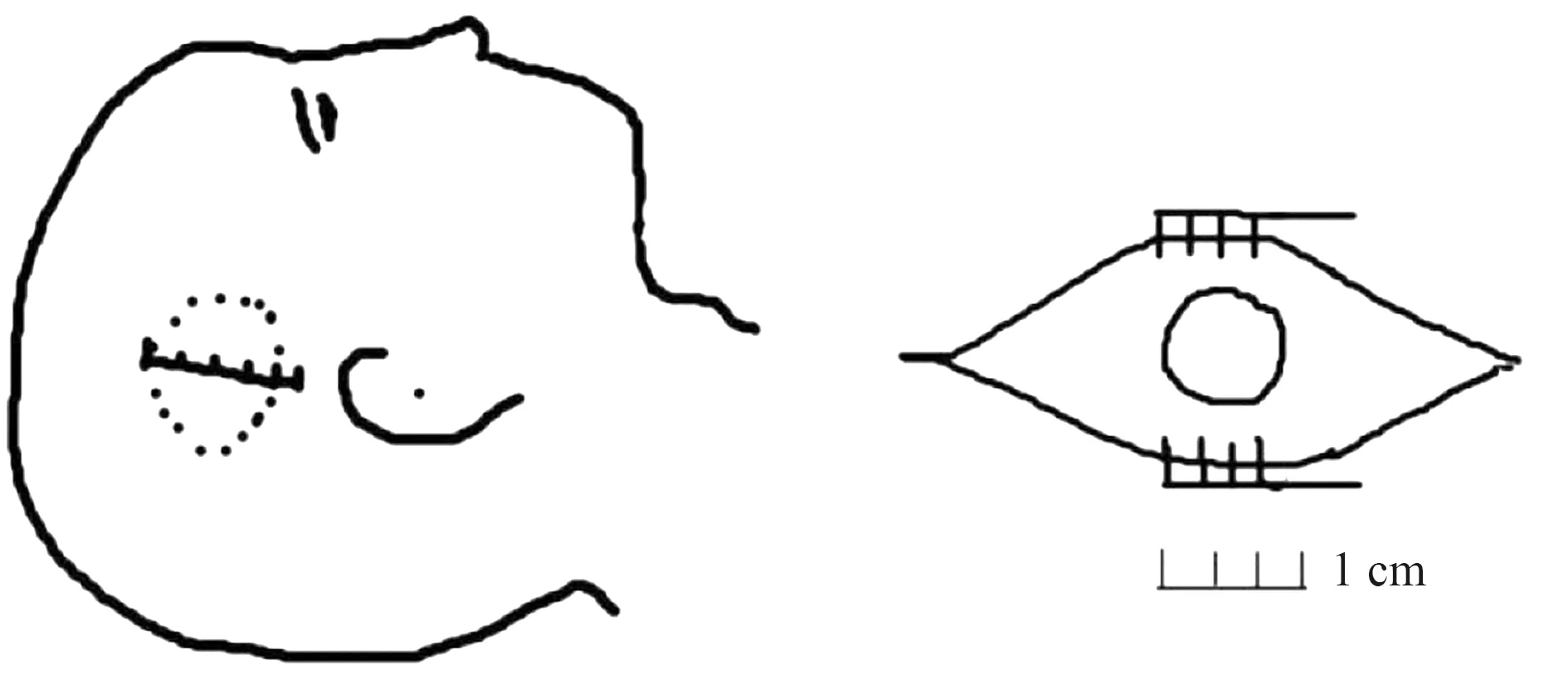
图2 内镜手术中标记血肿体表投影范围及手术切口
1.3 观察及评价标准 比较两组患者的手术相关指标,如皮肤切口长度、骨窗大小、术中出血量、手术时间、血肿清除率等;对比分析患者的治疗效果、术后并发症发生率及死亡率。患者出院后采用电话及门诊复查等方式随访。于术前、术后1、3、6个月采用日常生活能力量表(activities of daily living scale,ADL)评价患者的生活质量[10];ADL总分为100分,分数越高表示生活质量越高。所有患者在术前、术后7 d、1、3个月行美国国立卫生研究院卒中量表(National Institutes of Health Stroke Scale,NIHSS)评分。分析比较两组患者中深部血肿和表浅血肿患者的血肿清除率、生活质量、总体并发症发生率及再出血率。
1.3.1 临床疗效评价标准[9]根据血肿清除效果、脑出血症状改善情况、生命体征是否正常等进行评价,分为显效、有效、无效。(1)显效:血肿彻底清除,脑出血症状消失或明显改善,生命体征在正常范围;(2)有效:血肿有少许残留但可自性吸收,脑出血症状明显改善,生命体征保持在临界范围;(3)无效:残留大量血肿或再出血需要再次手术,脑出血症状没有明显改善,生命体征不正常(包括死亡)。总有效率=(显效例数+有效例数)/总例数×100%。
1.3.2 血肿清除率计算 血肿清除率=(术前血肿量-术后血肿量)/术前血肿量×100%。
1.3.3 NIHSS评分 用于评估最近脑卒中患者的神经功能缺损程度,共15项,总分为各项相加的总和,总分越高,患者的神经功能缺损程度越严重。分为5个等级:(1)正常或近乎正常(0~1分);(2)轻度卒中/小卒中(1~4分);(3)中度卒中(5~15分);(4)中-重度卒中(15~20分);(5)重度卒中(21~42分)。
1.3.4 术后并发症 包括肺部感染、颅内感染、颅内再出血、消化道出血、尿路感染等。
2 结 果
2.1 开颅组与内镜组手术相关指标比较 内镜组患者的皮肤切口长度、骨窗面积、术中出血量、手术时间均少于开颅组患者,血肿清除率高于开颅组患者,差异均有统计学意义(均P<0.001)。见表1、图3。

图3 内镜组患者术后头颅CT
表1 开颅组与内镜组患者手术相关指标比较
2.2 两组患者的疗效比较 内镜组患者的治疗总有效率高于开颅组,差异有统计学意义(P<0.05)。见表2。
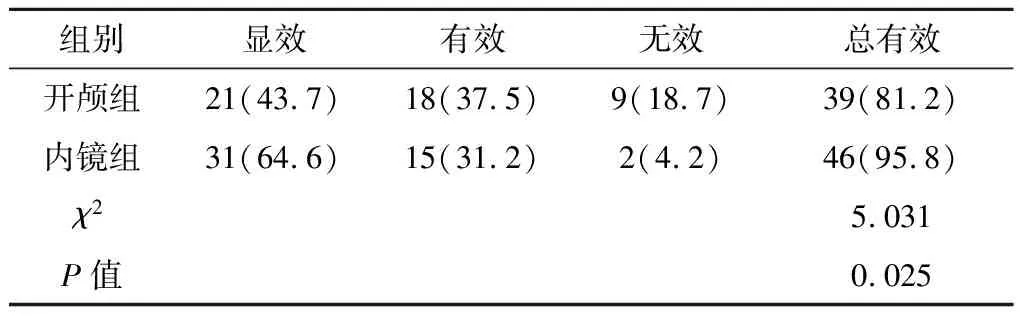
表2 两组患者的疗效比较(例,%,n=48)
2.3 两组术后并发症、死亡率比较 内镜组患者的并发症发生率低于开颅组,差异有统计学意义(P<0.001)。两组患者的死亡率比较,差异无统计学意义(P>0.05)。见表3。

表3 两组患者术后并发症发生率及死亡率比较(例,%,n=48)
2.4 两组患者的ADL、NIHSS评分比较 两组患者的术前ADL、NIHSS评分的差异均无统计学意义(均P>0.05)。内镜组患者术后1、3、6个月的ADL评分均高于开颅组,术后7 d、1个月、3个月的NIHSS评分均低于开颅组,差异有统计学意义(均P<0.001)。见表4、5。

表4 两组患者术前及术后ADL评分比较分,n=48)
2.5 两组深部组、表浅组的血肿清除率、ADL评分及并发症比较 内镜-深部组患者的血肿清除率、术后1~6个月ADL评分均高于开颅-深部组,再出血率、总体并发症发生率低于开颅-深部组(P<0.05~0.001)。内镜-表浅组患者的总体并发症发生率低于开颅-表浅组(P<0.05);而血肿清除率、术后1~6个月ADL评分及再出血率与开颅-表浅组的差异均无统计学意义(均P>0.05)。见表6。

表5 两组患者术前及术后NIHSS评分比较分,n=48)
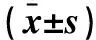
表6 两组深部组、表浅组患者的血肿清除率、ADL评分及并发症比较
3 讨 论
高血压脑出血是在情绪激动、劳累、天气转冷等诱发因素刺激下导致血压剧烈升高,使已经出现血管壁玻璃样或纤维样变性的脑血管破裂、出血,从而引发脑出血,是心脑血管系统最严重的急危重症之一;如果不能及时妥善治疗,可导致患者死亡。目前临床上常用外科手术治疗突发的高血压脑出血,能有效地控制患者病情发展,从而降低神经功能障碍程度,提高生活质量[11-13]。临床常用的手术方式包括传统开颅血肿清除术、立体定向血肿穿刺引流术、小骨窗开颅显微血肿清除术和神经内镜微创手术等。随着医学技术的发展,因传统开颅清除血肿手术对患者的创伤较大,头皮切口长、骨窗大、失血量多、感染及病死率高,在临床的应用日趋减少。其中小骨窗开颅血肿清除术因其创口小,显微手术技术成熟,在临床的应用较广泛。但仍有研究表明,小骨窗开颅血肿清除术对术者的操作经验依赖性强,手术视野不佳,深部血肿止血效果差,术后并发症仍较多,影响患者的恢复[14-15]。Vargas等[16]指出,神经导航和神经影像学的进展使临床手术中能更精确地定位和进入大脑深部病变,颅内血肿微创清除术将对脑实质的创伤降至最低,提高了血肿清除成功率。
本研究内镜组患者的皮肤切口长度为(5.94±1.03)cm,骨窗大小(11.59±3.78)cm2,血肿清除率为(93.59±11.78)%,术中出血量为(46.78±5.37)mL,手术时间为(1.31±0.66)h,治疗有效率为95.8%,均优于开颅组患者(P<0.05~0.001)。神经内镜微创手术的手术窗口更小,与小骨窗开颅显微手术相比能更有效地减少手术创伤,降低对患者的损伤,同时对血肿清除效果更好,提高了血肿清除率,显著改善脑出血症状,有利于患者术后恢复(图3)。这可能由于小骨窗开颅显微手术切口和骨窗开口较大,但手术视野相对较差,术中牵拉容易损伤病灶周围的正常组织,同时易造成继发出血[17]。此外,小骨窗开颅显微手术时间长,脑组织暴露时间长可引起脑血管和神经应激反应,引起脑血管痉挛,可能导致术后脑水肿,不利于术后神经功能恢复。神经内镜微创手术切口小、骨窗开口小,能有效减少手术对患者的创伤;手术视野清晰有助于避免损伤病灶周围正常组织、缩短手术时间,避免长时间、大面积暴露脑组织,减轻应激反应和降低脑水肿发生率。通过神经内镜观察,结合CT定位能准确找到血肿位置,有效清除血肿,清除速度更加均匀、缓慢,有利于避免再灌注损伤的风险,保护脑血管和脑神经组织[8,18-19]。
本研究显示,内镜组患者的并发症发生率为10.4%,低于开颅组患者的41.7%;术后7 d、1个月、3个月的NIHSS评分分别为(10.64±2.16)分、(7.32±1.28)分、(4.29±1.48)分,均低于开颅组;术后1、3、6个月的ADL评分分别为(51.32±5.41)分、(72.48±7.24)分、(86.17±8.95)分,均高于开颅组。结果表明神经内镜微创手术能有效降低并发症的发生率,改善患者神经功能恢复,提高患者生活质量。此可能与神经内镜微创手术对患者脑组织的损伤小有关,手术切口小、骨孔小、手术时间短可避免脑组织长时间、大面积暴露,从而减少颅内、肺部感染、颅内再出血、上消化道出血等并发症的发生,有效缓解脑出血和脑水肿引起的脑组织损害,降低死亡的风险。而且,微创手术能有效减少手术操作对机体的应激刺激,减少脑组织病理性损伤,减轻患者痛苦,缩短住ICU时间;使患者神经功能更快恢复,从而提高生活质量[20-21]。宋波等[22]研究表明,通过对高血压脑出血患者开展神经内镜微创手术治疗,可有效减少手术创伤,提高血肿清除率,改善患者神经功能,减少炎症发生的风险,有利于患者术后康复,改善生活质量,提高存活率。
此外,本研究根据患者的脑出血是否为基底节血肿,将血肿分为表浅和深部血肿,对比内镜手术是否均优于开颅手术。结果显示,内镜-深部组患者的血肿清除率、术后ADL评分高于开颅-深部组,且再出血率、总体并发症发生率低于开颅-深部组;内镜-表浅组与开颅-表浅组患者血肿清除率、术后ADL评分及再出血率的差异均无统计学意义,可能与血肿位置浅、涉及重要核团少、手术操作相对容易有关。对于深部血肿,内镜手术时需适当调整穿刺套管方向;血肿清除后,血肿空腔失去脑组织本身重力压迫,应适当增加止血材料的填塞,减少术后出血。神经内镜微创手术只要使用适当,深部血肿同样可以达到良好清除且术后再出血少,而开颅手术的总体并发症增多,考虑可能与手术创伤大有关。
综上所述,神经内镜微创手术能有效减少高血压脑出血患者的手术创伤,有效清除血肿,是一种治疗高血压脑出血的有效手段,值得在临床推广应用。

