前床突脑膜瘤的临床和影像学特征分析
陈立华,魏帆,夏勇,孙恺,陈文锦,张洪钿,徐如祥
前床突脑膜瘤(anterior clinoidal meningiomas,ACMs)指起源于前床突(anterior clinoid process,ACP)硬膜上的脑膜瘤,肿瘤沿着前床突硬脑膜延伸,累及眶上裂、视神经管等邻近的结构,压迫、推挤前循环动脉及前视觉通路;甚至包裹、侵犯ACP周围的重要神经血管结构,并可能侵犯海绵窦(cavernous sinus,CS)[1-4]。熟练掌握前床突脑膜瘤的临床和影像学特征及病理解剖知识是显微手术治疗的关键。充分的术前评估,可显著改善前床突脑膜瘤的手术切除率及预后。四川省人民医院神经外科1999年7月—2021年6月期间行手术治疗的颅内脑膜瘤患者1 084例,其中前床突脑膜瘤患者63例(占5.8%)。本研究对63例前床突脑膜瘤患者的临床资料进行回顾性分析;探讨前床突脑膜瘤的临床、影像学特征,以及手术效果与影像学分型的关系。
1 资料与方法
1.1 一般资料 本组患者中男15例,女48例;年龄26~76.5岁,平均(50.4±13.2)岁;病程2个月~7.5年,平均病程(23.5±19.3)个月;肿瘤位于左侧 27例、右侧36例。患者均有完整的临床、影像学资料,并经手术和术后病理检查证实;排除复发和继发性前床突脑膜瘤。按症状和体征出现的频率,症状和体征依次为视力下降、头痛头昏、视野缺损、视乳头水肿、呕吐、癫痫发作、复视、轻偏瘫(表1)。术前均经神经眼科的视力和视野评估检查。首发症状以视力、视野障碍者最多,为39例(61.9%);其次是不典型的头部胀痛和/或头晕21例(33.3%),癫痫发作3例(4.8%)。另外,出现记忆力减退者15例,颅高压性视乳头水肿9例(其中2例患者出现Foster-Kennedy综合征),眼球运动障碍和复视3例,精神症状2例,肢体轻瘫和语言障碍各1例。
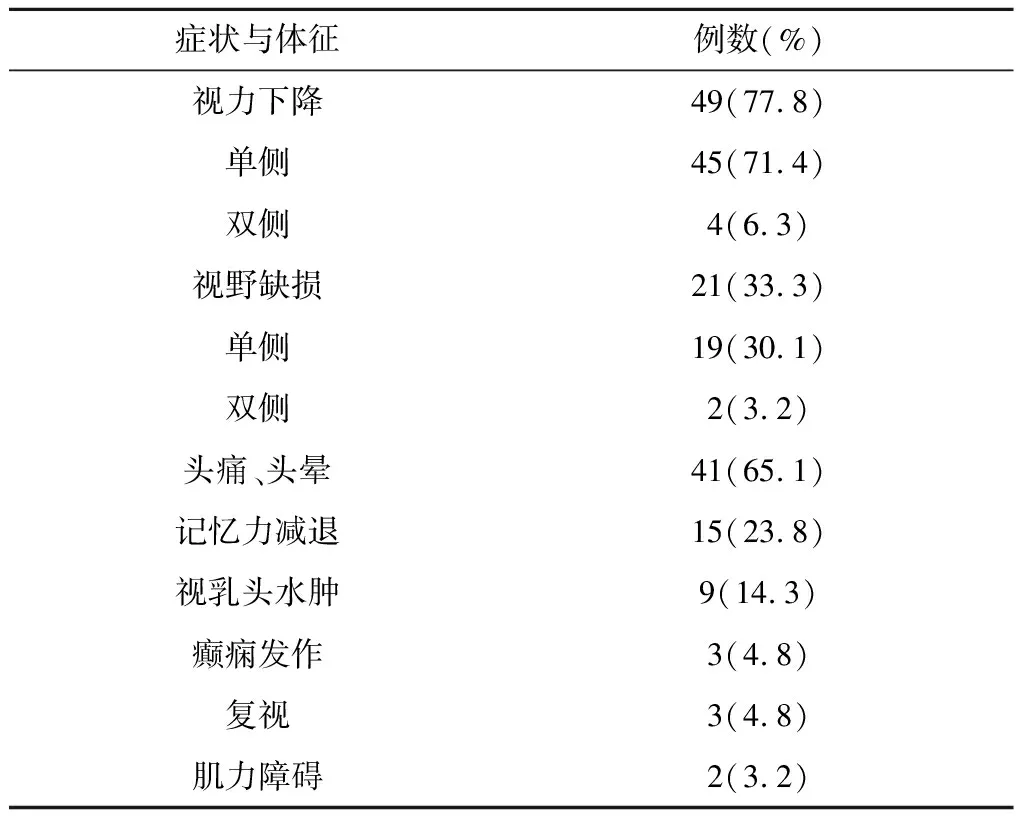
表1 本组患者的症状与体征
1.2 方法
1.2.1 影像学检查 头部 CT和CTA、 MRI和MRA、DSA 可从不同角度观察了解肿瘤的特点及其与周围神经血管结构的关系,肿瘤的位置、大小、质地、血供强化特征、累及范围和侵袭方向,颈内动脉(internal carotid artery,ICA)及大脑中动脉(middle cerebral artery,MCA)和大脑前动脉(anterior cerebral arter,ACA)是否被包绕,以及是否侵犯海绵窦、眼眶或视神经管,肿瘤与神经的关系分级等。53例患者术前行CT检查,其中31例患者的前床突有反应性增生变厚(图1A)。63例患者均行头颅MRI平扫+增强扫描检查,肿瘤均有不同程度的增强,轴位或冠状位扫描显示肿瘤基底部位于前床突不同区域(图1B-E)。根据T2WI和FLAIR信号强度评价脑膜瘤质地、瘤周水肿;根据水肿厚度将患者分为无或轻度水肿组(水肿厚度<5 mm)与中~重度水肿组(水肿厚度≥5 mm)。肿瘤最大直径为1.5~7.4 cm,平均(4.2±1.8)cm;位于前床突右侧37例、左侧26例。行头颅CTA检查27例,MRA检查31例,观察评估肿瘤主要动脉的通畅性或狭窄程度;其中显示肿瘤包绕床突上段ICA及MCA者24例,肿瘤推挤ICA及MCA者11例。术前接受DSA检查21例,DSA 可显示肿瘤的主要血管供应,以评估对侧血流和侧支循环,包括ICA、MCA、大脑前动脉的位置变化及其通畅性。
1.2.2 影像学分型 根据肿瘤最大直径将前床突脑膜瘤分为4型:小型(<2.0 cm)、中型(2.0~4.0 cm)、大型(4.1~6.0 cm)和巨大型(>6.0 cm)。在Al-Mefty分类基础上[1],结合肿瘤是否侵袭毗邻区域和海绵窦,将前床突脑膜瘤分为4型。51例患者术前影像学检查可以确定肿瘤基底部位于前床突的具体起源部位,按Al-Mefty分类标准归为Ⅰ-Ⅲ型;12例患者的肿瘤包绕前床突和毗邻区域的神经、血管,或侵袭海绵窦区域,术前影像学检查不能确定肿瘤的确切起源部位,或基底部来源于前床突的哪个区域,但术中证实肿瘤基底位于前床突,归为Ⅳ型。
1.2.3 肿瘤与前循环动脉的关系分级 根据肿瘤与前循环动脉的关系,将其分为4级:0级,肿瘤未累及血管;Ⅰ级,肿瘤压迫动脉,使之发生移位,肿瘤与动脉之间存在完整的蛛网膜界面;Ⅱ级,肿瘤包绕、包裹动脉而无狭窄,与动脉之间存在完整的蛛网膜界面;Ⅲ级,肿瘤包裹、侵犯动脉外膜使之发生狭窄,肿瘤与动脉之间缺乏蛛网膜界面。
1.2.4 手术方法 根据术前影像学检查结果选择手术入路和手术方式。采用额颞部开颅,术中骨瓣平前、中颅窝底,并磨平蝶骨嵴、部分眶后和外侧壁;根据具体情况决定是否磨除前床突、打开视神经管和松解视神经鞘。充分显露侧裂,释放脑脊液并充分显露肿瘤,先处理肿瘤与前床突硬膜的基底,根据肿瘤的位置、大小及生长方式,判断其与视神经、动眼神经、颈内动脉及其分支的位置关系,从而保护重要结构。然后,沿蛛网膜间隙分离肿瘤与周围重要神经、血管的边界,分块切除肿瘤。早期视路和前循环血管的可视化,精确掌握肿瘤切除的“度”。
2 结 果
2.1 视觉功能 由于前床突脑膜瘤靠近视神经而最常表现为进行性视力损害,通常发生在同侧眼。本组患者中49例患者术前有不同程度视力障碍(77.8%),其中单侧视力下降45例(71.4%)、双侧视力下降4例(6.3%);视野缺损21例(33.3%),其中单侧视野缺损19例(30.2%),双侧视野缺损2例(3.2%)(表1)。视神经管侵袭与术前视力缺损有明显关系,22例视神经管受累的患者术前均有视力功能障碍。视乳头水肿患者9例,其中2例患者表现为Foster-Kennedy综合征。无视野改变的患者中视力下降者28例,占视力下降患者的57.1%;有视野缺损的21例患者均有视力下降。
2.2 影像学特征 本组患者中,前床突脑膜瘤Al-Mefty分类最多见的类型是Ⅱ型(39例,61.9%),其次是Ⅳ型(12例,19.1%)。前床突脑膜瘤包绕ICA或/和MCA、ACA复合体的患者为39例( 61.9%),侵袭前循环血管的患者为7例(11.1%)。出现骨质增生的患者 31例(49.2%),肿瘤钙化12例(19.0%)。17例患者术前影像学检查示视神经管受累;术前影像学检查视神经管未受累的5例患者,术中探查视神经管时发现视神经管内有明确的肿瘤侵袭。根据术前影像学检查和术中所见,共发现22例患者(34.9%)的肿瘤侵入视神经管内,术中共 19例患者(30.2%)需打开视神经管。肿瘤累及海绵窦的患者只有9例(14.3%)。见表2。
2.3 肿瘤切除程度与影像学特征的关系 肿瘤的类型、肿瘤与前循环的关系、是否累及海绵窦与肿瘤切除程度有密切关系,而肿瘤大小、是否有钙化、肿瘤是否侵入视神经管和前床突的骨质增生与肿瘤切除程度无明显关系。本组患者中,51例患者(81%)术前可明确肿瘤基底来源于ACP,另有12例Ⅳ型前床突脑膜瘤患者均是术中确定肿瘤基底。39例Ⅱ型肿瘤患者中37例患者(94.9%)获得肿瘤全切除;5例Ⅲ型肿瘤患者中4例患者(80%)获得全切除;7例Ⅰ型肿瘤患者中仅1例患者(14.3)得到全切除;12例Ⅳ型肿瘤患者中全切除与部分切除者各6例(50%),其切除程度取决于肿瘤与前循环血管的关系,即肿瘤与血管的分级。见表2。
3 讨 论
3.1 前床突脑膜瘤的定义和相关解剖分区
3.1.1 前床突脑膜瘤的定义 ACP位于一个狭窄的关键位置,数毫米起源的前床突脑膜瘤只有个体解剖学的微小差异,尽管前床突脑膜瘤起源点的变化很小,但却导致临床表现的显著差异。根本原因是肿瘤与蛛网膜层的关系,存在蛛网膜层时,促进了血管的安全性;反之,肿瘤通常紧紧地附着在周围神经、血管结构的外膜和神经束膜上。Al-Mefty首先详细描述了前床突脑膜瘤,并将其分为3型[1]。目前,尽管前床突脑膜瘤的定义还存在争议,但一致的意见是肿瘤起源于覆盖前床突上、外、下方硬脑膜的脑膜瘤,基底的正中位于前床突上,肿瘤通常向上生长,形成一个小的基底,朝向鞍上区和外侧裂,并影响邻近的蝶骨嵴、蝶骨平台、鞍膈、眶上裂和CS的脑膜瘤[2]。中小型前床突脑膜瘤可清楚地看到ACP起源,巨大型和少数大型前床突脑膜瘤很难确定肿瘤是起源于ACP的哪个区域,甚至无法区别是起源ACP,还是从邻近的结构延伸到ACP;此类肿瘤需要结合术中情况才能判定。
3.1.2 ACP的解剖分区 ACP是蝶骨小翼末端的骨质突起,位于外侧眶上裂和内侧视神经管之间,呈不规则三棱形,其后下方为CS的前内侧三角,其前内侧为视神经管。起源于覆盖ACP硬脑膜的前床突脑膜瘤,沿硬脑膜的脑膜层向多个方向生长,侵袭周围多处重要的神经血管结构,增加了肿瘤全切除的难度和手术风险,尤其在毗邻的重要结构被肿瘤推挤、移位、包绕甚至侵袭时。Xu等[3]解剖研究ACP的脑膜结构显示,ACP的上表面、外侧表面、内侧表面和尖端被不同类型的脑膜覆盖,并将ACP周围脑膜的精细结构分为4个区域。(1)Ⅰ区:即ACP的上表面,为完整的骨膜层+脑膜层结构,被蛛网膜和脑膜和骨膜的脑膜层覆盖;(2)Ⅱ区:前床突的外侧表面,为多层致密的脑膜层结构,无骨膜层;(3)Ⅲ区:前床突尖部后方的三角形,亦为多层脑膜层结构;(4)Ⅳ区:前床突的内表面。硬膜远环上方,Ⅳ区的上部也被脑膜和骨膜脑膜层覆盖,而Ⅳ区的下表面仅被骨膜硬脑层覆盖。然而,这一分区中Ⅲ区与其他区有重叠。本研究认为将其分为上区(上表面)、外侧区、内侧区和下面4个区更为合理,但还有待临床研究验证。ACP不同区域的硬脑膜解剖并不一致,不同区域的硬脑膜解剖决定了肿瘤不同的延展方向。因此,ACP周围脑膜结构分区有助于理解前床突脑膜瘤的发生和发展。
3.2 临床特征
3.2.1 发病率 前床突脑膜瘤约占颅内脑膜瘤的5%[1],占幕上脑膜瘤<10%,占蝶骨脑膜瘤的34%~43.9%[4]。发生率仅次于矢状窦旁脑膜瘤和大脑凸面脑膜瘤。Xu等[3]报道131例前床突脑膜瘤,占颅内脑膜瘤的4.94%(131/2 654例)。本组前床突脑膜瘤患者占同期收治的颅内脑膜瘤患者的5.8%。
3.2.2 首发症状和主要临床表现 前床突脑膜瘤具有独特的病理解剖特征,不同类型的前床突脑膜瘤可能有不同的临床表现。最常见和最早的症状为单眼进行性视力下降,且病程较长,可能与脑膜瘤的良性进展有关。有研究报道高达86%~92%的前床突脑膜瘤患者以视力障碍为首发症状[4-5]。本组患者中以视力、视野障碍为首发症状者占61.9%,不典型头部胀痛和/或头晕者占33.3%,癫痫发作者占4.8%。除了视觉功能障碍外,其他主要症状还有不典型头痛和头晕(41例,65.1%)和记忆力减退(15例,23.8%)等。Bassiouni等[6]报道106例前床突脑膜瘤,主要症状为视力损害者占54%,视力下降占49%,视野缺损占26%。对前床突脑膜瘤独特的解剖结构和临床表现的了解,可对前床突脑膜瘤手术的认识有了重大的提高。
3.2.3 视觉障碍 前床突脑膜瘤最突出的症状是早期视力恶化,通常表现为单侧视力下降和单侧视野缺损。Sade等[7]报道52例前床突脑膜瘤患者,其中22例患者术前有视野缺损,术后17例患者(77%)视力得到改善。Wong等[8]报道29例前床突脑膜瘤患者,21例患者(72.4%)有视力缺损。Attia等[9]报道22例巨大型前床突脑膜瘤(≥5 cm),术前有视力损害者为19例(占86.4%)。Nanda等[10]报道89%的患者有视觉功能障碍。在视力严重下降前,其他症状大多会被忽视。张旭等[11]报道145例前床突脑膜瘤患者,术前视力下降者62例(占42.8%)。本组患者中术前表现为视力障碍者占77.8%,主要表现为单侧视力下降(71.4%),出现双侧视力下降者少见(6.3%);表现为视野缺损者占33.3%,其中单侧视野缺损(30.1%)19例,双侧视野缺损者很少见(3.2%)。本研究将前床突脑膜瘤分为4个亚组,Ⅲ型和Ⅰ型视神经最容易受到压迫,视觉症状在早期和大多数情况下出现。Ⅲ型脑膜瘤起源于视神经管入口附近,早期侵袭视神经管并侵犯视神经,早期出现视觉症状。视神经损伤的机制可能由缺血、机械压迫和/或脱髓鞘引起。直接压迫是导致视觉问题的最重要因素,如果减压在缺血半暗带时间内完成,视觉障碍是可逆的。
3.3 影像学特征 术前准确的影像评估有助于手术方式的选择、预估手术风险和预判预后。术前大多数前床突脑膜瘤可明确其起源和类型,最准确的判断应根据术中对肿瘤基底位置的判断。但术前影像学检查很难确定肿瘤是否侵袭血管外膜,术前血管造影显示血管狭窄不一定意味着有浸润,仍有可能从血管壁上分离与切除肿瘤。Salunke等[12]对21例前床突脑膜瘤进行ICA及其分支的供血、移位、包埋/狭窄等检查,术前影像学检查示血管包埋与术中发现的血管受累不符,尽管术前血管造影显示肿瘤完全包裹/狭窄,但只有局部肿瘤浸润血管壁,术中发现11例患者的ICA仅在分叉处被完全包裹。
前床突脑膜瘤的生长特点是以ACP为中心,倾向于向鞍上和外侧裂方向球形生长,有一个位于ACP较小的基底,同时引起前床突骨质增生[13]。随着肿瘤体积的增大,前床突脑膜瘤往往侵犯周围的神经血管结构,包括颈动脉远端分支、海绵窦,导致手术效果不佳[13]。冠状位CT上近一半的前床突脑膜瘤伴有ACP骨质增生。本组患者中伴有ACP增生者占49.2%。
根据肿瘤的分型可以预知肿瘤与血管的关系,因为不同解剖起源的脑膜瘤表现出不同的行为。起源于ACP下表面的脑膜瘤位于“床状间隙”,包含ICA的床状段(C5),ICA没有被蛛网膜层包围。因此Ⅰ型前床突脑膜瘤在起源的早期就包裹ICA,并直接附着在ICA的外膜上,其间无蛛网膜分隔,手术切除非常困难。幸运的是这一型在本组患者中仅占11.1%。Ⅱ型前床突脑膜瘤发生在ACP的上表面,相对局限的肿瘤基底,在脑膜瘤增大的后期仅侵犯周围的神经血管结构,包绕ICA和分支,但多数存在蛛网膜相隔,手术切除的难度远小于Ⅰ型前床突脑膜瘤,基本上能做到全切除。本组39例Ⅱ型患者中,获得肿瘤全切除者37例(94.9%)。Ⅲ型前床突脑膜瘤起源于视神经管入口附近,肿瘤深入视神经管内,延伸至前床突尖端,与ICA之间也有蛛网膜相隔,多数可获得全切除。Ⅳ型前床突脑膜瘤体积往往巨大,引起明显的占位效应,侵袭海绵窦和动脉的风险大,肿瘤与血管之间往往不存在蛛网膜界面,并对MCA和ACA往往造成包绕移位,能否全切除取决于肿瘤与血管的关系。因此,前床突脑膜瘤的全切除应采取积极谨慎的态度,依据不同类型的肿瘤特点制定详细的手术计划[14]。
前床突脑膜瘤无论大小都有向视神经管延伸的趋势,平均21%的前床突脑膜瘤存在视神经管延长。Pamir等报道,前床突脑膜瘤侵入视神经管的发生率为7%~36%[13]。Nanda等[10]报道,前床突脑膜瘤患者中侵犯视神经管者占36%。Sade等[7]报道52例前床突脑膜瘤患者,其中19例患者(36.%)肿瘤侵入视神经管,并且视神经管侵入与术前视力有较好的相关性;术前视力缺损者24例(46%),其中14例患者(58%)出现了OCI;而28例术前无视力障碍患者中,术中累及OCI者只有5例(18%)(P=0.004)。Attia等[9]报道22例巨大前床突脑膜瘤(≥5 cm),其中侵犯视神经管者占77.3%(17例)。Giammattei等[15]对前床突脑膜瘤文献进行了系统回顾和荟萃分析,共有1 208例患者纳入分析,发现侵犯神经管的发生率为20.9%。直接压迫是引起视觉障碍的最重要因素,术前视力障碍反映了肿瘤与视神经的密切关系。尽管视觉障碍症状的发生率相对较高,但视神经管受累在前床突脑膜瘤中相对少见。本组前床突脑膜瘤患者中,尽管有77.8%的患者术前出现视觉功能障碍,但其中只有34.9%的患者肿瘤累及视神经管。
前床突脑膜瘤与ICA及其分支、视神经和CS之间的关系,是决定能否肿瘤全切除的前提。前床突脑膜瘤常压迫、推移甚至包绕或包裹ICA分叉及其分支,使其成为最危险的切除区域[12]。侵袭ICA、视神经或ICA远端分支也增加了肿瘤残留和致残的风险[13]。Salunke等[12]研究报道,21例前床突脑膜瘤患者中发现11例患者的颈内动脉在分叉处被完全包裹,但影像学示血管包裹与术中发现的血管壁粘连不一致,真正浸润颈内动脉分叉处外膜的患者只有6例;多数肿瘤可沿狭窄血管的长度分离。肿瘤与血管之间是否压迫或包绕不影响术中安全解剖出血管结构,肿瘤与血管之间是否存在蛛网膜间隙、是否侵袭血管外膜是决定血管能否安全分离的重要先决条件。因此,本研究将前床突脑膜瘤与血管的关系分为0-Ⅲ级:0级和Ⅰ级,肿瘤与ICA及视神经之间有一层蛛网膜相隔,可以找到明确有分离界面做到肿瘤全切除;Ⅱ级,肿瘤包裹ICA并使ICA及分支环形缩窄,能否全切除取决于肿瘤与海绵窦和视神经管的关系;Ⅲ级,肿瘤无法全切除(表2)。这一分级有助于预测血管能否安全解剖分离。
尽管前床突脑膜瘤往往不同程度地压迫海绵窦侧壁,但很少侵袭海绵窦,真正侵犯海绵窦的不多见[13]。本组患者中肿瘤侵袭海绵窦者仅有9例(14.3%)。Mariniello等[16]报道无海绵窦侵袭率。Xu等[3]研究显示,前床突脑膜瘤患者的海绵窦受累率为17.6%。Nanda等[10]研究报道肿瘤累及海绵窦者占38.9%。Liu等[17]报道47%的患者CS受累。巨大前床突脑膜瘤累及海绵窦的发生率更高。Attia等[9]研究报道,22例巨大前床突脑膜瘤(≥5 cm)患者中海绵窦受累者为13例(占59.1%)。随着肿瘤体积的增大,肿瘤向后方生长可以累及海绵窦上、外侧壁,甚至穿过窦壁进入窦腔;肿瘤与海绵窦的关系是影响前床突脑膜瘤全切除的重要因素[18]。
总之,前床突脑膜瘤靠近重要的神经血管结构,如ICA及其主要分支、视神经和运动神经,并延伸至海绵窦和视神经管。前床突脑膜瘤中OCI的发生率很高,提高患者的视力是治疗前床突脑膜瘤的主要目标[19]。因此,术前充分评估肿瘤的临床和影像学特征,制定个体化的手术方式,可改善患者的远期预后。由于前床状脑膜瘤与重要神经血管结构的关系密切,因此其完全和安全切除仍然是一个挑战[20]。

