冬凌草甲素通过抑制STAT-3/SYNPO-2信号通路诱导人恶性胶质瘤U87MG细胞凋亡*
陈 爽, 王 宸, 马晓娇, 邱红梅
(重庆医科大学药理学教研室,重庆市生物化学与分子药理学重点实验室,药物代谢研究重庆市重点实验室,重庆 400016)
胶质瘤(glioma)是一种起源于神经外胚层部位的脑肿瘤,属于人类恶性程度最高的肿瘤之一,具有生长迅速、与正常脑组织无明显界限、并向周围组织浸润的特点,复发率和死亡率极高[1]。目前胶质瘤的治疗方法主要有手术切除,术后辅以放疗和化疗,但因其浸润性生长手术难以根除,且常规化疗药物通常伴随严重毒副作用,导致患者预后极差,中位生存期仅有一年左右,临床上尚无确切有效的治疗手段[2]。传统中医药是我国的医药文化瑰宝,尤其近年来随着紫杉醇[3]和人参皂苷[4]等天然抗肿瘤单体药物的发现,使中药单体的抗癌作用逐渐被广泛重视并成为研究热点。
冬凌草甲素(oridonin,ORI)是从冬凌草中分离出来的一种贝壳杉烷型四环二萜类化合物,具有很好的抗炎、抗菌、抗感染和清除活性氧自由基等功效。此外,ORI 对多种肿瘤细胞株也具有较好的抗癌活性,可促进胰腺癌细胞凋亡并抑制其增殖迁移[5],增强人结直肠癌细胞对氟尿嘧啶的敏感性并促进其凋亡[6],诱导神经胶质瘤细胞发生周期阻滞和凋亡[7],然而有关ORI对神经胶质瘤作用研究较少且其机制尚不十分明确。信号转导及转录激活因子3(signal transducer and activator of transcription-3,STAT-3)作为Janus 激酶(Janus kinase,JAK)/STAT-3信号通路中的关键因子之一,研究证实它的过度激活与胶质瘤的生长侵袭密切相关,下调STAT-3 可抑制胶质瘤细胞的增殖和迁移,并诱导凋亡[8]。突触足蛋白2(synaptopodin-2,SYNPO-2)是一种已知的抑癌因子,可参与细胞骨架及肌动蛋白束的形成,在体内外均可抑制肿瘤的生长。Abkhezr 等[9]报道,使用小分子抑制剂Stattic 或siRNA 抑制STAT-3 表达可直接导致synaptopodin 的mRNA 和蛋白表达改变。而ORI 的抗胶质瘤作用是否与它对STAT-3/SYNPO-2信号通路的调控有关,目前未见报道。
本项工作以人源恶性胶质瘤细胞株U87MG 为研究对象,探讨ORI 对胶质瘤细胞的作用,并采用STAT-3磷酸化激动剂白细胞介素6(interleukin-6,IL-6)和抑制剂Stattic 探究其可能机制是否涉及STAT-3/SYNPO-2通路。
材 料 和 方 法
1 材料
人恶性胶质瘤细胞株U87MG 购自American Type Culture Collection(ATCC);ORI 购自TargetMol,批号T3001-1,纯度99.7%;BCA 蛋白定量试剂盒和二甲基亚砜(dimethyl sulfoxide,DMSO)均购自北京鼎国昌盛生物技术有限公司;胰酶、胎牛血清(fetal bovine serum,FBS)和DMEM高糖培养液均购自重庆塞米克生物有限公司;Cell Counting Kit-8(CCK-8)购自上海Bimake;超敏显影液和细胞凋亡试剂盒均购自碧云天生物有限公司;α-tublin、STAT-3、SYNPO-2和Bax 抗体均购自Proteintech;p-STAT-3(Tyr705)抗体购自Affinity;Bcl-2 抗体购于GeneTex;STAT-3 磷酸化抑制剂Stattic 购自MedChemExpress;IL-6 购自武汉三鹰生物有限公司。
2 方法
2.1 细胞培养 将人源神经胶质瘤U87MG 细胞株置于孵箱,用添加含10% FBS 的DMEM 培养液进行培养,孵育条件:恒温37 ℃,5%CO2。全部实验均取对数生长期的细胞进行操作。
2.2 ORI干预 将ORI干粉(纯度为99.7%)溶解于DMSO 配制成0.01 mol/L 终浓度,用0.22 μm 微孔滤膜过滤除菌,避光存于-20 ℃,使用时用完全培养液梯度稀释成所需浓度。根据文献[10]及前期的浓度筛选,实验组分别加入2.5、5、7.5、10和12.5 μmol/L的ORI,对照组加入与最高浓度组相同体积的DMSO,空白组加入等体积完全培养液。
2.3 CCK-8 法检测细胞活力 取对数生长期U87MG 细胞接种于96 孔板中(每孔5×103个),每孔100 μL细胞悬液,移入孵箱过夜培养。吸弃旧液,换用不同浓度(2.5、5、7.5、10 和12.5 μmol/L)的ORI继续处理,每组6 个复孔,作用24 h 和48 h 后,弃旧培养液,每孔加入含10%CCK-8的培养液100 μL(避光操作),继续孵育2~3 h 后,用酶标仪测定450 nm处各孔的吸光度(A)。药物对U87MG 细胞活力的抑制率(%)=[1-(实验给药组A值-空白组A值)/(阴性对照组A值-空白组A值)]×100%。
2.4 划痕实验检测细胞迁移 取对数生长期的U87MG 细胞接种于6 孔板,观察融合至80%~90%时,将移液枪头垂直于孔板进行平稳竖直划线,弃旧培养液,用PBS 轻洗2 次。空白组加入无血清培养液,实验组加入无血清培养液配制的不同浓度(0、5、7.5 和10 μmol/L)ORI,置于孵箱培养。在显微镜下观察大约同一位置,不同时点(0 h、12 h、24 h、36 h和48 h)的划痕愈合状态,并拍摄图像,使用ImageJ 软件计算细胞迁移率。细胞迁移率(%)=(刚划痕时划痕面积-培养不同时间点时划痕面积)/刚划痕时划痕面积×100%。
2.5 流式细胞术检测细胞凋亡 取对数生长期的U87MG 细胞接种于6 孔板(每孔5×105个),置于孵箱过夜培养,弃旧培养液,用不同浓度(0、5、7.5 和10 μmol/L)的ORI 处理U87MG 细胞48 h 后收集各组细胞,PBS 洗涤2 次后,12 000×g离心5 min,离心2 次,弃上清,先后加入annexin V-FITC和碘化丙啶染色液进行室温避光染色(染色步骤按试剂盒说明书操作),20 min 后冰浴终止染色,于40 min 内进行流式上机测定细胞凋亡率。
2.6 Western blot 检测蛋白表达 取对数生长期的U87MG 细胞接种于10 cm 培养皿中,观察长至60%左右时,分别用不同浓度ORI处理48 h后收集各组细胞,加入细胞裂解液提取总蛋白,并用BCA蛋白定量检测样品浓度(按说明书步骤操作),加上样缓冲液煮沸变性存于-80 ℃。SDS-PAGE分离,冰浴转膜,再按照常规方法,5%BSA 室温封闭2 h 后,依次加入Ⅰ抗4 ℃孵育过夜、Ⅱ抗室温孵育2 h,TBST洗膜3次后,加入ECL 发光液在凝胶成像仪上显影成像,用Image Lab 4.1软件分析条带灰度值。以目的蛋白与α-tublin条带灰度值之比表示相应蛋白的相对表达水平。
3 统计学处理
实验结果以均数±标准差(mean±SD)表示,采用SPSS 20.0 软件进行单因素方差分析,组间比较采用LSD-t检验。使用GraphPad Prism 8.0 软件作图。以P<0.05为差异有统计学意义。
结果
1 ORI对U87MG细胞活力的影响
用不同浓度的ORI(结构见图1A)干预U87MG细胞24 和48 h,结果显示,与对照组比较,各组细胞的活力均受到显著抑制,且抑制率呈浓度和时间依赖性增高(P<0.01),相应的细胞形态亦发生变化,见图1B、C。采用SPSS 20.0 软件进行分析得出ORI 作用24 和48 h 的IC50均介于5~10 μmol/L,且作用48 h的效果更加显著,因此后续实验选用5、7.5 和10 μmol/L 作用48 h 作为给药组,以加入最高浓度相同体积DMSO处理的U87MG细胞作为对照组。

Figure 1. The effect of oridonin(ORI)on the viability of U87MG cells. A:the chemical structure of ORI;B:the effect of ORI at different concentrations for 24 and 48 h on the viability of U87MG cells was detected by CCK-8 assay;C:as the concentration of ORI increased,the number of U87MG cells gradually decreased,and the cells become round and shiny,dying and floating in the culture medium(scale bar=100 μm). Mean±SD.n=5.*P<0.05,**P<0.01vs control group.图1 冬凌草甲素对U87MG细胞活力的影响
2 ORI对U87MG细胞迁移能力的影响
迁移实验结果显示,与对照组比较,5、7.5 和10 μmol/L 的ORI 可显著抑制U87MG 细胞的迁移,且药物浓度越高,作用时间越长,细胞迁移速率降低越显著(P<0.01),见图2。其中7.5 和10 μmol/L 的ORI对应的抑制效果更为显著。

Figure 2. The effect of oridonin(ORI)on the migration of U87MG cells. The migration of U87MG cells treated with different concentrations of ORI for different time was measured by scratch test(scale bar=100 μm). Mean±SD.n=5.**P<0.01vs 0 μmol/L group.图2 冬凌草甲素对U87MG细胞迁移的影响
3 ORI对U87MG细胞凋亡率的影响
流式细胞术结果显示,与对照组比较,5、7.5 和10 μmol/L 的ORI 组细胞凋亡率均显著增高(P<0.01),见图3。因此选用中间浓度7.5 μmol/L 作为后续ORI组。
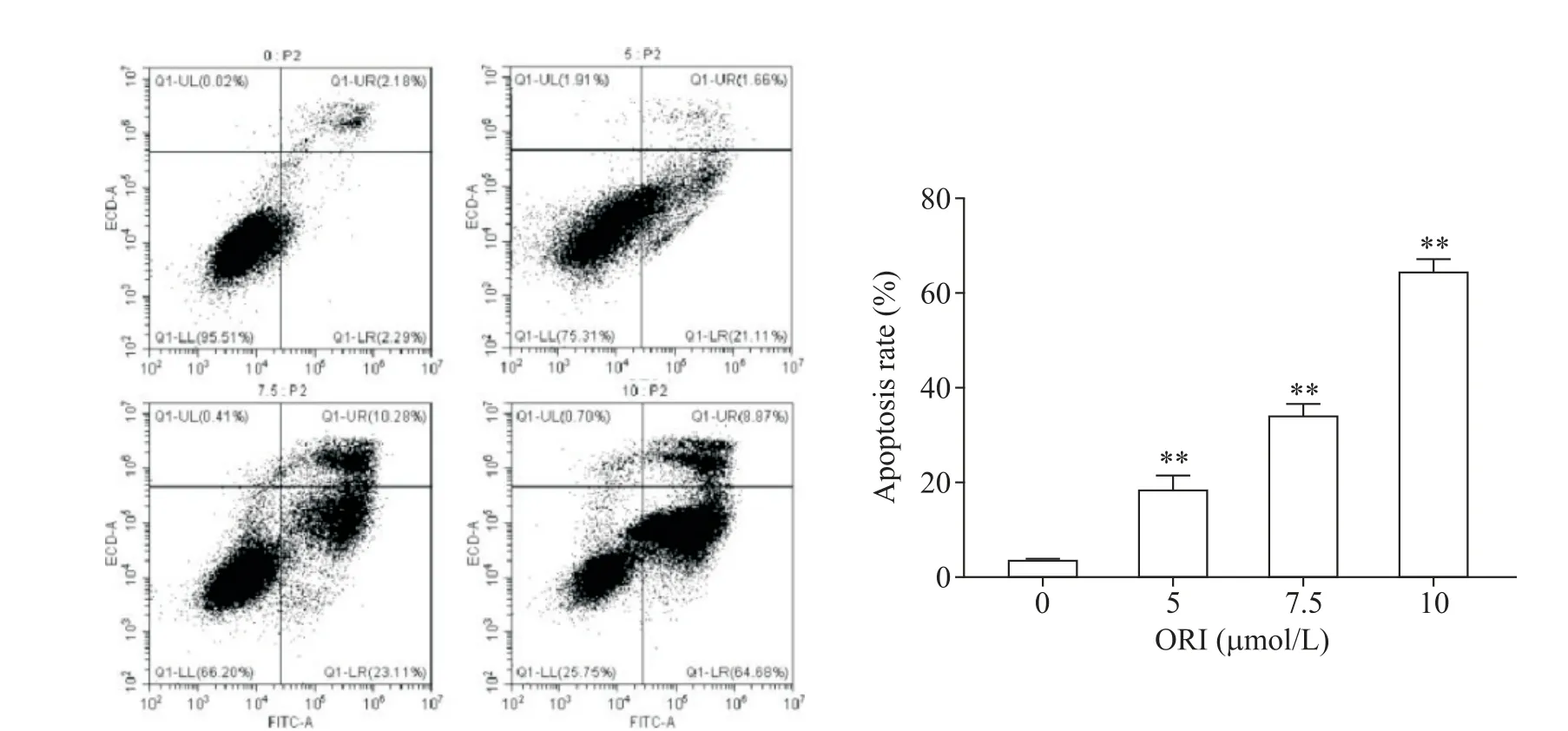
Figure 3. The effect of oridonin(ORI)on the apoptosis of U87MG cells. Mean±SD.n=3.**P<0.01vs 0 μmol/L group.图3 冬凌草甲素对U87MG细胞凋亡的影响
4 ORI对U87MG细胞Bcl-2和Bax蛋白表达的影响
与对照组比较,ORI(7.5 μmol/L)组Bcl-2 蛋白表达降低,Bax蛋白表达增高(P<0.01),而STAT-3磷酸化激动剂IL-6(20 μg/L)组Bcl-2 蛋白表达增高,Bax 蛋白表达降低(P<0.01);与ORI组比较,合用IL-6 后,Bcl-2 蛋白表达显著增高,Bax 蛋白表达显著降低(P<0.01),提示ORI 对U87MG 细胞的促凋亡作用被IL-6 逆转;而加入STAT3 磷酸化拮抗剂Stattic(3 μmol/L)的作用与前面相反,它可以协同增强ORI 的促凋亡效应(P<0.01),见图4。

Figure 4. The effect of oridonin(ORI)on the protein expression of Bcl-2 and Bax in U87MG cells. A:the protein expression of Bcl-2 and Bax in U87MG cells treated with IL-6(20 μg/L)or/and ORI(7.5 μmol/L)for 48 h;B:the protein expression of Bcl-2 and Bax in U87MG cells treated with Stattic(3 μmol/L)or/and ORI(7.5 μmol/L)for 48 h. Mean±SD.n=3.**P<0.01vs control group;##P<0.01vs ORI group.图4 冬凌草甲素对U87MG细胞Bcl-2和Bax蛋白表达的影响
5 ORI 对U87MG 细胞STAT-3/SYNPO-2 通路的影响
与对照组比较,ORI(7.5 μmol/L)组p-STAT-3 蛋白水平显著降低,SYNPO-2 蛋白表达显著增高,STAT-3 蛋白含量无显著变化,即STAT-3/SYNPO-2通路被抑制(P<0.01),而IL-6(20 μg/L)组STAT-3/SYNPO-2 通路被激活(P<0.01);合用IL-6 后,与ORI组比较,STAT-3 磷酸化水平显著升高,SYNPO-2 蛋白表达显著降低,STAT-3蛋白含量基本不变,ORI对STAT-3/SYNPO-2 通路的抑制作用被IL-6 逆转(P<0.01);另一方面,给予STAT-3 磷酸化抑制剂Stattic(3 μmol/L)则可协同ORI 的作用,二者共同抑制STAT-3/SYNPO-2通路(P<0.01),见图5。
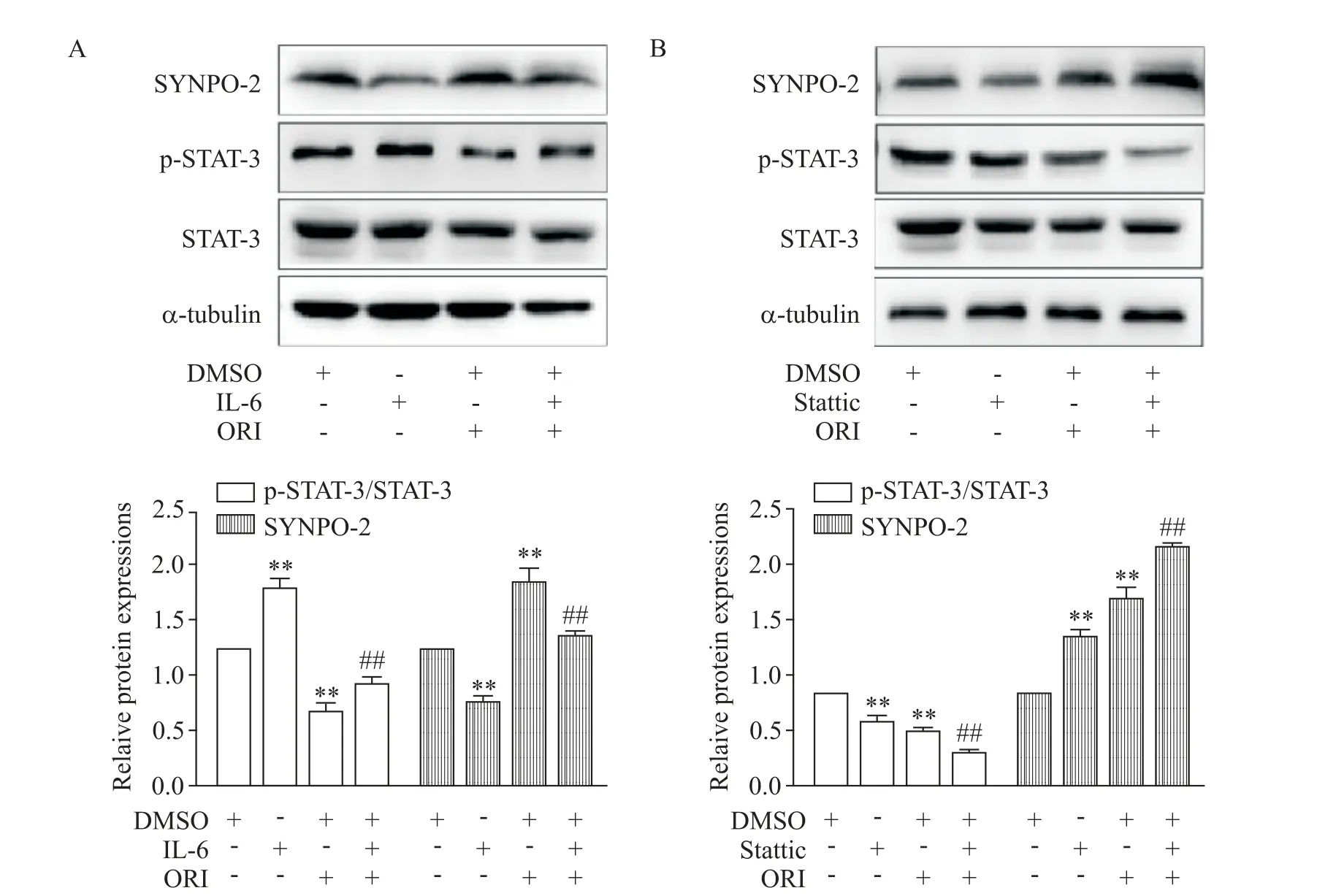
Figure 5. The effect of oridonin(ORI)on STAT-3/SYNPO-2 signaling pathway in U87MG cells. A:the protein expression of STAT-3 and SYNPO-2 in U87MG cells treated with IL-6(20 μg/L)or/and ORI(7.5 μmol/L)for 48 h;B:the protein expression of STAT-3 and SYNPO-2 in U87MG cells treated with Stattic(3 μmol/L)or/and ORI(7.5 μmol/L)for 48 h. Mean±SD.n=3.**P<0.01vs control group;##P<0.01vs ORI group.图5 冬凌草甲素对U87MG细胞STAT-3/SYNPO-2信号通路的影响
讨论
胶质瘤是所有颅内肿瘤中最具侵袭性的实体瘤之一,由于其发病机制复杂、常规化疗药物毒性作用大且肿瘤细胞极易产生耐药性,均对其治疗和预后带来困难。天然来源的中药单体及其复合物因具有取材方便、价格低廉、高效低毒等特点,目前已成为抗恶性肿瘤药物研发的热点。冬凌草,也称“延命草”,是我国传统中草药之一。ORI 是冬凌草的主要活性成分,具有作用靶点众多、抗癌作用广泛的特点,对肝癌、肺癌、胃癌、宫颈癌和乳腺癌等多种肿瘤细胞均能产生明显的抑制或杀伤作用[11]。近期研究显示,ORI 可增加神经胶质瘤细胞的放疗敏感性并诱导细胞凋亡[12],提示其可能在神经胶质瘤的预防和治疗方面具有潜在的应用价值。因此,本研究采用ORI 作用于人恶性胶质瘤细胞U87MG,探讨ORI对U87MG 细胞活力、迁移和凋亡的影响,以及其抗恶性胶质瘤的作用及机制,为ORI 临床抗恶性胶质瘤应用提供一定的实验基础。
细胞凋亡是机体细胞为维持内环境稳定而发生的一种由基因严格控制的自主的、有序的死亡过程,涉及一系列基因的激活、表达及调控,许多天然抗肿瘤药物皆可通过促进细胞凋亡来发挥其抗癌活性[13-14]。本研究结果显示,5、7.5 和10 μmol/L 的ORI作用于恶性胶质瘤细胞U87MG 后,可浓度和时间依赖性地显著抑制其活力和迁移能力,提示ORI 对U87MG细胞具有一定的杀伤作用。流式细胞术及蛋白分析显示,ORI在提高U87MG细胞凋亡率的同时,细胞中的抗凋亡蛋白Bcl-2 表达显著降低,促凋亡蛋白Bax表达显著增高;采用STAT-3磷酸化激动剂IL-6干预后结果显示,与ORI组相比,IL-6+ORI组U87MG细胞中Bcl-2蛋白表达显著增高,Bax蛋白表达显著降低,提示IL-6 可显著抑制ORI 对U87MG 细胞的促凋亡作用;而STAT-3磷酸化抑制剂Stattic却发挥与ORI一致的效应,并协同促进U87MG 细胞的凋亡。上述结果提示ORI 可显著促进U87MG 细胞的凋亡,其机制与STAT-3相关通路抑制有密切联系。
JAK/STAT-3信号通路是调控细胞增殖、分化、凋亡和免疫等方面的关键通路。近年研究表明,STAT-3同时也是人表皮生长因子受体(epidermal growth factor receptor,EGFR)、IL-6和Src等多个致癌性酪氨酸激酶信号通道汇集的焦点,活化的STAT-3 可通过调控下游增殖(Myc和cyclin D1/D2)、凋亡(Bcl-2、Bax和p53)、侵袭迁移(MMP-3、9)及血管生成(VEGF 和HIFE)等关键靶蛋白的表达从而表现出致癌作用,在肿瘤的发生发展、侵袭转移以及药物耐受起着尤为重要的作用[15-16]。SYNPO-2 是一种已知的肿瘤抑制因子,作为STAT-3的下游信号分子,其表达缺失和遗传改变参与了多种侵袭性癌症的高复发率和预后不良[17]。有研究表明,STAT-3 信号通路与神经胶质瘤的发生、生长及化疗耐药都有密切关系[18],但STAT3/SYNPO-2 通路活化异常否参与了恶性胶质瘤发生发展,以及ORI 的抗神经胶质瘤作用是否与此通路有关,目前尚未见报道。本研究结果显示,ORI 可以显著降低U87MG 细胞中STAT-3 蛋白Tyr705 位点的磷酸化水平,并升高其下游SYNPO-2 蛋白表达;采用STAT-3 磷酸化激动剂IL-6 干预后结果显示,与ORI组相比,IL-6+ORI 组U87MG 细胞中STAT-3 蛋白Tyr705位点磷酸化水平显著增高,SYNPO-2蛋白表达显著降低;而STAT-3 磷酸化抑制剂Stattic 却发挥与ORI 一致的效应,并协同降低STAT-3 蛋白Tyr705 磷酸化水平,且进一步促进SYNPO-2 蛋白表达。上述实验结果提示,ORI 诱导U87MG 细胞凋亡与抑制STAT-3/SYNPO-2通路活化有密切联系。
综上所述,我们的体外细胞实验结果提示,ORI可浓度和时间依赖性地显著抑制恶性胶质瘤U87MG细胞的增殖、迁移并促进其凋亡,其促凋亡机制可能与抑制STAT-3/SYNPO-2 信号通路,即抑制STAT-3蛋白Tyr705 位点磷酸化,继而增高SYNPO-2 蛋白表达相关。本研究为探讨恶性胶质瘤病理生理机制、ORI 的临床应用转化及恶性胶质瘤的治疗靶点开发提供了一定的基础实验数据。
【致谢:本实验在重庆医科大学药学院生物化学与分子药理学重点实验室和药物代谢研究重庆市重点实验室完成,特此致谢!】

