阿维来司他对主动脉瓣膜间质细胞成骨分化的作用及机制研究*
刘 艳, 安利钦, 朱梦颖, 蒋 鹏, 刘 璐, 刘天瑶, 翁亚光
(重庆医科大学检验医学院临床检验诊断学教育部重点实验室,重庆 400016)
钙化性主动脉瓣膜疾病(calcific aortic valve disease,CAVD)是全世界常见的心脏瓣膜疾病之一[1],最新数据表明,每年钙化性主动脉瓣疾病的全球患病人数约为1 260 万,影响着2%左右的70 岁以上老年人群[2]。作为一种长期的慢性疾病,CAVD 的特征是瓣膜小叶进行性纤维化、基质重塑和钙化[3],这一过程不能被逆转,且目前临床上缺乏有效的药物治疗,因此,寻找合适的药物干预CAVD 的发生或延缓病程,是目前急需解决的问题[4]。
中性粒细胞弹性蛋白酶(neutrophil elastinase,NE)是一种储存在中性粒细胞嗜苯胺蓝颗粒中的丝氨酸蛋白酶[5]。在病理状态下NE 分泌增多,过度降解细胞外基质,容易导致基质重塑[6]。NE 与心血管疾病有密切联系,在冠心病患者,尤其是不稳定心绞痛和急性心肌梗死患者的血浆中,NE 水平显著升高,被认为是心血管事件的预测因子[7]。研究表明,敲除NE基因能有效缩小载脂蛋白E(apolipoprotein E,ApoE)基因敲除小鼠动脉粥样硬化斑块的大小[8]。一些NE 抑制剂已在动脉粥样硬化[8]和脊髓损伤[9]中展现出良好的保护作用。阿维来司他(alvelestat;又称AZD9668)是近年来开发的一种新型可口服的NE抑制剂,与NE 呈可逆的结合[10]。临床研究结果显示,alvelestat 可改善支气管扩张患者的肺功能,减少痰中的炎症因子[11],并能显著降低由牙龈卟啉单胞菌引起的大鼠腹主动脉瘤直径的增加[12]。目前,NE及其抑制剂alvelestat 在主动脉瓣膜疾病中的作用尚未有研究。因此,本项工作拟检测CAVD 患者瓣膜组织中NE 的表达水平,采用NE 抑制剂alvelestat 研究其对成骨诱导的主动脉瓣膜间质细胞(valve interstitial cells,VICs)成骨分化的作用,并进一步探讨其可能的分子机制。
材 料 和 方 法
1 材料
1.1 人瓣膜组织和猪主动脉VICs 来源 1 例人正常瓣膜组织取自重庆医科大学附属第一医院心胸外科患有主动脉夹层的患者,3例钙化瓣膜标本来源于行瓣膜置换手术的CAVD 患者。患者及家属均已签署知情同意书。术中取下的瓣膜立即用无菌磷酸盐缓冲液漂洗,一部分置于4%多聚甲醛中固定,包埋切片;另一部分置于液氮中保存,用于后续实验。
猪主动脉瓣膜取自重庆市璧山区动物检疫定点屠宰场,选取10 只8~10 月龄健康猪,体质量100~180 kg,取下猪瓣膜组织,立即用含1%青霉素/链霉素的无菌磷酸盐缓冲液漂洗3 次,放入无血清无抗生素的M199 培养液中,并置于冰上,30 min 内带回实验室进行后续的细胞消化分离。本文中的实验已通过重庆医科大学附属第一医院科研伦理委员会批准。
1.2 试剂 M199 培养液购自HyClone;澳洲胎牛血清(fetal bovine serum,FBS)购自Cellmax;Ⅰ型胶原酶购自Sigma;MTT、β-磷酸甘油二钠盐、维生素C、地塞米松、胰蛋白酶和茜素红染料均购自北京索莱宝科技有限公司;1%青霉素/链霉素溶液和碱性磷酸酶染色试剂盒购自上海碧云天生物技术有限公司;阿维来司他购自Selleck;兔抗人骨桥蛋白(osteopontin,OPN)抗体、兔抗人Ⅰ型胶原(type I collagen,collagen I)抗体和兔抗人波形蛋白(vimentin)抗体购自沈阳万类生物科技有限公司;鼠抗人Runt 相关转录因子2(Runt-related transcription factor 2,RUNX2)抗体购自Santa Cruz;兔抗人α-平滑肌肌动蛋白(αsmooth muscle actin,α-SMA)抗体和兔抗人CD31 抗体购自Abcam;兔抗人细胞外信号调节激酶1/2(extracellular signal-regulated kinases 1/2,ERK1/2)抗体和兔抗人p-ERK1/2抗体购自Cell Signaling Technology;鼠抗人GAPDH 抗体购自武汉三鹰生物技术有限公司;PD98059 购自MedChemExpress;兔SP 显色试剂盒、DAB 显色试剂盒及辣根过氧化物酶标记的山羊抗鼠和山羊抗兔IgG 均购自北京中杉金桥生物技术有限公司;兔抗人NE 抗体和荧光兔Ⅱ抗购自北京博奥森生物技术有限公司;PVDF 膜和化学发光试剂盒均购自Millipore。
2 方法
2.1 原代猪主动脉VICs 的分离与培养 按我们已报道的方法[13]进行原代猪主动脉VICs 分离。在超净台中取出猪主动脉瓣膜,用含1%青霉素/链霉素的无菌PBS再次漂洗3次,用无菌医用棉签轻轻擦拭瓣膜组织的表面,去除瓣膜内皮细胞;之后用无菌剪刀剪碎组织,用2 g/L 的Ⅰ型胶原酶于37℃消化组织,待组织呈絮状后终止消化,700×g离心5 min,去除上清,将组织沉淀物置于含10% FBS 和1%青霉素/链霉素的M199 培养液中培养,每3 d 更换一次培养液。待细胞密度约90%左右进行传代,取第3~7代细胞用于后续实验。
2.2 免疫组织化学染色 术中取下的人瓣膜组织于4%多聚甲醛中固定,后续包埋、切片。将石蜡切片于56 ℃烘片2 h,依次用100%、95%、80%和70%乙醇水化。将切片置于0.01 mol/L 的枸橼酸钠缓冲液在微波炉中进行抗原修复,自然冷却。加入3%过氧化氢封闭内源性过氧化物酶,正常山羊血清室温封闭15 min,滴加适量Ⅰ抗,4 ℃过夜。PBS清洗后滴加相应生物素标记的Ⅱ抗,室温孵育15 min,滴加辣根过氧化物酶标记的链霉卵白素工作液,室温下孵育15 min,加入新鲜配制的DAB显色液5 min,自来水冲洗,苏木素染色液孵育20 s后用中性树脂封片。
2.3 免疫荧光染色鉴定细胞表型 将第3~7 代VICs 接种于24 孔板无菌爬片中,待细胞生长至约50%密度时用4%多聚甲醛固定30 min,0.5% Triton X-100进行细胞破膜,室温孵育20 min。加入3%过氧化氢封闭内源性过氧化物酶,室温孵育15 min,正常山羊血清封闭30 min,滴加1∶50稀释的Ⅰ抗(兔抗人α-SMA、CD31 和vimentin 抗体),置于4 ℃过夜;加入1∶200稀释的荧光Ⅱ抗,室温下避光孵育2 h,用DAPI 复染细胞核,于荧光显微镜下观察VICs 中α-SMA、CD31和vimentin的表达情况。
2.4 MTT 法检测细胞活力 将VICs 以每孔5 000个的密度接种于96 孔细胞培养板,每孔加入100 μL培养液,待细胞生长至30%左右时加入不同浓度(0、1、10、20、40、80 和160 nmol/L)的alvelestat 处理细胞24 h 和48 h,每组5 个复孔。药物处理之后,在相应时点加入10 μL MTT溶液,继续培养4 h,吸出孔内液体后每孔加入150 μL DMSO 溶液,用酶标仪于492 nm处检测各孔吸光度(A)。
2.5 VICs 的成骨分化诱导 按我们已报道的方法配制成骨培养液[13]:M199 培养液中加入10 mmol/L β-甘油磷酸二钠盐、50 mg/L 维生素C 和100 nmol/L地塞米松,配制为成骨培养液(osteogenic medium,OM),用于诱导细胞成骨分化。
2.6 用alvelestat 处理VICs 及实验分组 取对数生长期的细胞接种于相应培养皿中,待细胞密度达到60%时,加入相应浓度的alvelestat 处理。实验分组如下:对照组(blank 组)用正常M199 培养液处理;OM 组用钙盐培养液处理;OM+alvelestat 组加相应浓度(5、10、20 和40 nmol/L)的alvelestat 处理24 h 或48 h。
2.7 Western blot 实验 提取细胞总蛋白。将适量蛋白样本进行10% SDS-PAGE,恒压90 V 电泳30 min,120 V 电泳60 min,电泳结束后切下相应位置的胶,恒流210 mA 将蛋白转移至PVDF 膜上,5%脱脂奶粉封闭2 h,洗膜后加入相应Ⅰ抗(NE、collagen I、RUNX2和OPN抗体1∶500稀释,α-SMA、ERK1/2和p-ERK1/2 抗体1∶1 000 稀释,GAPDH 抗体1∶2 000 稀释)于4 ℃过夜孵育。加入相应Ⅱ抗(1∶5 000 稀释),于37 ℃孵育1 h,洗膜后加入化学发光液,于化学发光成像系统中检测相应蛋白的表达情况。用Image Lab 软件计算各条带的灰度值,GAPDH 作为内参照,将目的蛋白条带灰度值与对应内参照条带灰度值的比值作为目的蛋白的相对表达水平。
2.8 碱性磷酸酶染色 取对数生长期的VICs 接种于24 孔细胞培养板中,细胞密度达到40%左右更换为含5% FBS 的M199 培养液,按照实验分组进行相应处理,培养7 d。7 d 后弃去培养液,PBS 清洗3 次,4%多聚甲醛固定30 min,加入BCIP/NBT 工作液200 μL,双蒸水终止反应,观察染色结果。
2.9 茜素红染色 取对数生长期的VICs 接种于24孔细胞培养板中,细胞密度达到30%左右更换为含2% FBS 的M199 培养液,按照实验分组进行相应处理,培养14 d。14 d 后弃去培养液,PBS 清洗3 次,4%多聚甲醛固定30 min,加入0.4%茜素红S 溶液,用双蒸水终止反应,观察染色结果。
3 统计学处理
采用GraphPad Prism 9 软件进行统计分析。计量资料用均数±标准差(mean±SD)表示。组间均数比较采用单因素方差分析,两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
结果
1 钙化的主动脉瓣膜组织中NE和成骨相关标志物表达升高
免疫组化结果显示,与正常瓣膜组织相比,CAVD 患者的瓣膜组织中OPN 和NE 的表达高于非钙化瓣膜组织,见图1A。Western blot 结果证实,钙化的瓣膜组织中NE,钙化指标RUNX2 和OPN,以及纤维化指标α-SMA 表达均显著上调(P<0.05 或P<0.01),见图1B。
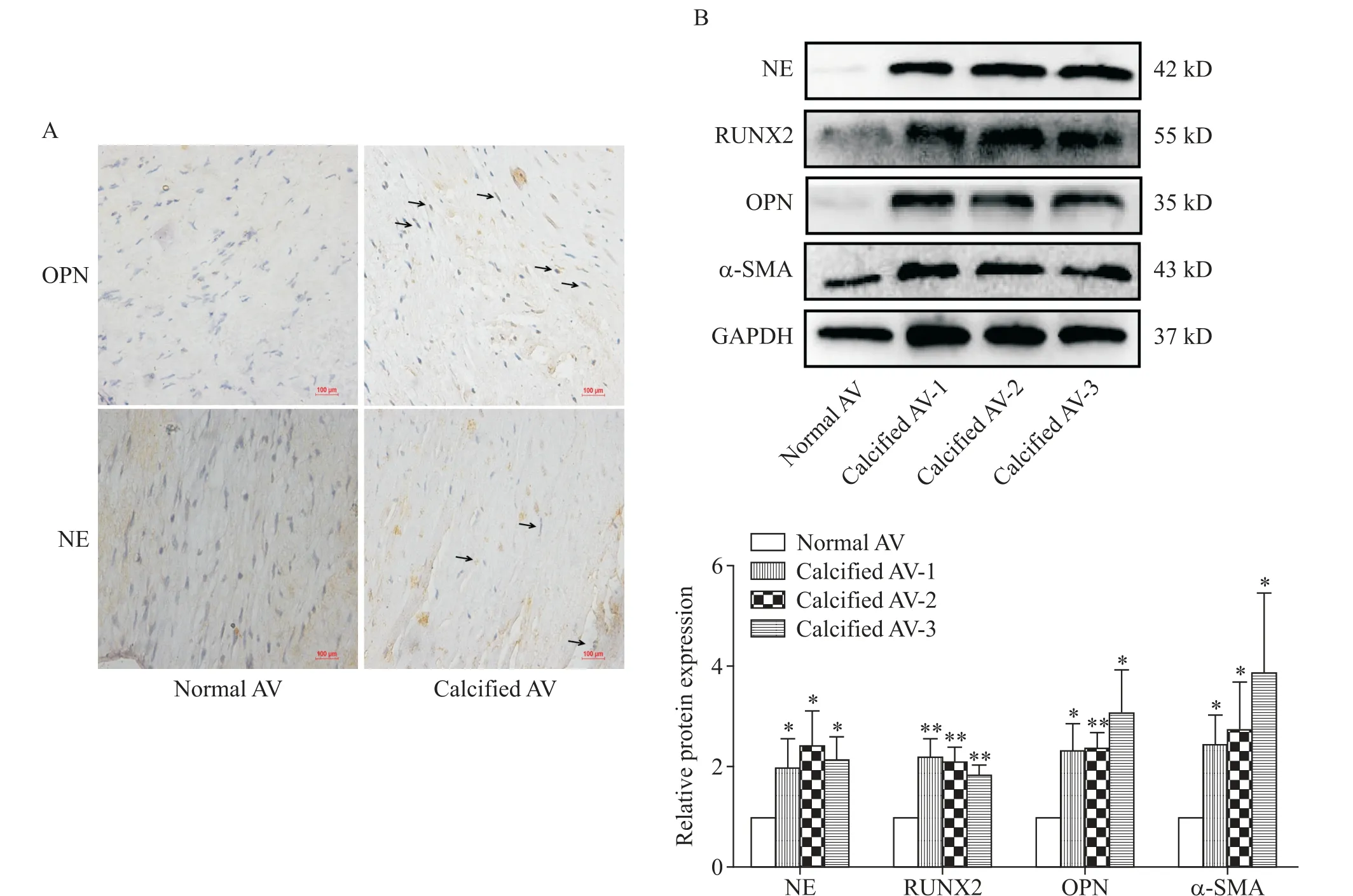
Figure 1. Expression levels of NE and osteogenic indicators in calcified aortic valve(AV)tissues. A:the expression of NE and OPN in AV tissue was detected by immunohistochemistry(the black arrows indicate the positive sites;scale bar=100 μm);B:the protein expression of NE,α-SMA,OPN and RUNX2 was detected by Western blot. Mean±SD.n=3.*P<0.05,**P<0.01vs normal AV group.图1 钙化的主动脉瓣膜组织中NE和成骨指标表达水平
2 原代猪主动脉VICs的形态及表型鉴定
将对数生长期的VICs 接种于24 孔细胞培养板中,24 h 后贴壁,可见细胞呈长梭形或不规则三角形,生长时呈放射状。细胞免疫荧光结果显示,分离的细胞表达α-SMA和vimentin,而不表达内皮细胞标志物CD31,说明原代VICs分离成功,见图2。
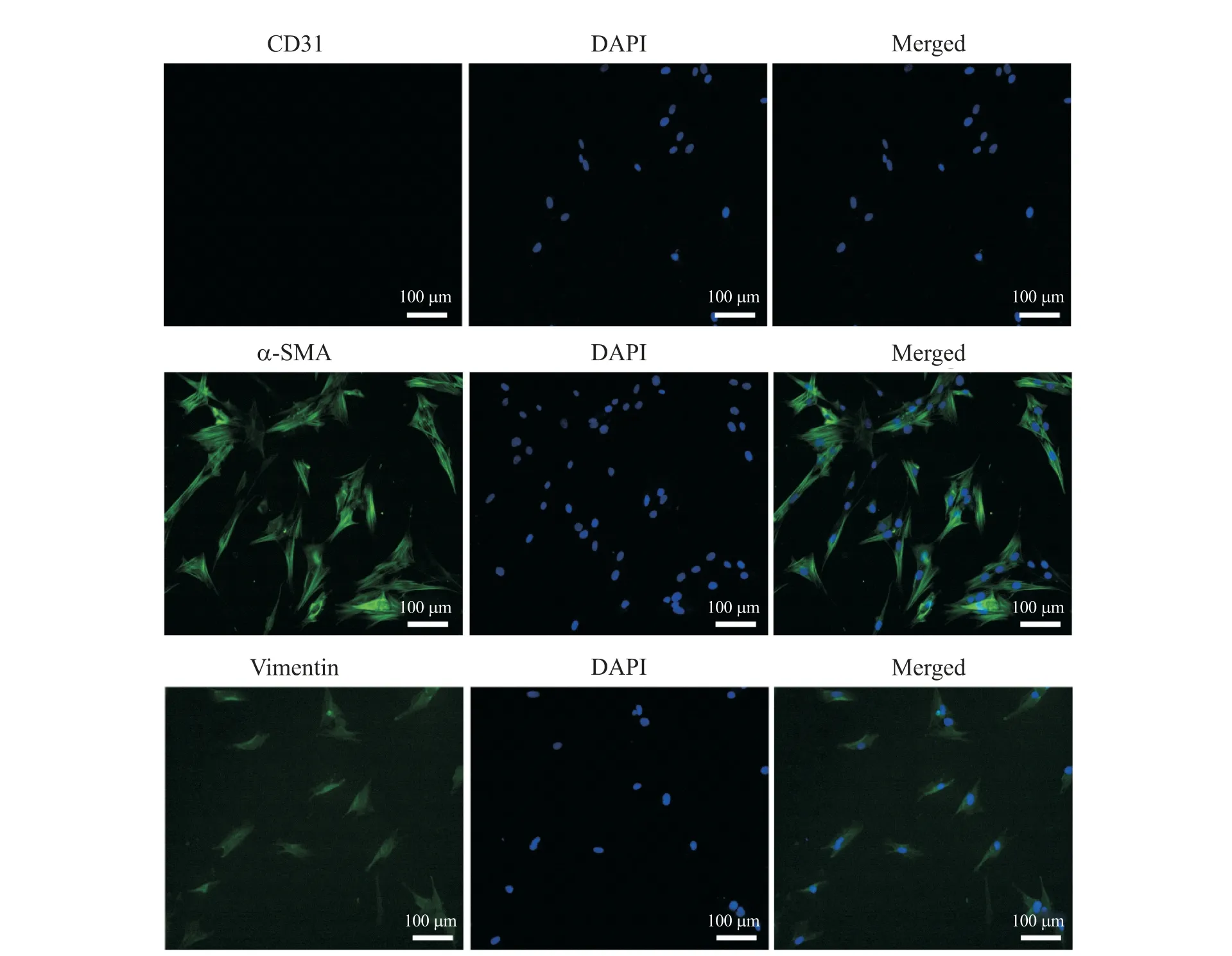
Figure 2. Phenotype identification of primary porcine aortic valve interstitial cells. Immunofluorescence staining of CD31,α-SMA and vimentin. The scale bar=100 μm.图2 原代猪主动脉瓣膜间质细胞表型的鉴定
3 NE抑制剂alvelestat对VICs活力的影响
MTT 实验结果显示,浓度80 和160 nmol/L 以上的alvelestat 会损害VICs 的活力(P<0.01),见图3A;48 h 后,细胞活力下降为47.5%和21.74%,显著低于空白组(P<0.01),见图3B。因此,在不影响细胞活力的情况下,为了筛选有效的药物处理浓度,选取了0~40 nmol/L浓度的alvelestat进行后续实验。

Figure 3. The effect of alvelestat on the viability of valve interstitial cells(VICs). A:the viability of alvelestat on VICs was detected by MTT method;B:the viability of VICs treated with alvelestat for 48 h. Mean±SD.n=3.**P<0.01vs 0 nmol/L group.图3 NE抑制剂alvelestat对瓣膜间质细胞活力的影响
4 NE 抑制剂alvelestat 可抑制成骨诱导的VICs 纤维化
将VICs 接种于培养皿,用OM 诱导24 h 后提取细胞总蛋白。Western blot结果显示,OM组早期纤维化指标α-SMA 和collagen I 表达水平显著高于blank组(P<0.01);在OM 条件下,加入不同浓度(5、10、20和40 nmol/L)的alvelestat,Western blot 结果显示,40 nmol/L 的alvelestat 可显著抑制α-SMA 和collagen I 的表达(P<0.05或P<0.01),见图4。
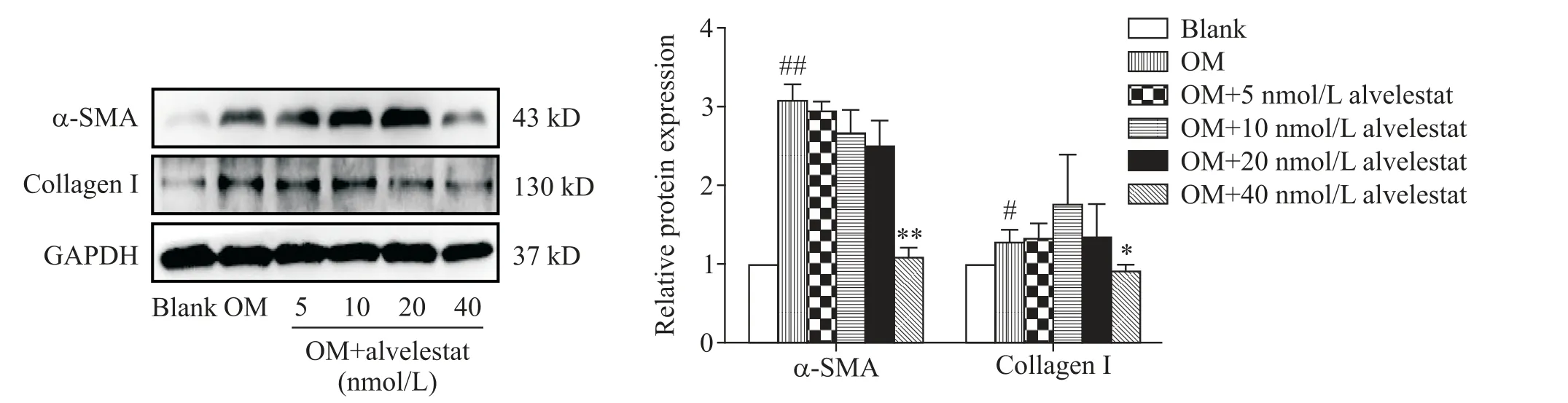
Figure 4. Alvelestat inhibited early fibrosis of valve interstitial cells induced by osteogenic medium(OM). The protein expression levels of α-SMA and collagen I were detected by Western blot. Mean±SD.n=3.#P<0.05,##P<0.01vs blank group;*P<0.05,**P<0.01vs OM group.图4 NE抑制剂alvelestat抑制成骨诱导的瓣膜间质细胞发生早期纤维化
5 NE 抑制剂alvelestat 可抑制成骨诱导过程中的VICs向成骨样表型分化
Western blot 结果表明,成骨诱导VICs 48 h 后,OM 组成骨指标RUNX2 和OPN,以及NE 的表达水平显著高于blank 组(P<0.05 或P<0.01),5 nmo/L 和10 nmo/L 的alvelestat 对RUNX2、OPN 和NE 的表达无显著影响(P>0.05),40 nmol/L 的alvelestat 可显著降低NE、RUNX2 和OPN 的表达水平(P<0.05 或P<0.01),见图5。因此选择40 nmol/L 作为后续处理的有效浓度。

Figure 5. Alvelestat inhibited osteogenic differentiation and NE expression of valve interstitial cells induced by osteogenic medium(OM). The protein expression levels of NE,RUNX2 and OPN were detected by Western blot. Mean±SD.n=3.#P<0.05,##P<0.01vs blank group;*P<0.05,**P<0.01vs OM group.图5 NE抑制剂alvelestat抑制成骨诱导的瓣膜间质细胞的成骨分化和NE表达
6 NE 抑制剂alvelestat 可抑制成骨诱导的VICs 早期及晚期成骨分化能力
同正常对照组相比,OM 诱导VICs 7 d 时,碱性磷酸酶染色增多,14 d 时,茜红素染色增强,钙沉积增多;40 nmol/L 的alvelestat 则可显著降低碱性磷酸酶染色和钙沉积,见图6。

Figure 6. The effect of alvelestat on the osteogenic differentiation of valve interstitial cells(VICs)in early and late stages. A:the early osteogenic differentiation ability of VICs was measured by alkaline phosphatase staining;B:the late osteogenic differentiation ability of VICs was measured by alizarin red staining. OM:osteogenic medium. The scale bar=100 μm.图6 NE抑制剂alvelestat对瓣膜间质细胞早期及晚期成骨分化能力的影响
7 NE 抑制剂alvelestat 能抑制钙盐诱导的ERK1/2信号通路活化
Western blot结果显示,与正常瓣膜组织相比,钙化的瓣膜组织中p-ERK1/2 水平显著升高(P<0.01),见图7A。体外成骨诱导VICs 钙化过程中,加入40 nmol/L的alvelestat,在不同时点(0、1、2、4和8 h)检测ERK1/2 和p-ERK1/2 蛋白水平,Western blot 结果显示,与OM 组相比,alvelestat 使p-ERK1/2 蛋白水平在8 h 显著降低(P<0.01),而不影响总ERK1/2 蛋白水平(P>0.05),见图7B。为进一步明确alvelestat 对ERK1/2 信号通路的作用,我们采用ERK1/2 抑制剂PD98059 进行验证,Western blot 结果显示,alvelestat和PD98059 均能显著降低NE、RUNX2 和OPN 的蛋白水平(P<0.05或P<0.01),见图7C。
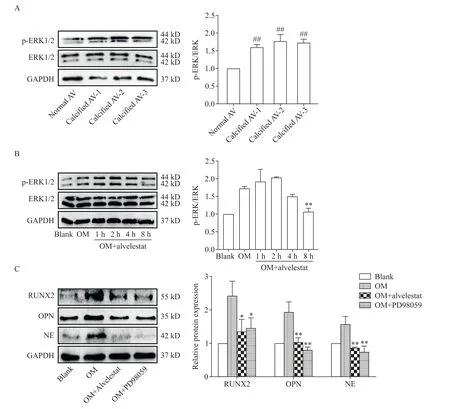
Figure 7. The effect of alvelestat on ERK1/2 signaling pathway. A:the protein levels of ERK1/2 and p-ERK1/2 in the aortic valve(AV)tissues were detected by Western blot;B:the effects of alvelestat on protein levels of ERK1/2 and p-ERK1/2 in valve interstitial cells(VICs)treated with osteogenic medium(OM)and 40 nmol/L alvelestat were detected by Western blot;C:the VICs were treated with OM and 40 nmol/L alvelestat or 10 μmol/L PD98059 for 24 h,and Western blot was used to detect the expression of RUNX2,OPN and NE. Mean±SD.n=3.##P<0.01vs normal AV group;*P<0.05,**P<0.01vs OM group.图7 NE抑制剂alvelestat对ERK1/2信号通路的影响
讨论
长期以来,人们认为CAVD 是由于瓣膜小叶的长期磨损造成的一种被动的退化性疾病[14]。如今的研究表明,CAVD 是一种涉及脂质沉积和炎症、纤维化、钙化等复杂因素的主动过程[15]。VICs 是构成主动脉瓣膜的主要细胞,在健康的瓣膜组织中VICs 呈静息状态,当受到外界刺激,如内皮损伤和炎症等,会向活化状态的VICs 转化,此时瓣膜组织开始发生纤维化;当刺激持续存在时,VICs继而向成骨样表型转化,瓣膜组织发生钙沉积和矿化[16]。本研究结果显示,alvelestat 不仅能抑制VICs的早期纤维化,也能在晚期抑制VICs 的成骨分化,具有较好的保护作用。由于人类VICs 的来源十分有限,目前在CAVD研究领域也多使用和人类同源性较高的猪VICs 作为实验材料,故在本研究中采用了容易获得和培养的猪原代VICs进行实验研究。
我们在钙化的瓣膜组织中观察到NE 的表达显著升高,成骨诱导VICs 钙化过程中,NE 水平也随成骨指标RUNX2 等升高,这提示NE 可能参与了主动脉瓣膜钙化的病理过程。但瓣膜钙化时NE 水平升高的原因尚不明确。我们的结果显示,成骨培养液可诱导VICs 中NE 表达增加,因此异常钙盐沉积可能是NE 升高的原因之一。目前NE 已被证实参与了多种心血管疾病的病理过程,例如,NE 能促进ApoE敲除小鼠动脉粥样硬化的发生[8],血清中NE 的活性与收缩期高血压和动脉硬化有关[17]。目前开发出的NE 抑制剂多用于治疗一些炎症性疾病,例如,NE 抑制剂西维来司钠能降低急性肺损伤患者的肺损伤评分,升高氧合指数[18],并且能减轻大鼠脑缺血/再灌注后的炎症反应[19]。但由于西维来司钠和NE 不可逆结合而形成酰基酶复合物,导致它有严重的毒副作用,因此在临床上的使用受到一定的限制[20-21]。而alvelestat 作为新型的NE 抑制剂,由于其与NE 呈可逆结合,并具有高选择性和药物耐受性好的特点,现已进入临床二期研究[11]。目前对于alvelestat 的研究主要聚焦于一些炎性疾病,例如慢性阻塞性肺疾病和囊性纤维化的抗炎作用方面,尚未研究其在心血管疾病中的作用。研究表明,alvelestat 在血液和细胞水平的IC50分别为44 和48 nmol/L[22]。本研究发现alvelestat 有效抑制纤维化和钙化的作用浓度为40 nmol/L,并不呈现剂量依赖性,且当alvelestat 浓度在40 nmol/L 以上时,VICs 的活力降至50%以下,这也与以往研究相符[22]。
ERK1/2 信号通路参与了多种生物学过程,包括细胞增殖和凋亡等[23]。白细胞介素17(interleukin-17,IL-17)能通过激活ERK1/2 促进肾脏纤维化[24]。ERK1/2 信号也促进了大鼠骨髓间充质肝细胞的成骨分化作用[25]。有研究表明,ERK1/2 信号通路被激活将导致ERK1/2 磷酸化水平升高,从而加速了主动脉瓣膜钙化的进程[26]。ERK1/2 信号通路的抑制剂PD98059 也被证实能有效抑制VICs 的钙化[27]。NE也可以通过激活ERK1/2 信号通路并诱导促炎因子IL-8 的产生,从而促进香烟提取物引起的小鼠肺气肿[28]。本研究结果显示,alvelestat 能显著抑制成骨诱导的ERK1/2 信号通路的激活,且alvelestat 和ERK1/2 抑制剂PD98059 均能显著降低成骨指标RUNX2 和OPN 的表达水平,进一步证实alvelestat 能发挥与PD98059 相同的抑制ERK1/2 通路活化和减轻VICs 成骨分化的作用。我们还发现ERK1/2 抑制剂PD98059 同时也能抑制NE 的表达,但ERK1/2 信号通路是否能反向调控NE 的表达这一机制尚不清楚,后续我们将对这一结果进行深入研究。
综上所述,本研究证实了在钙化的瓣膜组织和成骨诱导的VICs 中NE 的表达水平升高,NE 抑制剂alvelestat 能通过抑制NE 和ERK1/2 信号通路的活化来抑制VICs 的纤维化和成骨分化。在后续研究中,我们将在动物和细胞水平研究NE 及其抑制剂alvelestat 对瓣膜钙化的作用和分子机制,为以NE 为治疗靶点的瓣膜钙化临床治疗提供参考资料。

