17种中药多糖提取物的理化性质研究*
李承浩,郑富香,游广娇,任晓亮,邓雁如
(天津中医药大学中药学院,天津 301617)
多糖又称多聚糖,是由糖苷键连接起来的醛糖或酮糖组成的高聚物,分子量为数万至数百万,用通式(C6H10O5)n表示[1-3]。多糖不仅在生物体生命活动中起着重要的营养作用,而且还在维持生物体的生命活动中发挥着重要生理功能,因此其与脂质、蛋白质、核酸一起被视为生物体中最重要的4种大分子物质[4-6]。
多糖是一种很好的佐剂,不仅可以作为一种能量物质和结构成分,还有一部分多糖可以参与细胞的代谢及生理调节。近年来,关于活性多糖生物功能的报道主要包括多糖的抗肿瘤、抗凝血、抗氧化、降血脂、抗病毒、提高免疫功能等,如牛膝多糖为水溶性的小分子多糖,具有调节免疫、保护肝脏、抑制肿瘤作用;如桑黄多糖具有抗肿瘤、调节免疫、治疗肝炎、抗炎、抗氧化、降血糖等生理活性。除了作为药物用于治疗,中药多糖在皮肤领域也具有延缓衰老、美白、晒后修复、祛痘抗炎、促进创伤愈合等功效,可以作为功效化妆品活性成分的天然来源,还可以作为凝固剂、润滑剂、增稠剂、絮凝剂、悬浮剂、凝胶剂、添加剂等广泛应用于化工、食品、石油、纺织印染、水处理和医药等行业。
中药多糖主要来源于植物、藻类和微生物类。其中植物类多糖种类最为繁多,且没有细胞毒性,应用于生物体毒副作用小,所以在医药和保健品行业得到了更好的推广及应用[7-8]。本文选用17种市面常售多糖研究其多糖含量与蛋白质含量、吸湿性、黏度、抗氧化活性,希望总结出多糖的共性,为以后的多糖应用提供依据[9-10]。
1 材料
1.1 药品与试剂 黄芪多糖,批号:SJH17102201,购自西安四季生物科技有限公司;虫草多糖,批号:CC20170625,购自兰州百禾生物科技有限公司;大枣多糖,购自西安通泽生物科技有限公司;枸杞多糖,批号:20170725,购自西安通泽生物科技有限公司;白桦茸多糖,批号:TZ170810,购自西安通泽生物科技有限公司;灰树花多糖,批号:2017091204,购自西安万方生物科技有限公司;白术多糖,批号:BZ20170715,购自兰州百禾生物科技有限公司;刺五加多糖,批号:GN170606-SG,购自宁波金艾农生物科技有限公司;土茯苓多糖,购自陕西森弗天然制品有限公司;甘草多糖,批号:GCDT170714,购自陕西森弗天然制品有限公司;黄精多糖,购自西安美川生物科技有限公司;桑黄多糖,购自西安万方生物科技有限公司;党参多糖,购自西安维珍生物科技有限公司;猪苓多糖,批号:Virgin170301,购自西安维珍生物科技有限公司;海带多糖,批号:CY170901,购自陕西慈源生物技术有限公司;蒲公英多糖,批号:CY170807,购自陕西慈源生物技术有限公司;牛膝多糖,批号:QZ17-7-26,购自西安青芷生物技术有限公司;苯酚,分析纯,购自西陇科学股份有限公司;浓硫酸,分析纯,购自开封开化有限公司试剂厂;无水葡萄糖,批号:160824,纯度≥98%,购自上海融禾医药科技发展有限公司;蒸馏水,购自屈臣氏食品饮料有限公司;考马斯亮蓝G-250试剂,购自北京索莱宝科技有限公司;维生素C,批号:171204,纯度≥98%,购自上海融禾医药科技发展有限公司;FeCl3·6H2O,分析纯,购自上海麦克林生化科技有限公司;FeSO4·7H2O,分析纯,购自天津市风船化学试剂科技有限公司。
1.2 仪器与设备 旋转黏度计(NDJ-79,上海平轩科学仪器有限公司);台式高速离心机(TG16-WS,长沙湘仪离心机仪器有限公司);十万分之一天平(Sartorius BT125D,赛多利斯科学仪器有限公司);pH计(PB-10,赛多利斯科学仪器有限公司);万分之一天平(FA2004A,上海精天电子仪器有限公司);电热鼓风干燥(WC-20,天津市中药机械厂);温湿计时表(WS-A6,上海天宇科技仪表有限公司);智能磁力加热搅拌器(SZCL-4B,巩义市予华仪器有限公司);紫外可见分光光度计(TU-1901,北京普析通用仪器有限责任公司);数显恒温水浴锅(HH-S8,金坛盛蓝仪器制造有限公司)。
2 方法
2.1 中药多糖的含量测定
2.1.1 标准曲线建立 精密称定105℃干燥至恒质量的无水葡萄糖标准品2.00 mg于10 mL棕色容量瓶内,加蒸馏水稀释至刻度,得到0.2 mg/mL的葡萄糖标准品溶液。分别精密量取葡萄糖标准品溶液0.05、0.1、0.2、0.3、0.5、1.2、1.5 mL 于 10 mL 具塞试管中,补水至2.0 mL,加入1 mL 5%苯酚溶液后迅速加入浓硫酸5 mL,摇匀,室温放置5 min,置沸水浴中加热15 min,取出冰水浴5 min,冷却至室温,于490 nm波长处测定吸光度,以空白试剂为参照测定吸光度。
以对照品浓度X(mg/mL)为横坐标,吸光度Y(ΔAbs)为纵坐标绘制标准曲线。得到标准曲线回归方程为 Y=12.421X+0.206 1(r=0.999 5),表明葡萄糖标准品在0.005~0.15 mg/mL线性关系良好。
2.1.2 精密度实验 精密称取葡萄糖对照品溶液,连续测定6次,RSD为0.47%,表明仪器精密度良好。
2.1.3 重复性实验 精密称取白术多糖粉末0.2 g定容至100 mL容量瓶,从中精密量取2 mL于具塞试管中,平行6份,然后加入5%苯酚1 mL、浓硫酸5 mL,静置 5 min,水浴 15 min,冰浴 5 min,放置室温后测定其吸光度。RSD为2.20%,表明重复性良好。
2.1.4 稳定性实验 取“2.1.3”项下配制好的溶液,每隔10 min测定1次吸光度,RSD为0.98%,表明样品在1 h内稳定性良好。
2.1.5 加样回收率实验 精密吸取白术多糖样品溶液6份,每份2 mL,分别精密加入一定量的葡萄糖标准品,按上述方法操作测定吸光度,计算得到加样回收率为98.06%,RSD为2.39%,符合方法学要求。
2.1.6 多糖含量测定 分别精密称定多糖粉末2 g于100 mL棕色容量瓶中,加蒸馏水稀释至刻度,摇匀至溶解完全,4 000 r/min离心15 min(离心半径为10 cm),取上清,即得多糖溶液。精密量取适量多糖溶液,加蒸馏水稀释得到0.02 mg/mL的供试品溶液。精密吸取供试品溶液2.0 mL,按照“2.1.1”项下自“加入1 mL 5%苯酚溶液”起依法操作,平行6份。根据回归方程及公式计算市售多糖样品的多糖含量。样品中多糖含量(%)=cdvm×1 000。其中,c为样品待测液中葡萄糖的质量浓度(mg/mL),d为待测液的稀释倍数,v为待测液的总体积(mL),m为称取的样品质量(g)。根据回归方程及公式计算得到17种市售多糖含量均较高[11-14]。
2.2 蛋白质含量测定
2.2.1 标准曲线的建立 考马斯亮蓝试剂配置:称取100 mg考马斯亮蓝G-250溶于50 mL 95%的乙醇及加入100 mL 85%的磷酸,加蒸馏水稀释至1 L,最终溶液含0.01%的考马斯亮G-250、4.7%的乙醇及8.5%的磷酸,置于棕色试剂瓶中备用,4℃保存。蛋白标准液配置:精密称取牛血清白蛋白10mg置于10 mL棕色容量瓶中,加蒸馏水稀释至刻度即得1.0 mg/mL的牛血清蛋白标准溶液,4℃储存(用后放入冰箱)。分别精密量取1.0 mg/mL的牛血清白蛋白溶液 0.01、0.06、0.08、0.10、0.15、0.20、0.25、0.30 mL于10 mL具塞试管中,加水补足至1 mL,得到梯度浓度对照品溶液,向试管中加入考马斯亮蓝试剂5.0 mL混匀,室温放置10 min,用紫外可见分光光度计测定其于595 nm下的吸光度,以蒸馏水为空白对照,以牛血清白蛋白溶液X(mg/mL)为横坐标,吸光度Y(△Abs)为纵坐标绘制标准曲线。得到标准曲线回归方程为 Y=4.597X+0.093(r=0.999 0),线性范围为0.01~0.3 mg/mL。
2.2.2 精密度实验 精密量取浓度为0.06 mg/mL的标准牛血清白蛋白溶液1 mL,加入考马斯亮蓝G-250显色剂5.0 mL混匀,室温放置10 min后于595 nm测定吸光度,连续测定6次。RSD为0.40%,表明仪器精密度良好。
2.2.3 重复性实验 精密称取500 mg灰树花多糖样品,稀释50倍得到浓度为10 mg/mL的样品溶液,从中量取1 mL,平行6份,按上述方法操作测定吸光度。RSD为2.22%,表明稳定性良好。
2.2.4 稳定性实验 精密量取10 mg/mL的灰树花多糖样品溶液1 mL,按上述方法操作,每隔10 min测定吸光度,RSD为2.0%,1 h内其线性范围良好。
2.2.5 加样回收率实验 取10 mg/mL的灰树花多糖样品溶液0.5 mL,加入浓度为0.4 mg/mL的牛血清白蛋白标准溶液0.5 mL,再加入5 mL考马斯亮蓝G-250显色试剂,混匀,室温放置10 min,于595 nm处测定吸光度,以0号试管为空白对照,根据标准曲线算出相应浓度,计算加入蛋白质量,并计算回收率,分别进行6次平行测定。RSD为2.98%,提示线性范围良好。
2.2.6 蛋白质含量测定 精密称定各多糖样品粉末0.1 g于10 mL棕色容量瓶中,加蒸馏水稀释至刻度,摇匀至完全溶解,得到浓度为10 mg/mL的多糖溶液。精密量取多糖溶液1 mL,按照本实验“2.2.1”项下自“向试管中加入考马斯亮蓝试剂5.0 mL”起依法操作,平行测定3次,并根据回归方程计算多糖粉末中蛋白质含量[15-18]。
2.3 多糖吸湿性测定 在已恒质量的称量瓶底部分别加入1.5 g干燥多糖粉末,置玻璃干燥容器内备用;将底部含有氯化钠过饱和溶液的玻璃干燥器放入25℃烘箱中恒温24 h,此时干燥器内的相对湿度为50%;将多糖粉末置于有氯化钠过饱和溶液的干燥箱中,于25℃恒温箱中保存,定时取样称取质量,重复3次,计算吸湿百分率。经观察,发现所有的多糖粉末随着时间的延长均呈现出不同程度的吸湿效果[19-22]。吸湿百分率=(吸湿后质量-吸湿前质量)/吸湿前质量×100%。
2.4 多糖黏度测定
2.4.1 多糖溶液浓度对黏度的影响 将多糖溶液配置成 0.02、0.05、0.10、0.15 g/mL 不同浓度的多糖溶液,室温下磁力搅拌充分溶解,在剪切速率750 r/min条件下测定其黏度3次,取平均值。
2.4.2 温度对多糖溶液黏度的影响 配置浓度为0.15 g/mL的多糖溶液,在剪切速率为750 r/min条件下,将多糖溶液分别在25、45、65、85℃搅拌,测定其黏度变化[23-24]。
2.5 总抗氧化能力测定
2.5.1 溶液制备 FRAP试剂:1)300 mmol/L,pH=3.6的醋酸钠缓冲溶液:称取无水醋酸钠0.187 1 g,加入冰醋酸1.6 mL,加蒸馏水至100 mL。采用pH计测定其pH为3.6。2)10 mmol/L TPTZ(溶解在40 mmol/L盐酸溶液中):精确量取浓盐酸(36%~38%)0.333 mL,用水定容至100 mL容量瓶内,得到40 mmol/L盐酸溶液。精确称取TPTZ粉末31.23 mg于10 mL棕色容量瓶内,用40 mmol/L盐酸溶液稀释至刻度,得到10 mmol/L TPTZ溶液澄清透明。3)20 mmol/L FeCl3:精确称取 FeCl3·6H2O 固体粉末54.06 mg于10 mL棕色容量瓶内,加蒸馏水稀释至刻度,得到20 mmol/L FeCl3溶液。将醋酸钠缓冲溶液(300 mmol/L,pH=3.6)、TPTZ(10 mmol/L)和 FeCl3(20 mmol/L)以体积比 10∶1∶1 比例混合,配成 FRAP试剂(临用前新鲜配制)[25]。
对照品溶液:精密称取27.8 mg FeSO4·7H2O颗粒于10 mL棕色容量瓶内,加入蒸馏水稀释至刻度,得到10 mmol/L的FeSO4溶液。精密量取FeSO4溶液适量,加水逐级稀释,分别得到浓度为0.1、0.2、0.3、0.4、0.5、0.6、0.8、1.0、1.2 mmol/L 的对照品溶液。
样品溶液:精密称取多糖粉末25 g于50 mL棕色容量瓶内,加水稀释至刻度,混匀,水浴加热至溶解完全,放至室温,4 000 r/min离心15 min(离心半径为10 cm),取上清得到多糖溶液。分别精密量取适量中药多糖溶液,加蒸馏水稀释,得到5种不同浓度样品溶液。
阳性对照溶液:另精密称定维生素C对照品2 mg于10 mL棕色容量瓶内,加水稀释至刻度,混匀,得到浓度为0.2 mg/mL的维生素C溶液。取维生素C溶液适量,逐级稀释,得到6种不同浓度维生素C溶液。
2.5.2 标准曲线绘制 分别精密量取0.2 mL不同浓度的对照品溶液于10 mL具塞试管内,迅速加入6mL孵育的FRAP试剂,于37℃下水浴放置30min,取出测定相应的吸光度值,检测波长为595 nm。以蒸馏水为空白对照。以FeSO4溶液的浓度(mmol/L)为横坐标X,吸光度为纵坐标Y(△Abs),绘制FeSO4溶液的标准曲线,进行回归分析。所得方程为Y=0.710 8X-0.007 1,相关系数r为0.999 8,线性范围为0.1~5.0 mmol/L。
2.5.3 样品测定 分别精密量取0.2 mL各浓度样品溶液及维生素C溶液于5 mL具塞试管内,按照本实验“2.5.2”项下“迅速加入6 mL孵育的FRAP试剂”依法操作,测定吸光度。FRAP值是以1mmol/L FeSO4为标准,通过FeSO4标准曲线计算,达到相同吸光度值所需FeSO4量,此值即为样品的FRAP值。以各样品溶液、维生素C溶液的FRAP值为纵坐标Y,溶液浓度(mg/mL)为横坐标X,绘制各样品总抗氧化能力图[26-29]。
3 实验结果
3.1 17 种多糖的理化性质分析 市售的17种中药多糖粉末中多糖含量、蛋白质含量如表1所示,其中多糖含量较高,蛋白质含量较少,其中党参多糖中多糖含量最高,枸杞多糖中多糖含量最低。
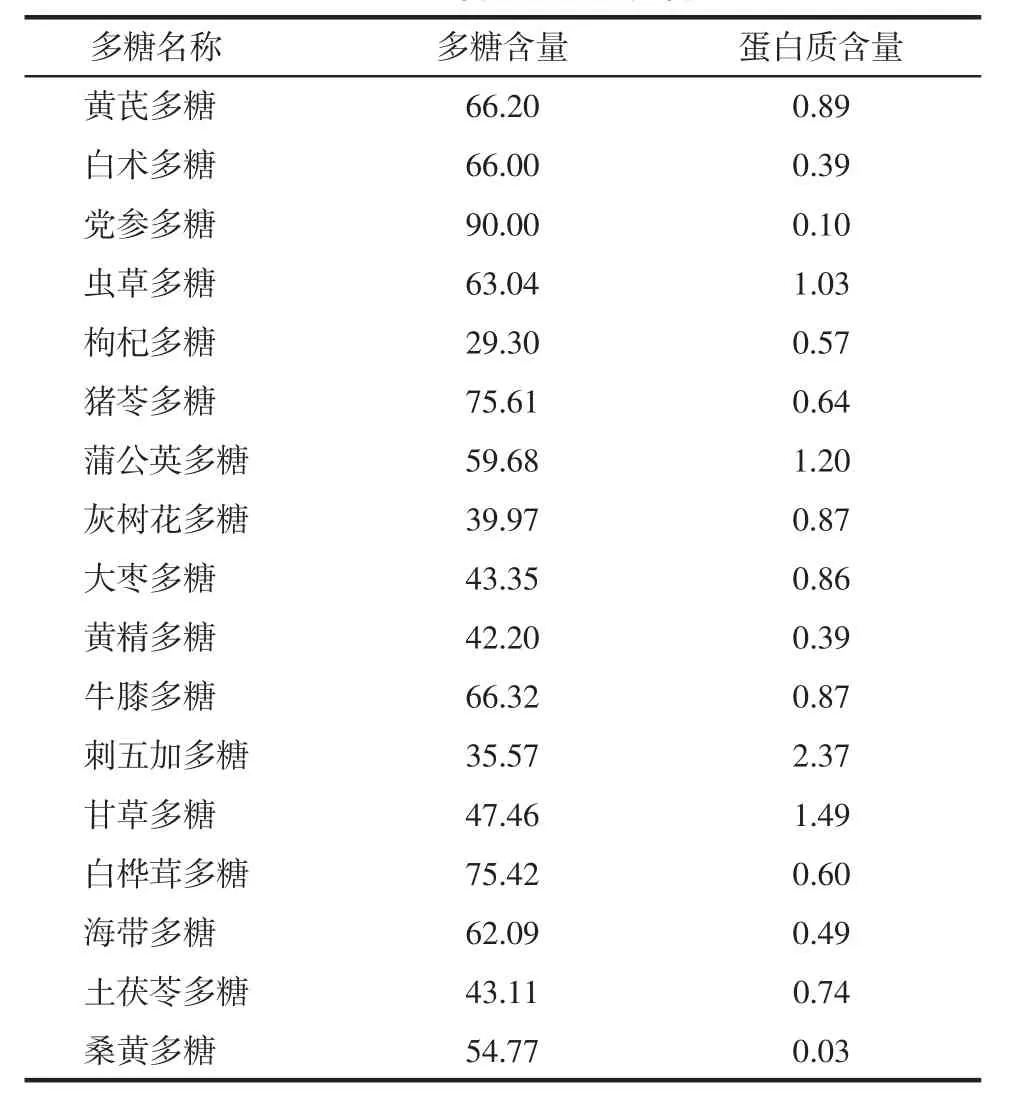
表1 17种多糖含量、蛋白质含量数据%
多糖的吸湿性测定结果如图1所示,结果表明17种多糖均具有较好的吸湿性,其中刺五加多糖的吸湿性最低,枸杞多糖的吸湿性最高。如图2所示,多糖黏度随溶液浓度升高而增强,可能是由于多糖浓度升高,多糖链之间的相互作用加强,导致多糖分子结构发生变化,从而使多糖溶液黏度变大。考察温度对多糖溶液黏度的影响,结果如图3所示,多糖黏度随温度的升高而降低,这是由于温度升高导致多糖分解,生成了小分子的糖,使自身黏度下降[30-32]。
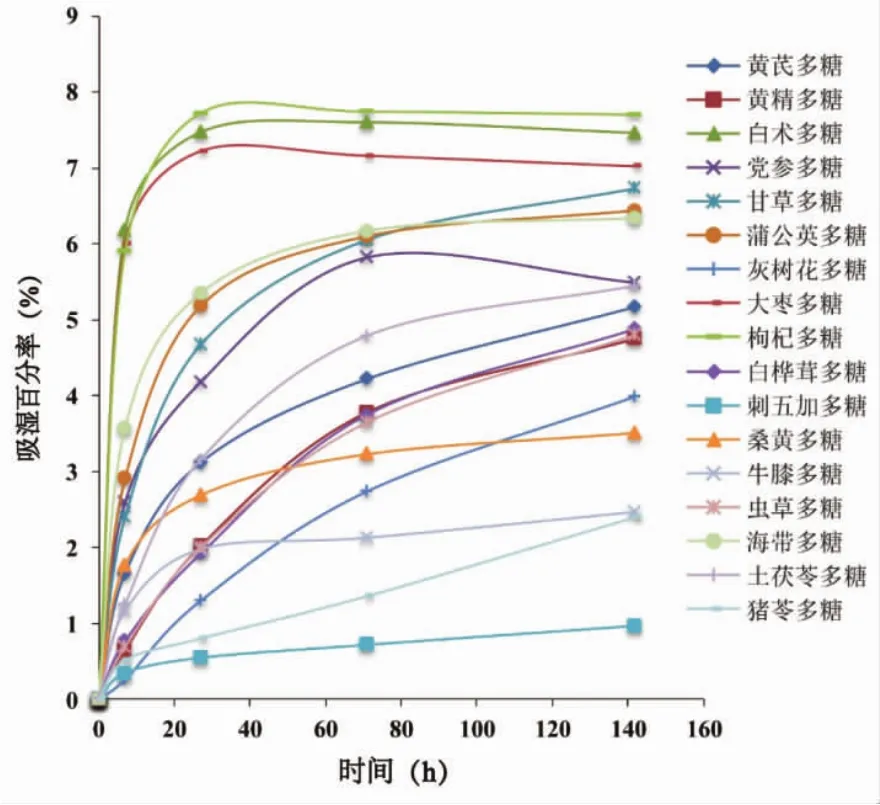
图1 多糖吸湿曲线图
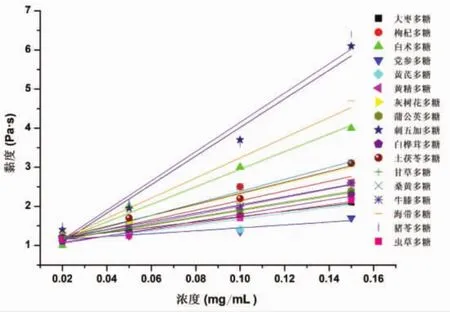
图2 多糖黏度与浓度关系图
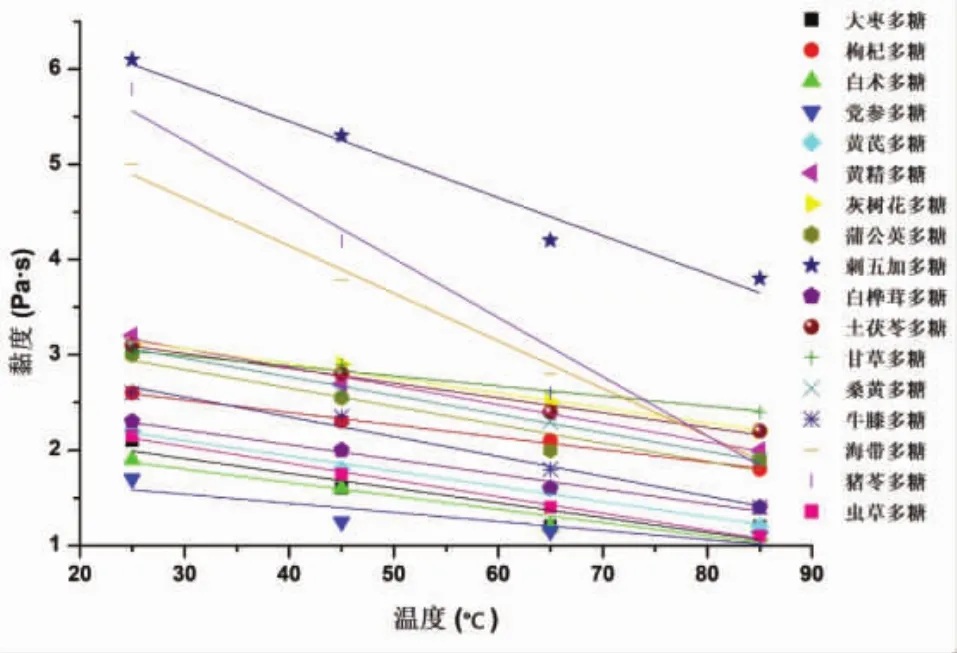
图3 多糖黏度与温度关系图
3.2 抗氧化能力测定结果 应用铁离子(Fe3+)还原法测定多糖的体外抗氧化活性,当Y值为1时所测得的X值为多糖对Fe3+还原能力浓度,可知每种多糖均具有抗氧化能力。其中刺五加多糖的抗氧化能力最强,黄精多糖抗氧化能力最弱。将17种多糖与维生素C对Fe3+还原能力的对比可知,17种中药多糖对Fe3+均具有还原能力,但其抗氧化活性低于维生素C。见表2。
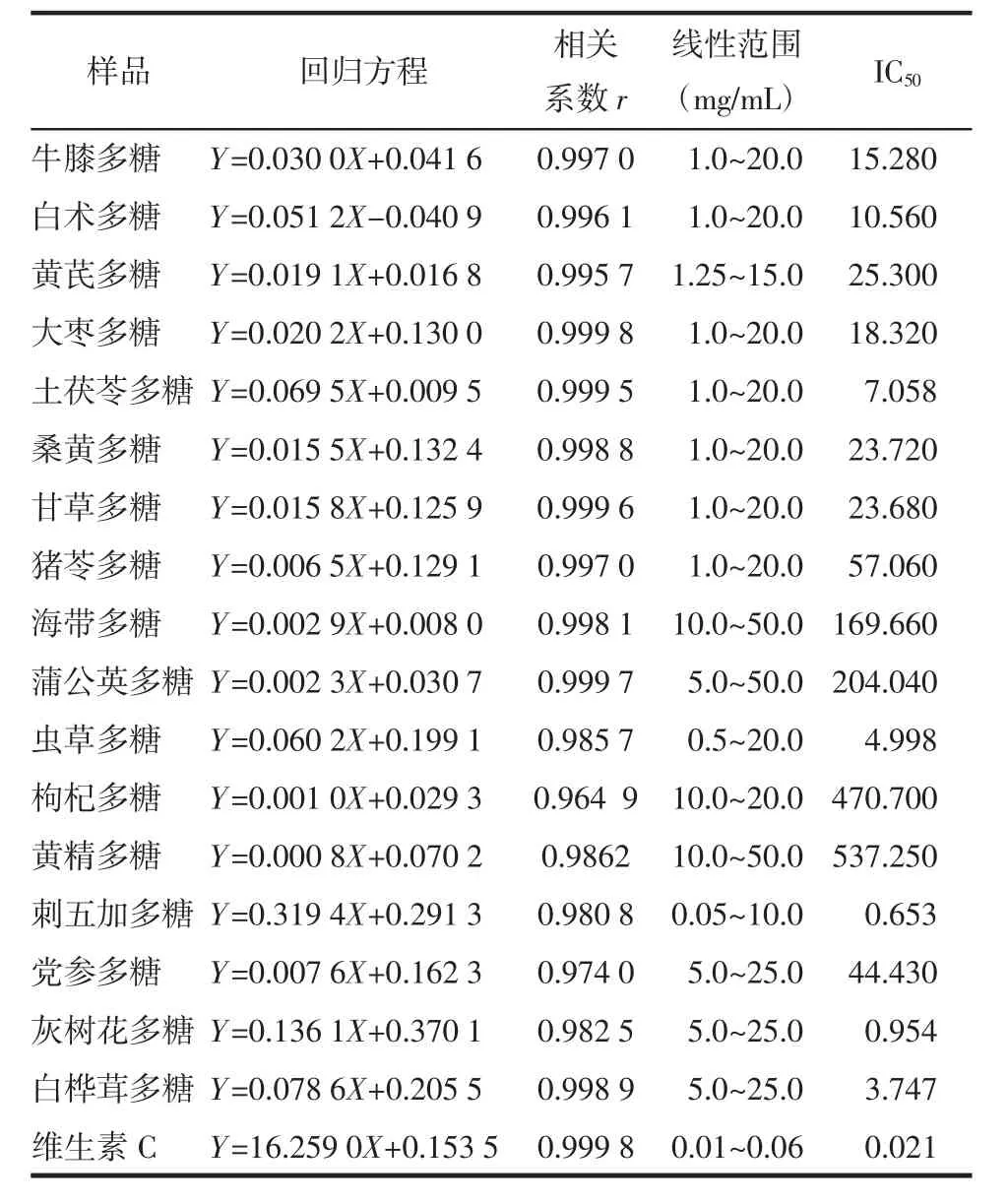
表2 17种中药多糖与维生素C的总抗氧化能力
4 讨论与结论
以往对中药有效成分的研究通常集中在小分子物质,多见生物碱、萜类、黄酮、挥发油及苷类等小分子化合物,而蛋白质、多糖、多肽等生物大分子物质相对较少。而实际上,生物大分子也是中药重要的有效成分,由于受到研究技术和方法的限制,且生物大分子本身的分离、纯化和结构测定难度较大,导致鲜有研究。
本实验首先采用苯酚-硫酸法测定17种中药多糖粉末中多糖含量,通过黏度计、紫外可见分光光度法等方法研究各多糖的黏度、吸湿性、蛋白含量等基本理化性质。研究结果表明,市售的17种中药多糖粉末中多糖含量均较高,且蛋白质含量非常低。多糖的吸湿性测定结果表明,多糖具有较好的吸湿性。多糖黏度测定结果表明,多糖黏度随溶液浓度升高而增大,可能是因为增大多糖浓度,使多糖链之间的相互作用加强,导致多糖分子结构发生变化,从而使多糖溶液黏度变大。多糖黏度随温度升高而降低,这是由于温度升高,导致多糖分解,生成了小分子的糖,使多糖结构发生了变化,从而黏度下降。应用铁离子还原法测定多糖的体外抗氧化活性,将17种多糖与维生素C对Fe3+还原能力的比较可知,17种中药多糖对Fe3+的还原能力较弱,其中刺五加多糖在17种多糖中抗氧化能力最强,但也仅为维生素C的1/43。本文总结了17种多糖的理化性质,希望可以对日后多糖的研究提供理论性支持。

