同型半胱氨酸损伤血管内皮细胞的机制研究
李健,王海峰,刘阳,罗明,谢南姿
上海市同济医院老年科,上海200065
随着社会老龄化日趋严重,越来越多的老年患者罹患心、脑血管疾病。新近的调查报告显示,我国目前有高达2.3 亿心、脑血管疾病患者,其中85%以上均是老年患者。心、脑血管病严重危害着老年人群[1]。故而明确心、脑血管病的病因并针对病因进行有效的预防是当今生物学和医学的热点之一。
目前,己成功确定了一些与心、脑血管疾病发生相关的因素,主要包括高龄、血脂异常、高血压、糖尿病、吸烟、肥胖症等。经过不懈努力,在心、脑血管疾病危险因子的干预方面取得了明显成效,但这类疾病的发病率、病死率仍居高不下,甚至有上升的趋势。
同型半胱氨酸(homocysteine,HCY)是一种含硫氨基酸,于1932年由Devgnesud 首次发现。1969年研究者发现,高同型半胱氨酸尿症,与致死性心、脑血管病有关,首次提出了高HCY 血症可能是动脉粥样硬化病的危险因素,从而确立了HCY 与心、脑血管病之间的关系[2]。近年来,大量的流行病学调查和临床试验己经证实血浆HCY 水平升高是心、脑血管缺血性疾病的一个独立的危险因素[3-6]。动物实验发现:HCY 可促进血管内皮细胞炎症反应,损伤主动脉、颈总动脉等大血管的内皮细胞、形成粥样斑块甚至附壁血栓。但是对于HCY 损伤内皮细胞的机理尚不完全清楚。
1 材料与方法
1.1 实验材料 正常人脐静脉内皮细胞株(中科院上海细胞生命科学院细胞库)、RPMI1640 培养基、胎牛血清(美国Sigma 公司)、同型半胱氨酸(美国Sigma公司)、二甲基亚砜(美国Sigma 公司)、胰蛋白酶(美国Sigma 公司)、L-谷氨酰胺(美国Sigma 公司)、EDTA(美国Sigma 公司)、青霉素、链霉素(哈药集团制药总厂)和PBS 缓冲液(美国HyClone 公司)。
1.2 实验方法
1.2.1 细胞复苏、培养及传代 取冻存于液氮中的脐静脉内皮细胞,37°C 水浴中复苏2 min,将细胞转移到含5 mL RPMI1640 培养基的离心管中,1 500 r/min 离心5 min,弃上清;用RPMI1640 培养基(100 U/mL青霉素,100 g/mL 链霉素和10% FBS) 悬浮细胞并转移到细胞培养瓶中,培养于含5% CO2的恒温培养箱中,37°C 下培养,每2 d 换液1 次,当细胞铺满瓶底后(100% confluence 用PBS 液清洗3 遍,置入1 mL 0.25%的胰蛋白酶,用倒置显微镜观察,当细胞间隙增大,细胞变圆时,立即加入含 10% FBS 的RPMI1640 培养基终止消化,用弯头吸管反复吹打,使大多数细胞脱落,形成细胞悬浮液,显微镜下对细胞进行计数,按照1∶3 进行接种传代。
1.2.2 四唑盐(MTT) 比色实验 在设定的时间点,各孔加入MTT 溶液20 L,37°C,孵育4 h,弃上清液,每孔加入150 L DMSO,振荡15 min,使结晶溶解充分,选择490 nm 波长,用酶联免疫检测仪(BioRad,USA) 测定各孔吸光值,记录结果。
1.2.3 细胞分组 将对数生长期的细胞以2.0×104/mL的密度接种在96 孔板中,每孔加100 L 细胞悬液,分为:(1)对照组,无其它处理,37 °C 下培养细胞48 h;(2)HCY 处理组,向细胞悬液中分别加入终浓度为0.1 mmol/L、0.5 mmol/L、1 mmol/L、2.5 mmol/L、5 mmol/L、10 mmol/L 和20 mmol/L 的HCY,37 °C 下培养细胞48 h;
1.2.4 VIII 因子免疫荧光染色 (1)将细胞爬片置于35 mm 或60 mm 细胞的培养皿里,PBS 洗3 遍;(2)4%多聚甲醛固定30 min,PBS 洗3 遍;(3)0.2%Triton X-100 通透15 min,PBS 洗3 遍;(4)将二抗相同宿主的血清封闭30 min,PBS 洗3 遍;(5)一抗4°C 湿盒内12 h,PBS 洗3 遍;(6)二抗室温下避光2 h,PBS 洗3 遍;(7)DAPI 染核,显微镜下拍照;(8)以蒸馏水洗净PBS,用甘油封印。
1.2.5 Western blot 参照相关文献,在各组hUVEC混悬液中加入蛋白裂解液,4°C、12 000 r/min 离心20 min,行蛋白定量,继之各取等量样本行凝胶电泳,将蛋白转移至硝酸纤维素膜上,浸于封闭液中1 h,将膜与一抗共育90 min,漂洗;再与辣根过氧化物酶标记的二抗共育45 min,加等体积增强发光化学试剂共孵1 min,暗室内将膜曝光后用相纸显影,摸索曝光时间,直至电泳带显影,采用Smartscape 生物电泳图像处理系统分析免疫复合物。
1.2.6 ELISA 检测血浆NF-κB 采用ELISA 检测血浆中NF-κB 含量。向96 微孔板中加入样品蛋白或标准蛋白100 L,室温孵育2.5 h;PBS 洗涤4 次,加入100 L 的1×检测抗体,然后室温孵育1 h;加入100 L 的1×辣根过氧化物酶标记的链霉亲和素,室温孵育45 min;洗涤4 次后加入100 L 的四甲基联苯胺底物;加入50 L 终止液,450 nm 波长下用酶联免疫检测仪测各孔光OD 值。实验重复3 次。
1.2.7 统计学分析 采用SPSS 16.0 进行统计分析。计量资料用均值±标准差(±s)表示,用t 检验法或方差分析法比较组间差异<0.05 为差异有统计学意义。
2 结果
2.1 内皮细胞鉴定 用倒置显微镜观察细胞,血管内皮细胞贴壁生长,单个细胞呈梭型、三角形等形态,细胞核圆型、胞浆透明,细胞呈铺路石样融合生长。见图1。

图1 血管内皮细胞形态特点。
2.2 HCY 诱导的血管内皮细胞损伤研究MTT 的检测结果如表1所示:在HCY 处理组,随着HCY 的浓度逐渐增加,内皮细胞的OD 值逐渐下降,在HCY 0.1 mmol/L,0.5 mmol/L,1 mmol/L 时,HCY 对OD 值的影响与对照组比较差异无统计学意义;在HCY 的浓度为2.5 mmol/L 时,OD 值较对照组差异有统计学意义(<0.05);在HCY 5 mmol/L,10 mmol/L,20 mmol/L 时 OD 值较对照组差异有统计学意义(<0.01)。见图2。
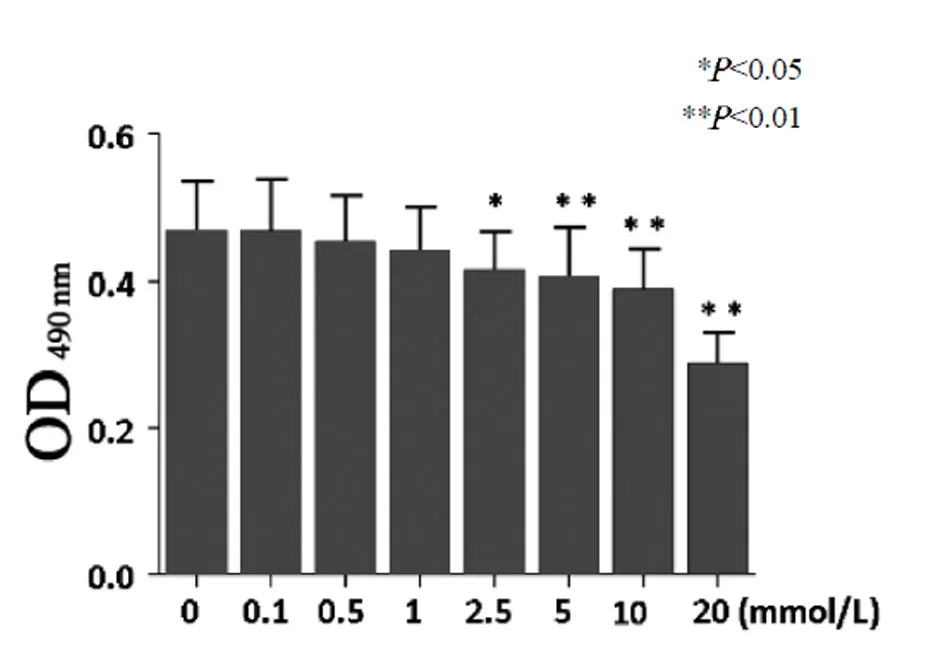
图2 不同的HCY 浓度影响血管内皮细胞的OD 值

表1 不同的HCY 浓度对血管内皮细胞存活率的影响
不同浓度的HCY 处理细胞48 h 后,对细胞进行计数分析发现,当HCY 的浓度为2.5 mmol/L 时细胞的存活率接近LD50,结合前面MTT 分析,HCY 的浓度为2.5 mmol/L 时,细胞活力下降,因此本研究HCY 的干预均采用2.5 mmol/L 的浓度。见表1。
2.3 HCY 对血管内皮细胞细胞炎症因子分泌的影响分别收集各组培养上清液并保存在-70°低温冰箱中冻存备用。IL-6 和E-选择素均采用ELISA 法测定,严格按说明书操作。
2.3.1 HCY 对人脐静脉内皮细胞分泌E-选择素的影响在H CY 为2.5 mmol/L 孵育人脐静脉内皮细胞后,内皮细胞E-选择素的分泌增加。在HCY 刺激后2 h E-选择素升高,较0 点差异有统计学意义(<0.01),HCY刺激6 h E-选择素的浓度达到峰值,随孵育时间的延长,E-选择素的分泌逐渐减少,12~24 h 后,与对照组差异仍有统计学意义,在HCY 刺激后的48 h E-选择素的水平恢复到正常。见图3。

图3 HCY 对血管内皮细胞E-选择素的影响
2.3.2 HCY 对人脐静脉内皮细胞分泌IL-6 的影响 在H CY2.5 mmol/L 干预血管内皮细胞后,细胞上清液中IL-6 的含量呈时间依赖性增加,内皮细胞IL-6 的分泌在2.5 mmol/LHCY 刺激后逐渐升高,在4 h 后较升高较0 点差异有统计学意义(<0.05),6 h 时IL-6的含量仍呈上升趋势,在HCY 刺激后12 h 后,IL-6的浓度达到峰值,较0 点差异有统计学意义(<0.01)。随后IL-6 的分泌逐渐下降,但在HCY 干预后的24 h时仍高于刺激前的基础水平 (<0.05),在48 h 时血管内皮细胞上清液中HCY的浓度降至正常水平。见图4。

图4 HCY 对血管内皮细胞IL-6 的影响
2.4 HCY 对核因子B(NF-κB)表达的影响 实验分为正常组、2.5 mmol/L HCY 干预0.5 h、1 h、2 h、4 h、6 h 组,HCY 孵育后在各个时间点提取各组总蛋白,并行Western blot,从而比较各组NF-κB 蛋白在血管内皮细胞中的表达。免疫印迹结果显示:当2.5 mmol /L 浓度的HCY 刺激血管内皮细胞后,NF-κB P65 的蛋白水平在0.5 h 即升高(<0.01),并达到高峰,随后呈逐渐下降的趋势,4 h 后基本恢复至基线水平。提示HCY 的刺激促进了NF-κB 的活化。见图5。

图5 HCY 对血管内皮细胞NF-κB 的影响
3 讨论
研究显示,高HCY 血症是心、脑血管病的一个独立危险因素。血浆HCY 升高5 mol/L,引起动脉粥样硬化的危险相当于低密度脂蛋白胆固醇增加0.52 mmol/L[7]。高HCY 血症引起心、脑血管病的机制目前尚不清楚,可能与内皮细胞毒性、平滑肌细胞增殖、促脂质过氧化和促血栓形成等相关[8-9]。
目前认为动脉硬化的发生、发展是一个慢性炎症性疾病过程。内皮细胞受损释放多种细胞因子,导致白细胞(T 淋巴细胞和单核细胞) 的趋化聚集,在动脉粥样硬化的形成、发展过程中起着重要作用[10]。动脉粥样硬化的形成、发展与粘附分子及细胞因子介导的炎症反应相关。E-选择素于活化的内皮细胞表面表达,介导白细胞与内皮细胞的粘附[11]。IL-6 可诱导产生急性期蛋白,使淋巴细胞激活,从而促进平滑肌细胞增殖和血小板释放。有研究发现,E-选择素及IL-6 mRNA 在动脉粥样斑块中有表达[12],冠心病患者血浆E-选择素、IL-6 的水平升高,IL-6、E-选择素可作为炎症反应的标志物。
本实验发现在人脐静脉内皮细胞中,HCY (2.5 mmol/L)能诱导E-选择素、IL-6 等细胞因子的合成和分泌增加,以上二个炎症相关因子分别在6 h、12 h 达分泌高峰,维持升高状态超过24 h,48 h 才逐渐恢复至基础水平。细胞培养时HCY 的刺激是一过性的,但是在人体,如果存在持续性的HCY 升高的刺激,其诱导全身血管内皮细胞E-选择素、IL-6 的分泌可能呈持续高水平,这无疑会加速血管内皮细胞损伤,促进白细胞粘附于血管内皮,进而促使动脉硬化的发生、发展。提示高HCY 具有潜在的促血管壁炎症激活作用,这可能是HCY 诱导动脉粥样硬化发生发展的重要机制之一[13-14]。
本实验在体外培养的细胞模型水平,证实HCY能诱导细胞因子E-选择素、IL-6 的合成和分泌增加,同时促进核因子kappaB(nuclear factor-κB,NF-κB)P65 表达上调,提示HCY 引起血管内皮细胞炎症因子释放显著增多可能与激活NF-κB 信号通路有关。炎症因子的刺激在动脉粥样硬化的发生、发展过程中起重要作用。NF-κB 是产生炎症因子的关键转录因子。在动脉粥样硬化斑块中可检测到活化的NF-κB[15]。NFB 是Rel 蛋白家族成员,激活血管平滑肌细胞NFB 后,血管平滑肌细胞、内皮细胞表达炎症因子、粘附分子、生长因子,单核细胞、内皮细胞在粘附分子介导下发生粘附和迁移内皮下,导致血管壁慢性炎症反应、平滑肌细胞增殖及向内膜移行,形成动脉粥样硬化[16-17]。因此,HCY 促进动脉粥样硬化形成可能与通过激活NF-κB 信号通路,促进血管内皮细胞炎症因子释放,加速血管内皮损伤有关。老年患者由于代谢率低,血浆中HCY 水平升高,对血管内皮的损伤更为明显。
总之,HCY 可导致血管内皮细胞中炎症因子的释放与表达,这些生物学过程是通过NF-κB 信号通路来实现的。如何干预这一信号通路,减少炎症因子释放,从而减轻血管内皮细胞的损伤,对于伴有高HCY血症的心、脑血管疾病患者、其中更多数是老年患者的防治有重要的科学价值。

