老年病毒性肺炎患者的麻醉考量
唐俊
复旦大学附属上海市第五人民医院麻醉科,上海200240
麻醉医师掌握着各种极端病理生理状况的理论知识和应对危机的处理技能。如果老年病毒性肺炎患者感染未经控制而必须手术的话,麻醉医师及相关医务工作者所具备的基础知识的重点有哪些?需要如何做好个人防护呢?
1 病毒性肺炎的评估
1.1 病毒性肺炎的基本特征 病毒性肺炎是经上呼吸道病毒感染,继而向下蔓延引发肺部炎症,导致肺换气功能障碍的疾病。病毒种类繁多,但真正造成严重肺炎的非常少,例如人感染的高致病性禽流感、腺病毒肺炎、新型冠状病毒肺炎等。一般而言,病毒性肺炎侵犯肺泡和间质为主,临床和检查呈弥散性;而细菌性肺炎则以支气管为主,表现多为局灶性。相较于细菌性肺炎,病毒性肺炎更易发生在老年、有合并症等免疫力相对较低的人群,且起病更急症状更重。
1.2 术前评估 病毒性肺炎本身需要手术者甚少(例如肺移植),但是当出现一些特殊情况需要手术时,需要考虑以下几个方面:(1)肺部的情况;(2)全身状况;(3)手术的类型和紧迫性。手术前,手术医师应事先告知相关感染状况,与包括麻醉医师在内的手术团队充分沟通,确保所有环节安全有序,尽可能减少传播和职业暴露风险,提高手术安全性。
围术期的肺功能评价基于氧合、二氧化碳排除、健全的自我保护机制,以及足够的储备和代偿能力。病毒造成的肺功能损害更类似于急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),而非慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD),因此判断病毒性肺炎的严重程度更依赖于临床表现和血气分析等。近年来,肺部超声对肺炎的诊断价值逐渐得到认识,结合临床资料可作为COVID-19 肺炎的有效辅助诊断工具,与CT 有良好的相关性[1]。超声将给老年人或不能转运行放射诊断的患者评估肺部状况带来便利。在对已出院的COVID-19 患者肺功能的研究发现,感染治愈后,肺功能损害可能会持续,以弥散能力和限制性通气障碍为最常见,且与疾病的严重程度有关,因此有相关病史的患者术前也需要认真评估肺功能[2]。
老年人免疫机能增龄性下降,常有多种合并症,致使术前评估较为复杂[3],需要考虑患者的基础疾病以及病毒对机体的影响。COVID-19 期间心脏可能出现广泛的损伤,从亚临床心肌损伤到明确的心肌炎、心肌梗死、肺栓塞和心力衰竭都有可能,及时的影像学和实验室检查可以为判断疾病的严重程度提供有效的参考[4]。病毒性肺炎对机体有可能引起严重的全身炎性反应综合征(systemic inflammatory response syndrome,SIRS),比如COVID-19 的感染后期。其造成的出凝血失衡和内环境紊乱,对全身各个组织器官都将造成严重的损害,对此应进行全面的评估。
2 病毒性肺炎的传播与防护
病原体传播有三个要素:传染源、传播途径和易感人群。根据防护对象可将防护措施分为主动防护与被动防护:主动防护是针对传染源的防护,最大限度减少环境中的病原体含量。被动防护是存在或可能存在病原体的环境下针对易感人群所采取的防护措施,比如医护人员等的防护。实际工作中两种防护措施是互为补充的。
所有的防护都是一个系统工程,需要从制度、流程、培训,以及环境、装备等多个环节进行综合考虑[5]。任何情况下都要做好标准防护,哪怕是基本防护也可以使传播几率大为降低。
(1)整体防护:防护工作是一种集体行为,人人有责,任何一个人的工作失当,比如一只污染的手套抑或一枚未按照要求放置的针等都可能造成短板效应,使防护工作功亏一篑。
(2)过程防护:防护贯穿于整个工作的过程之中,从对患者的术前访视了解患者的病史,到手术麻醉过程中的防护,一直到手术结束后医疗废物的处理,任何一个环节都存在职业暴露的可能。有研究发现,脱卸防护用品过程实际上可能是发生职业暴露最危险的时刻。
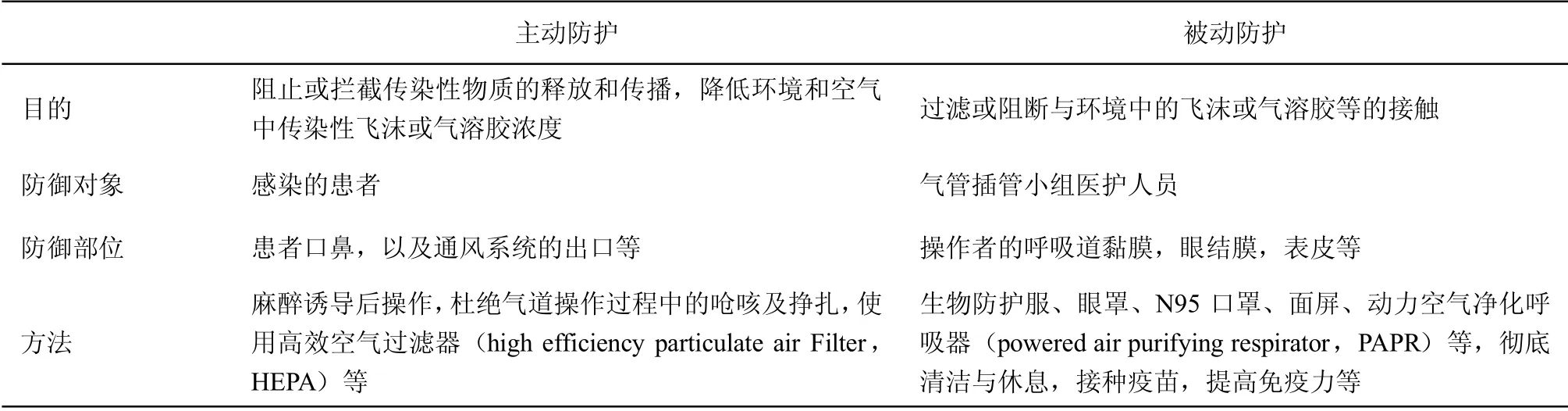
表1 气管插管中的主动防护和被动防护
(3)双向防护:也就是医患间都可能发生交叉感染,患者是可能的传染源,但同时也是易感人群,工作人员的身体健康和正确操作也是保护患者的重要一环。
个人防护设备(personal protective equipment,PPE)一般分为标准防护和特殊防护。前者是所有患者和场所都适用的最基本的防护措施,具有普遍性和强制性;后者是根据操作可能接触的传染性物质或污染物的危险性及传播特性而采取的针对特定传播途径的防护措施。例如麻醉医师进行气管插管等操作,直接面对患者呼吸道,属于高危操作,应采取高级别的特殊防护措施。值得注意的是,目前已发现因输注单采血小板而被感染的COVID-19 病例,提示潜在血行传播的可能,对血液制品的安全以及血液体液的暴露也应注意加以防范[5]。
环保工程管理体系的完善程度有待提高,主要体现在:(1)一些能源企业过于注重自身经济效益的提升,没有在施工过程中对环境和水资源等因素给予高度重视,出现了严重的破坏现象,而这些企业的环境保护意识比较薄弱化;(2)一般来说,对于购进净水设备和其他环保器材来说,其成本比较高,而一些能源企业在资金的影响下,很难顺利购置环保系统设备[1],导致环境污染现象的出现;(3)在我国,环保志愿者并不多,参与环保组织力度不足,进而加剧了环境污染程序,不利于环保工程质量的提升。
3 病毒性肺炎的围术期关注点
3.1 麻醉方式 对于病毒性肺炎患者,气道干预和机械通气是病毒防护和疾病治疗的一部分。首选全身麻醉,优点包括:(1)麻醉呼吸回路可避免呼吸道暴露,减少气溶胶产生,降低主动传播风险;(2)镇静和肌肉松弛下的控制呼吸,可减少患者呼吸作功;(3)可同时予以呼吸治疗改善氧合等[6]。
对肺功能差的患者,尤其老年人,倾向局部麻醉(包括椎管内麻醉、神经阻滞等),其对于呼吸功能的影响相对较小。硬膜外麻醉和镇痛可以为手术提供充分的条件,减少术后肺部并发症,改善术后结局,但是需要注意阻滞平面的控制,防止对呼吸运动的影响。
总之,应当保证患者能够耐受和配合操作,尽可能减小手术和麻醉对呼吸的影响,维持好自主呼吸。所有局部麻醉都无法完全控制患者呼吸道,不可避免病毒气溶胶的排放。如果患者可以耐受的话,戴外科口罩或者不带呼吸阀的N95 口罩可以减少病毒的排放[7]。
3.2 气道管理 高流量鼻导管氧疗(high flow nasal cannula)或无创正压通气(noninvasive positive pressure ventilation)可用于轻中度ARDS 患者,却可能造成气溶胶产生和播散,对手术室的通气方式(负压)和医疗人员有较高的防护要求。当患者在接受标准氧疗后呼吸窘迫和/或低氧血症不能缓解,且在接受高流量鼻导管吸氧或无创正压通气2h 后病情没有改善(表现为呼吸窘迫,呼吸频率>30 次/min,氧合指数<150 mm Hg),以及出现呼吸循环情况不稳定、多器官衰竭或者出现精神障碍时,应及时进行气管插管支持治疗[8]。
气管插管操作中,快速序贯诱导和肌松药的使用可防止呛咳等引起的气溶胶播散;视频喉镜在提高插管成功率的同时,也可使操作者尽可能地远离患者口鼻部;回路内合理使用人工鼻湿热交换器/过滤器(heat and moisture exchanger/filter,HMEF),包括单肺通气时的开放侧。与插管过程相似,拔管流程也应设法防止呛咳,应尽可能在患者情况稳定后在手术室内完成,拔管时可用双层湿纱布掩盖患者口鼻,最大程度减少分泌物飞溅。
3.3 术中管理 虽然各种病毒性肺炎有各自的特点,例如COVID-19 有严重炎症反应和肺微血栓,但引起的ARDS 在治疗上相似,可采用成熟的呼吸支持治疗方法[9]。因此,麻醉与治疗过程中的机械通气策略也遵从肺保护性通气策略(lung-protective ventilation strategies,LPVS),即小潮气量、低吸气压和个性化的呼气末正压(positive end-expiratory pressure,PEEP)。虽然现代麻醉机的机械通气功能越来越接近呼吸机,且在疫情大流行期间麻醉机可作为备用呼吸机,但其结构还是有别于呼吸机,小潮气量的使用应根据HMEF死腔和阻力,回路顺应性(大多数现代麻醉机可以自检测定)等问题进行相应调整,并依据相关代谢性酸中毒程度和血流动力学稳定性来评估允许性高碳酸血症(permissive hypercapnia)的容忍度。需要注意的是,过高的PEEP 并不带来益处,反而可能增加病死率,因此PEEP 的确定应根据不同患者进行滴定。虽然神经肌肉阻滞可以为操作和PEEP 治疗带来便利,但是最近的一项多中心随机试验发现,在早期中重度ARDS 的治疗过程中使用神经肌肉阻滞对降低死亡率没有益处,且对心血管事件的影响较大。
此外,COVID-19 感染具有炎症反应失调与内皮血栓形成的特点,相关的抗炎和抗血栓治疗对预后有着重要的影响。
关于糖皮质激素的运用,存在一定的争议,研究认为,中度至重度的COVID-19 肺炎患者在病程相对较晚时,可能受益于中等剂量的糖皮质激素治疗。
3.4 转运管理 整个手术麻醉过程都应在手术室而不是麻醉准备室和恢复室内完成,以减少不必要的停留场所和途经通道。转运过程、路径选择、人员准备和PPE 使用、患者保护和保护罩运用、转运后的通道清洁都应有统一规划[7]。在转运中,无论患者是否插管都应穿戴全套防护,人员各司其职,麻醉医师携带呼吸支持和监护设备,随时准备呼吸支持。转运中应使用一次性大单覆盖患者全身,头面部予以支撑留出适度呼吸空间,有条件者使用专用转运推车。
病毒性肺炎的治疗以支持疗法和积极治疗基础疾病为主,应积极处理合并症,减少并及时纠治并发症,为后期的康复创造条件。
麻醉医师在急危重症救治中发挥着重要作用,同时对医院感染和职业防护也必须有科学的认识。

