基于分子对接和网络药理学探讨消栓肠溶胶囊改善血管内皮功能的作用机制
聂玉婷,温璐璐,司童,刘瑶,高利,曲淼
血管内皮细胞具有分泌、代谢等生理功能,可调节机体的免疫反应和血流动力学等生理功能[1]。血管内皮损伤是心脑血管病变的重要病理基础之一,内皮细胞功能失调直接参与高血压、动脉粥样硬化、血栓形成等病理过程[2-3]。消栓肠溶胶囊的药物组成源于补阳还五汤,补阳还五汤具有益气活血的功效,是卒中恢复期常用的中医方剂。已有研究证明补阳还五汤可以增加脑缺血后血管内皮生长因子和整合素αvβ3的表达,促进血管新生,改善神经功能[4]。还有研究显示补阳还五汤可促进人脑微血管内皮细胞的增殖和迁移,促血管生成[5]。动物实验提示补阳还五汤可通过磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/Akt信号通路上调血管内皮细胞生长因子受体2的磷酸化,促进脑出血小鼠的血管生成[6]。目前,消栓肠溶胶囊改善血管内皮功能的机制还不明确。本研究使用分子对接和网络药理学方法,探讨消栓肠溶胶囊改善血管内皮功能的可能机制,为基础和临床研究提供参考。
1 研究方法
1.1 药物化合物的筛选 本研究通过中药系统药理学数据库与分析平台(traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP)(http://tcmspw.com/tcmsp.php),以消栓肠溶胶囊的中药组成“赤芍”“黄芪”“桃仁”“当归”“红花”“川芎”为关键词搜索,设定条件为口服生物利用度(oral bioavailability,OB)≥30%,类药性(druglikeness,DL)≥0.18,分别筛选出符合条件的化合物及相应靶点。消栓肠溶胶囊的一个中药成分“地龙”在TCMSP中没有信息,在TCMid数据库、中药分子机制的生物信息学分析工具(bioinformatics analysis tool for molecular mechanism of traditional Chinese medicine,BATman)数据库、中医百科全书(encyclopedia of traditional Chinese medicine,ETCM)数据库中收集地龙化合物信息,配合文献检索补充化合物信息,再将化合物放入TCMSP平台搜索,删除OB、DL不合格的化合物,删除在TCMSP、天然产物活性和物种来源数据库(natural product activity and species source database,NPASS)和Symap数据库中找不到靶点的化合物,删除重复化合物。通过通用蛋白资源(universal protein resource,UniProt)数据库(https://www.uniprot.org)对靶点进行注释。
1.2 疾病靶点筛选 以“endothelial dysfunction”“vascular endothelial disorder”“vascular endothelial function”为关键词,在Genecards数据库(https://www.genecards.org)、在线人类孟德尔遗传(online Mendelian inheritance in man,OMIM)数据库(https://omim.org)进行检索,相关性得分设置为≥6,去除重复靶点,筛选血管内皮功能障碍的靶点。将赤芍、黄芪、桃仁、当归、红花、川芎、地龙与血管内皮功能障碍靶点基因取交集,得到药物与血管内皮功能障碍的共同靶点基因。
1.3 药物-血管内皮功能障碍靶点相互作用网络和蛋白互作网络构建 使用Cytoscape 3.8.0软件对药物和血管内皮功能障碍靶点进行可视化处理,构建“药物-关键化学成分-血管内皮功能障碍-靶蛋白”网络关系图。将药物与血管内皮功能障碍共同靶点导入STRING数据库中,设定物种为人类,取中度交互值为0.9,获取药物对血管内皮功能障碍的潜在治疗靶点的蛋白互作(protein-protein interaction,PPI)网络。将PPI结果通过Cytoscape 3.8.0软件进行可视化分析,获取度值、介度中心性值和紧密中心性值,构建药物对血管内皮功能障碍潜在治疗靶点PPI网络。
1.4 富集分析 利用R语言分析软件对筛选得到的药物-血管内皮功能障碍共有的靶点基因进行基因本体(gene ontology,GO)功能富集分析及京都基因和基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析,然后通过绘图软件Origin作图。
1.5 核心活性成分-靶点分子对接验证 通过分子对接探究天然产物与各靶点的结合方式,这些靶标受体全部从蛋白数据库(protein data bank,PDB)(https://www.rcsb.org/;PDB ID:4XZY、5LCY、1JNM)中下载获得。用于分子对接的小分子从pubchem数据库下载获得。本研究采用AutoDock Vina 1.1.2软件进行分子对接工作,在对接开始之前,使用PyMol 2.5对所有受体蛋白进行处理,包括去除水分子、盐离子以及小分子。并使用PyMol插件center_of_mass.py定义对接盒子的中心,对接盒子的边长统一定义为22.5。此外,使用ADFRsuite 1.0将所有处理好后的小分子以及受体蛋白转换为AutoDock Vina 1.1.2对接必须的PDBQT格式。对接时,使用默认对接参数进行对接。输出的得分最高的对接构象为结合构象,最后使用PyMol 2.5对对接结果进行可视化分析。
2 结果
2.1 药物关键化学成分的筛选 在TCMSP数据库搜索药物的化学成分,共得到66个化合物和218个靶点,其中川芎关键化合物4个,当归关键化合物2个,赤芍关键化合物7个,红花关键化合物15个,地龙关键化合物1个,黄芪关键化合物12个,桃仁关键化合物17个,共有化合物8个。
2.2 药物-疾病靶点 去除重复靶点后,筛选得到血管内皮功能障碍的3120个蛋白靶点基因,将药物靶点与疾病靶点取交集,得到药物与血管内皮功能障碍共同靶点基因159个(图1)。主要共同靶点基因有PGR、NR3C2、PTGS1、PTGS2、NOS2、ESR1、AR、SCN5A、PPARG、F7、KDR、RXRA、ADRB2、ESR2、DPP4、MAPK14、GSK3B、CDK2、CCNA2、NR3C1、DRD1、CHRM3、CHRM1、ADRA1A、ADRA1B、SLC6A4、OPRM1、GABRA1、BCL2、BAX、CASP9、JUN、CASP3、CASP8、PRKCA、PON1、MAP2、ADH1C、ADRA2A、SLC6A2等。
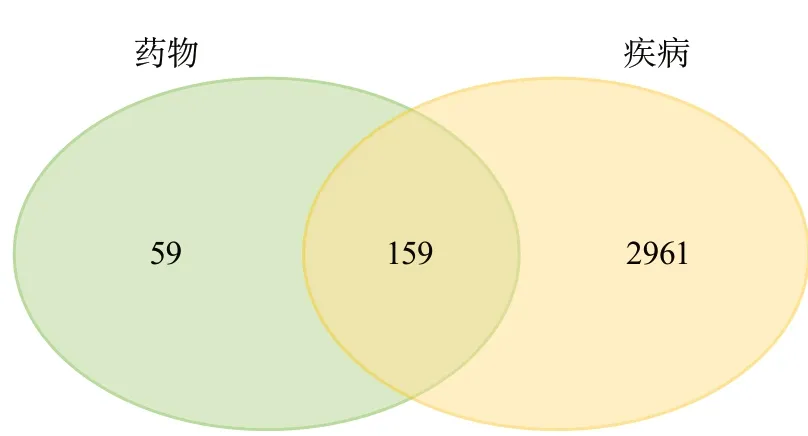
图1 药物作用靶点与血管内皮功能障碍靶点交集韦恩图
2.3 “药物-关键化学成分-血管内皮功能障碍-靶蛋白”网络构建 使用Cytoscape 3.8.0构建“药物-关键化学成分-血管内皮功能障碍-靶蛋白”可视化网络图。在该网络中,共包含221个节点,585条边,56个化合物节点,6个药物节点,159个药物治疗血管内皮功能障碍的潜在靶点(图2)。根据度值筛选,确定槲皮苷、木樨草素、山柰酚、7-O-甲基异微凸剑叶莎醇、β-谷甾醇、黄芩素、芒柄花黄素、异鼠李素、豆甾醇、β-胡萝卜素等为消栓肠溶胶囊治疗血管内皮功能障碍的主要有效成分(表1)。
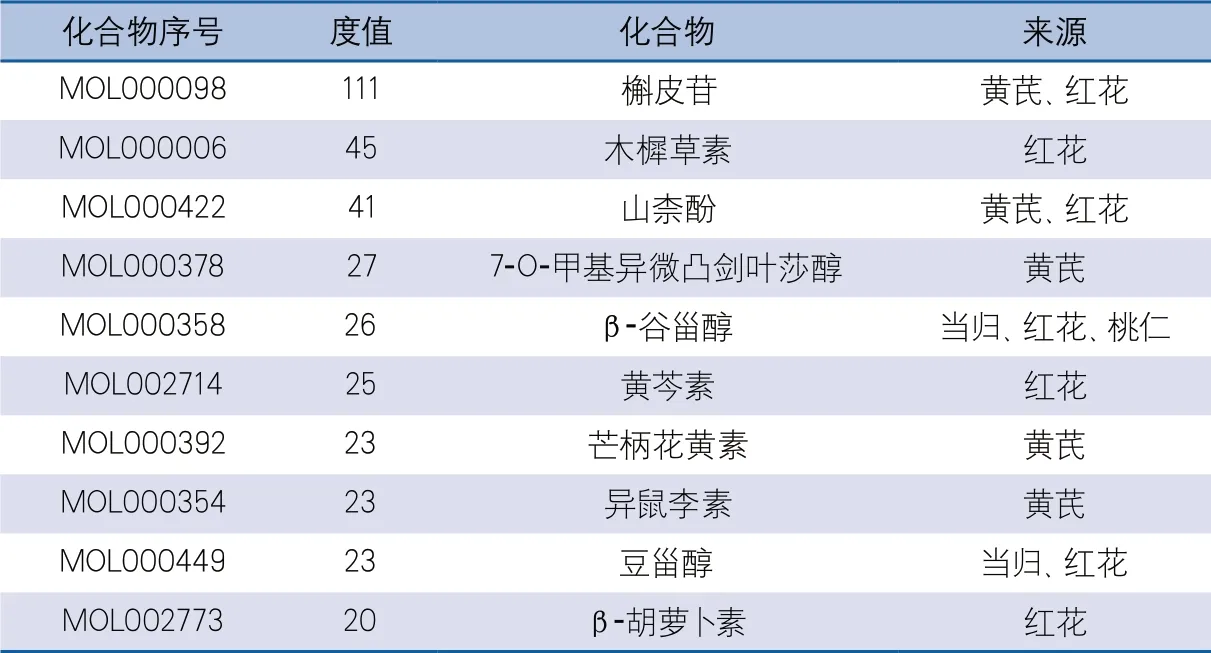
表1 药物化合物度值与来源

图2 化合物-血管内皮功能障碍靶点相互网络作用图
2.4 蛋白互作网络关系分析 将药物-血管内皮功能障碍共同的159个靶点基因导入STRING数据库平台,研究物种选择人类,获取蛋白质相互作用关系,筛选评分>0.9的蛋白关系,将蛋白互作结果通过Cytoscape 3.8.0软件进行网络拓扑结构分析,形成药物潜在作用靶点蛋白互作网络图(图3)。该网络包括42个节点,243条边。平均度值是11.57,超过平均度值的靶点蛋白有17个(表2),度值排名前5的靶点分别为TP53、MAPK1、JUN、Akt1和MAPK8。这5个关键靶点可能在药物治疗血管内皮功能障碍过程中发挥重要作用,涉及的信号途径包括血管生成、炎症、细胞凋亡等。
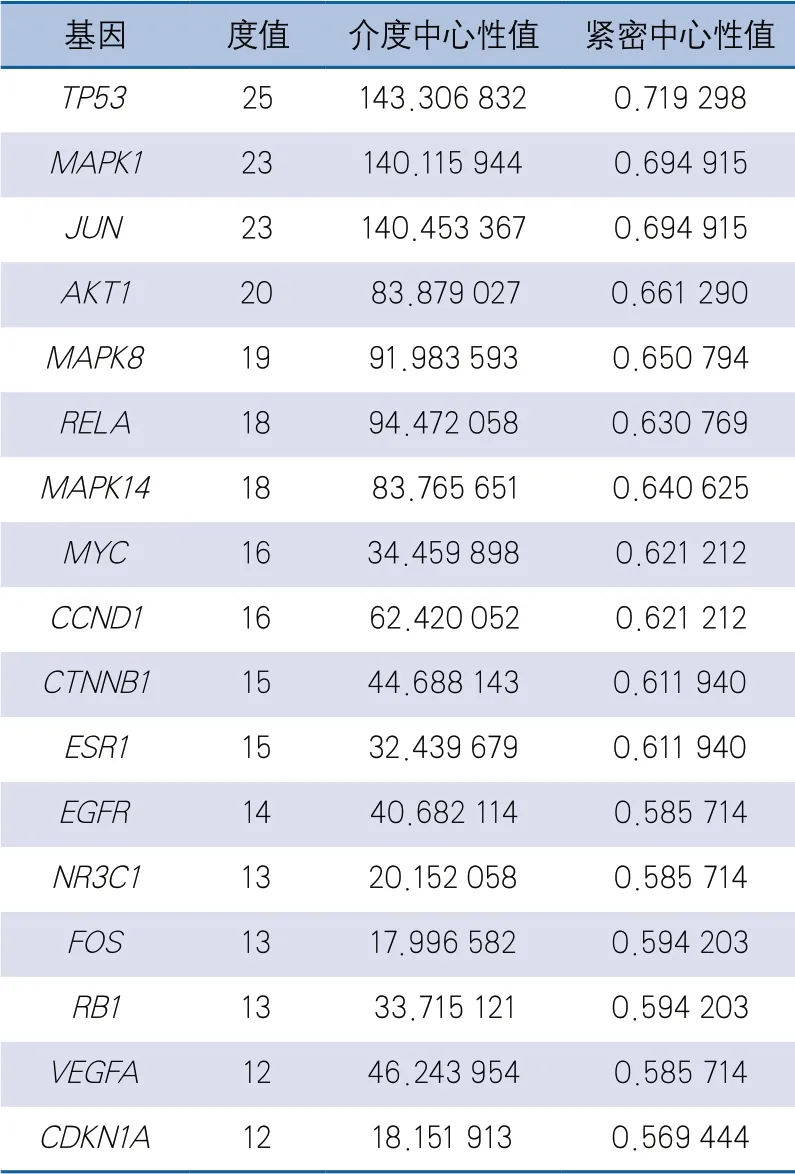
表2 药物潜在作用靶点拓扑属性表
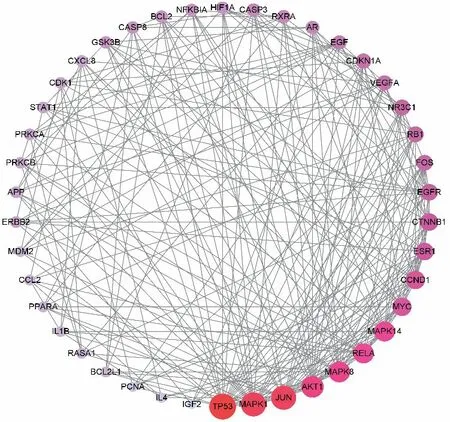
图3 药物潜在作用靶点蛋白互作网络图
2.5 富集分析
2.5.1 GO富集分析 GO富集分析共获得 2700条GO生物学过程,从生物过程(biological processes,BP)、分子功能(cellular components,CC)、细胞成分(molecular functions,MF)3个水平对关键靶点进行分析,取P<0.05,以该生物功能富集到的基因数排序,前5条富集结果见图4。获得BP相关的条目主要涉及细胞对化学应激的反应、对氧化应激的反应、细胞对氧化应激的反应、对脂多糖的反应、对活性氧的反应等;CC相关的条目主要涉及膜筏、膜微结构域、膜区等;MF相关的条目主要涉及DNA结合转录因子结合、RNA聚合酶Ⅱ-特异性DNA结合转录因子结合、核受体活性等。
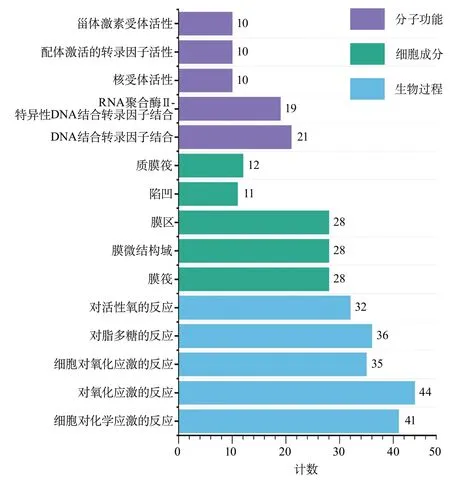
图4 药物潜在作用靶点Go富集分析结果
2.5.2 KEGG通路富集分析 KEGG通路富集分析结果显示,消栓肠溶胶囊改善血管内皮细胞功能的关键基因靶点主要富集的通路有168条,其中与血管内皮细胞功能密切相关的信号通路有PI3K/Akt、流体剪切应力和动脉粥样硬化、糖尿病并发症晚期糖基化终末产物(advanced glycation end product,AGE)与其受体(receptor for AGE,RAGE)信号通路、IL-17信号通路、TNF-α信号通路、凋亡、Th17细胞分化、TP53信号通路等(图5)。
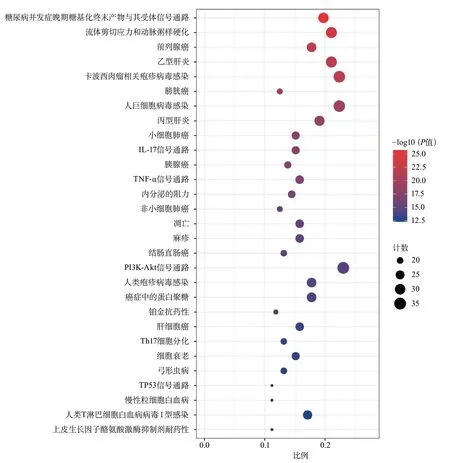
图5 药物潜在作用靶点京都基因和基因组百科全书通路富集分析结果
2.6 消栓肠溶胶囊改善血管内皮功能活性成分与关键靶点的分子对接预测 网络药理学预测关键靶点为TP53、JUN、MAPK1,使用AutoDock Vina软件对关键靶点与对应化合物进行对接。一般认为配体与受体分子构象越稳定,能量越低,发生作用的可能性越大。以结合能≤-20.9 kJ/mol为筛选标准,分子对接结果显示MAPK1与山柰酚、木樨草素、槲皮苷具有最好结合力(表3),使用PyMoL作图,结果见图6。
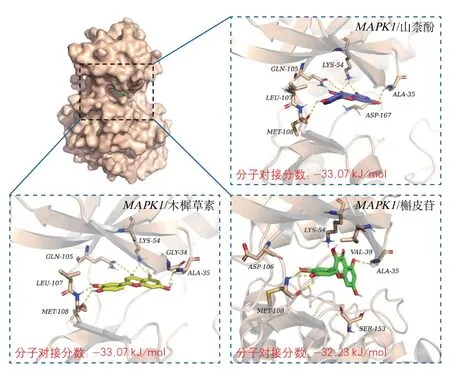
图6 分子对接图

表3 有效化合物与作用靶蛋白的结合分数表
3 讨论
综合分析本研究中关键靶点、KEGG和GO富集结果,消栓肠溶胶囊可能通过作用于TP53、JUN、MAPK1、AKT1、MAPK8等关键靶点,调控PI3K/Akt信号通路、流体剪切应力和动脉粥样硬化、AGE/RAGE信号通路、IL-17信号通路、TNF-α信号通路、凋亡信号通路、Th17细胞分化、TP53信号通路等,通过调节血流动力、抗凋亡、抗炎、保护血管及促进血管新生等机制,发挥改善血管内皮功能的作用。
凋亡是血管内皮细胞的死亡形式之一,TP53参与缺血再灌注后血管内皮细胞凋亡机制的调节[7]。张建初等[8]发现在血管紧张素Ⅱ诱导的血管内皮细胞凋亡中,TP53基因的表达明显增多,认为TP53基因参与了血管紧张素Ⅱ诱导内皮细胞凋亡的调节。JUN参与血管内皮细胞生长因子的合成,是血管内皮细胞生成反应的关键调节因子之一,而且在血管内皮细胞凋亡过程中发挥作用[9-10]。Akt是一种多功能的丝氨酸-苏氨酸蛋白激酶,Akt1能影响细胞迁移和一氧化氮合成,在血管内皮生长因子介导的血管生成中起到关键作用[11]。另外,Akt1能调节血管通透性、血管生成反应和血管成熟的过程[12]。动物实验表明,补阳还五汤能增加缺血脑内Akt1 mRNA的表达水平,减轻脑缺血后的脑组织损伤[13]。
流体剪切力在调节血管内皮细胞功能中有重要作用,研究表明,流体剪切力可上调血管紧张素转换酶2,抑制内皮细胞增殖和炎症反应,并促进一氧化氮的产生[14]。高剪切力能降低内皮细胞的动脉粥样硬化程度,促进血管生成[15];低切应力可促进氧化应激反应,加重血管内皮功能损伤[16]。
AGE可导致血管内皮细胞功能障碍,有研究证明AGE可通过AGE/RAGE信号通路、p38-MAPK受体信号通路等诱导血管平滑肌细胞钙化[17]。何林全等[18]在动物实验中证明加味补阳还五颗粒可通过调控高迁移率族蛋白B1/RAGE信号通路发挥脑保护作用。
血管内皮细胞凋亡与内质网应激密切相关,研究表明PI3K/Akt通路对内质网应激细胞有保护作用[19]。PI3K/Akt通路还可影响血管内皮细胞迁移,抑制PI3K/Akt信号通路,从而抑制肿瘤血管内皮细胞的定向迁移[20]。另外,Kawasaki等[21]的研究也证明PI3K/Akt信号通路有促进血管内皮细胞迁移及产生新生血管的作用。动物实验中显示,补阳还五汤可通过PI3K/Akt通路激活血管内皮细胞生长因子受体-2在脑出血诱导的血管生成中起到关键作用[6]。
血管内皮细胞损伤后释放大量细胞因子和炎症介质参与全身的炎症反应。Th17是CD4+T细胞亚群之一,分泌IL-17,在促进动脉粥样硬化斑块侵蚀或破裂过程中起着重要作用[22-23]。TNF-α等细胞因子的异常可使机体产生慢性低度炎症状态,导致血管内皮细胞功能障碍[24]。吴旋等[25]等的研究证明补阳还五汤可下调脑缺血大鼠TNF-α等炎症因子的水平,减轻脑缺血后的炎症反应。
综上所述,消栓肠溶胶囊具有多成分、多靶点的特点,从单一的通路或靶点难以阐明其改善血管内皮功能的作用机制。本研究运用网络药理学技术,系统地阐述了消栓肠溶改善血管内皮功能的活性成分及其可能作用机制,希望为消栓肠溶胶囊的临床运用提供理论支撑。
【点睛】本研究通过TCMSP等中药数据库,GeneCards、OMIM等生物信息数据库,基于分子对接和网络药理学分析了消栓肠溶胶囊改善血管内皮细胞功能的可能靶点及可能机制,有助于后续针对消栓肠溶胶囊的基础研究和临床应用。

