不饱和脂肪酸水平与不同性别血脂异常冠心病患者的关系
章海燕 张祖宏
(南京医科大学第二附属医院心血管内科,江苏 南京 210000)
心血管疾病,特别是冠状动脉粥样硬化发生发展的一个重要因素就是血脂异常[1]。既往研究中认为低密度脂蛋白胆固醇(LDL-C)水平与动脉粥样硬化性心血管疾病(atherosclerosis cardiovascular disease,ASCVD)之间关系密切[2]。而最新的大规模人群研究发现,三酰甘油(triglyceride,TG)水平与ASCVD发生同样也是密切相关的[3]。TG每增加1 mmol/L,ASCVD的发病率增加22%。多不饱和脂肪酸是体内重要的脂类物质,一般通过天然食物摄入,根据第一个双键出现在甲基端碳原子的位置不同,主要分为ω-3族和ω-6族不饱和脂肪酸。有研究发现,增加ω-3族不饱和脂肪酸摄入,可以通过降低三酰甘油酶表达下降,抑制肝脏三酰甘油合成关键酶或增加清除等机制来降低TG水平[4]。临床上将ω-3制剂作为治疗高三酰甘油血症(HTG)一线或二线用药[5],与他汀类药物合用可以降低ASCVD发生风险。本文采用液相色谱串联质谱技术检测冠心病患者(包括部分高血压患者)血清中不饱和脂肪酸谱的含量水平,与TG情况进行比较,希望能够找到冠心病患者血脂异常情况下特征性的不饱和脂肪酸谱的含量变化,为下一步探索不饱和脂肪酸,特别是ω-3族在ASCVD治疗中的作用打好基础。
1 对象与方法
1.1 研究对象 选择2019—2020年在南京医科大学附属第二医院心内科就诊患者130例,其中诊断为冠心病患者91例,诊断为高血压病患者39例,男性71例,女性59例,年龄(68.77±5.12)岁,未接受过脂肪酸相关制剂、药物的治疗,签署知情同意书。
1.2 方法 收集患者的一般情况,包括年龄、性别、BMI等;采用生化方法检测患者外周血的TG水平,根据最新版的《动脉粥样硬化患者三酰甘油升高的管理中国专家共识》将TG<1.7 mmol/L定义为TG水平正常。通过液相色谱串联质谱技术,检测患者的多不饱和脂肪酸指标。本研究为回顾性研究。
1.3 不饱和脂肪酸谱检测 使用液相色谱串联质谱技术平台检测患者静脉血样本中的不饱和脂肪酸谱项目。主要检验设备为AB SCIEX API 3200液相色谱串联质谱系统,其中液相设置条件为进样量:5 μL/min,自动进样器温度:室温,柱温:40 ℃,流速:600 μL/min。质谱条件为ESI电压:5 500 V,离子源温度:600 ℃,碰撞气体(CAD):6 psi,窗帘气体(CUR):25 psi,离子源气体(GS1):65 psi,离子源气体(GS2):60 psi。采用正离子MRM扫描分析。检测试剂采用不饱和脂肪酸谱商品化检测试剂盒,检测项目包括ω-3族不饱和脂肪酸、ω-6族不饱和脂肪酸和计算值。其中ω-3族不饱和脂肪酸为α-十八碳三烯酸(α-C18:3,ALAα-亚麻酸)、ω-3-二十二碳五烯酸(ω-3-C22:5)、二十碳五烯酸(C20:5,EPA)和二十二碳六烯酸(C22:6,DHA),ω-6族包括十八碳二烯酸(C18:2)、γ-十八碳三烯酸(γ-C18:3)、二十碳四烯酸(C20:4,AA)、ω-6-二十二碳五烯酸(ω-6-C22:5)4种不饱和脂肪酸。同时计算这些脂肪酸中ω-6族(C18:2,γ-C18:3,AA,ω-6-C22:5)与ω-3族(α-C18:3,ω-3-C22:5,EPA,DHA)之间的比值:ω-6/ω-3。参考范围采用试剂盒自带说明。
1.4 统计学方法 使用IBM SPSS 23.0软件进行统计学分析。计量资料呈偏态分布,以中位数(M)和四分位数(P25-P75)表示,两组间比较使用Mann-WhitneyU检验;计数资料以例数和百分数表示。P<0.05认为差异有统计学意义。
2 结果
2.1 不同疾病种类不饱和脂肪酸浓度比较 91例冠心病患者与39例高血压患者比较,发现ω-3族和ω-6族不饱和脂肪酸及ω-6/ω-3比值含量差异无统计学意义(P>0.05)。见表1。
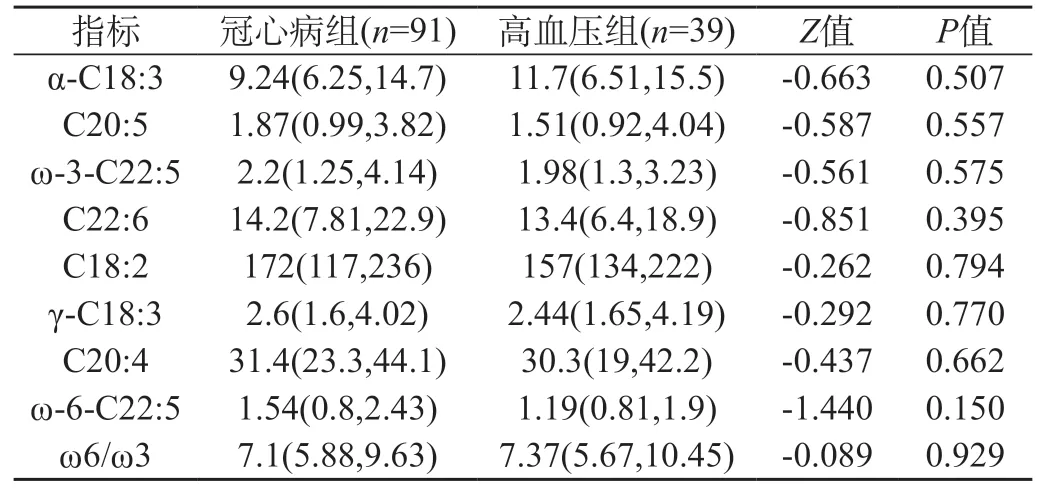
表1 冠心病组与高血压组不饱和脂肪酸浓度比较(μmol/L)
2.2 不同三酰甘油水平不饱和脂肪酸浓度比较 所有130例患者中,96例患者的三酰甘油水平<1.7 mmol/L,划分为血脂正常组,其余34例患者的三酰甘油水平≥1.7 mmol/L,划分为血脂异常组。将这两组的不饱和脂肪酸谱浓度进行比较,发现ω-3族不饱和脂肪酸谱中的α-C18:3(ALA)水平有显著性差异(P<0.05),ω-6族不饱和脂肪酸谱中的γ-C18:3水平有显著性差异(P<0.05),其余6种不饱和脂肪酸浓度和ω-6/ω-3比值差异没有统计学意义(P>0.05)。见表2。
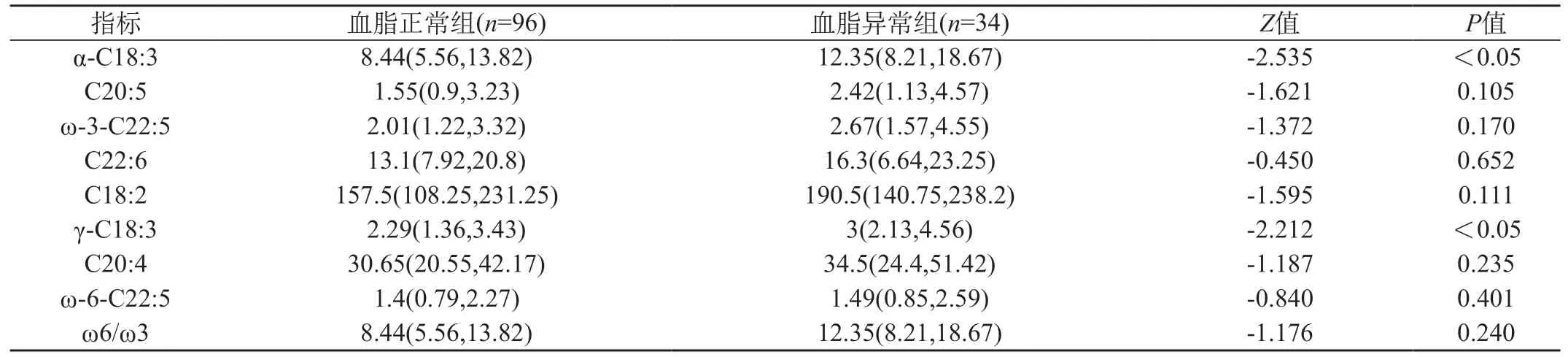
表2 不同血脂水平间不饱和脂肪酸浓度比较(μmol/L)
2.3 冠心病患者不同三酰甘油水平不饱和脂肪酸浓度比较 在冠心病患者中,血脂正常(TG<1.7 mmol/L)70例(占比76.92%),血脂异常(≥1.7 mmol/L)21例(占比23.08%),二者间不饱和脂肪酸谱浓度进行比较,同样发现ω-3族不饱和脂肪酸谱中的α-C18:3(ALA)水平有显著性差异(P<0.05),ω-6族不饱和脂肪酸谱中的γ-C18:3水平有显著性差异(P<0.05),其余6种不饱和脂肪酸浓度和ω-6/ω-3比值差异没有统计学意义(P>0.05)。而比较两组间不饱和脂肪酸谱浓度的中位数,则发现血脂正常组ω-3族及ω-6族不饱和脂肪酸浓度中位数均低于血脂异常组,但ω-6/ω-3比值中位数高于血脂异常组。见表3。

表3 冠心病不同血脂水平不饱和脂肪酸浓度比较(μmol/L)
2.4 冠心病患者不同性别不同血脂水平不饱和脂肪酸浓度比较 血脂正常组和血脂异常组在针对性别进行分层后,分析不饱和脂肪酸浓度水平,发现男性患者群体中,ω-3族和ω-6族不饱和脂肪酸及ω-6/ω-3比值差异均没有统计学意义(P>0.05)。而在女性患者群体中,发现ω-3族不饱和脂肪酸中的C20:5(EPA)和ω-6族不饱和脂肪酸谱中的γ-C18:3水平有显著性差异(P<0.05),其余6种不饱和脂肪酸浓度和ω-6/ω-3比值差异没有统计学意义(P>0.05)。见表4。

表4 冠心病患者不同性别不同血脂水平不饱和脂肪酸浓度比较(μmol/L)

3 讨论
本研究发现血脂异常的心血管疾病患者的α-C18:3(ALA,α-亚麻酸)和γ-C18:3水平与血脂正常的群体相比出现了显著性差异,中位数水平是高于血脂正常的群体。在单独对冠心病患者分析的亚组分析中,同样发现了α-亚麻酸水平在血脂异常组中的水平高于血脂正常组。α-亚麻酸在亚麻籽油、植物油中含量丰富,肉制品和奶制品也可以提供α-亚麻酸[6]。同时可以通过一系列碳链延长酶和去饱和酶的作用,合成ω-3族中非常重要的两种物质,DHA和EPA。临床上发现,适当地摄入鱼油或直接使用ω-3族不饱和脂肪酸,对于心血管疾病有预防和治疗作用[7-9]。从心血管危险因素角度出发,适当地提升ω-3族不饱和脂肪酸水平时,在高血压中可以通过上调血管紧张素转化酶Ⅱ活性,促进内皮细胞释放前列环素和一氧化氮等机制改善动脉顺应性,从而降低血压[10];而在动脉粥样硬化中,则可以通过改善内皮功能、减轻炎性反应、稳定斑块等机制来抑制动脉粥样硬化的进程。本研究发现α-亚麻酸水平的增高是出现在患者体内血脂异常状态时,提示血脂异常时,体内会代偿性地减少α-亚麻酸代谢和转化,增加贮存,从而提高体内的α-亚麻酸水平,增强降血脂的功能。本研究所纳入的患者未接受过脂肪酸相关制剂、药物的治疗,所以不存在超过普通人群的高ω-3族不饱和脂肪酸摄入水平,所以这种补偿机制可能并不完全有效。此外,α-亚麻酸可以在体内转化成EPA和DHA,男性α-亚麻酸转化EPA和DHA转化率最高仅8%和4%,女性则可达到21%和9.2%,女性的高转化率,与本研究中血脂异常女性中,发现ω-3族不饱和脂肪酸中的EPA水平提高的结果是相一致的。提高的EPA水平,降低了ω-6/ω-3比值,研究发现ω-6/ω-3比值在血脂异常组中的中位数低于血脂正常组,侧面印证冠心病患者血脂异常情况下机体自我调节作用,因为既往研究中发现这一比值减少,与心脑血管疾病发生发展减缓有关系[11-12]。而当血脂在正常水平时,即使已经存在冠心病或高血压疾病,体内可能不会启动代偿机制,上调ω-3族不饱和脂肪酸水平来减缓血脂异常。
在血脂异常的女性患者中,发现ω-6族不饱和脂肪酸谱中的γ-C18:3水平与血脂正常女性有显著性差异,在ω-3族中则是EPA水平与血脂正常女性有显著性差异。这提示血脂异常的冠心病患者群体中不饱和脂肪酸谱的变化可能同样受到性别的影响,可能与前述的α-亚麻酸转化EPA和DHA转化率中性别差异相关。

