头孢菌素C产生菌的诱变育种及发酵应用
牛李杰,张 婷,党建宁,张宝新
(伊犁川宁生物技术股份有限公司,新疆 伊宁 835000)
头孢菌素C(Cephalosporin C),全称7-(D-5-氨基-5-羧基戊酰胺基)头孢霉烷酸,是一种亲水性的β-内酰胺类抗生素,主要作为7-氨基头孢霉烷酸(7-ACA)的合成中间体[1]。头孢菌素C通过抑制细菌细胞壁肽的合成起到抑菌作用,具有抑菌范围广、对人体毒性较小等优点[2-3]。
头孢菌素C的产生菌为顶头孢霉(Cephalosporiumacremonium),生长较慢,在发酵过程中容易出现抗性丢失、菌种退化的现象,因此需要不断进行自然和诱变选育来保证菌种的优良性能,防止菌种衰退[4]。为了选育出性能优良的菌株,常采用紫外诱变、微波诱变、化学诱变等方法,但是微生物突变生理生化反应复杂,通过单一诱变往往难以达到目标。因此,诱变育种多采用复合诱变法,即组合两种或者两种以上化学或其它诱变剂使菌株发生较大的突变,进而筛选出优良菌株来提高效价[5]。曹栋等[6]通过紫外诱变结合终产物抗性的方法筛选到的突变菌株RM-8的头孢菌素C效价比出发菌株提高了45%。任璐[7]通过紫外诱变筛选到铜离子、丙二酸、头孢菌素C-钠盐耐受的突变菌株,并验证了耐受突变菌株与高产突变菌株有一定的联系,从耐受突变菌株中更容易得到高产突变菌株。孟国庆等[8]通过物理化学复合诱变的方法筛选到的高产菌株经摇瓶发酵后,头孢菌素C效价达到2.83 g·L-1,比出发菌株提高了154.6%。黎亮等[9]对顶头孢霉进行了紫外-氯化锂复合诱变处理,并对培养基进行了优化,在160 t发酵罐中培养高产菌株,其效价比出发菌株提高了22.6%以上。
作者采用紫外线和丙二酸复合诱变的方法筛选头孢菌素C高产菌株,并对筛选出的高产菌株进行50 L发酵罐小试验证,为后期中试及工业化生产提供优良菌种和数据支持,对丰富菌种资源和提高生产效率具有现实意义。
1 实验
1.1 菌种与培养基
顶头孢霉(Cephalosporiumacremonium)B-1822-S-04,保存于伊犁川宁生物技术股份有限公司。
PDA培养基(g·L-1):马铃薯浸粉5.0,葡萄糖20.0,硫酸铵15.0,琼脂15.0,自然pH值。
种子摇瓶培养基(g·L-1):黄豆粉28.0,酵母浸膏28.0,玉米浆19.0,蔗糖30.0,葡萄糖10.0,碳酸钙5.0,pH值7.00±0.05。
发酵摇瓶培养基(g·L-1):花生粉28.0,酵母浸膏30.0,黄豆粉35.0,玉米浆15.0,玉米粉20.0,硫酸铵1.0,碳酸钙15.0,消泡剂1.4,pH值7.20±0.05。
15 L一级种子罐培养基(g·L-1):黄豆粉29.0,花生粉28.5,蔗糖25.0,碳酸钙5.0,玉米浆50.0,葡萄糖10.0,消泡剂0.35,pH值7.8,121 ℃灭菌35 min。
50 L二级种子罐培养基(g·L-1):黄豆粉29.0,花生粉28.5,蔗糖8.0,豆油10.0,碳酸钙6.5,硫酸铵2.5,硫酸镁2.0,葡萄糖24.5,淀粉20.0,玉米浆60.0,消泡剂0.35,pH值6.0,121 ℃灭菌35 min。
50 L发酵罐培养基(g·L-1):花生粉17.0,谷朊粉14.0,玉米粉11.0,糊精20.0,蛋氨酸15.0,硫酸铵8.0,豆油53.0,玉米浆100.0,硫酸钙9.0,碳酸钙5.0,消泡剂0.25,pH值6.8,121 ℃灭菌35 min。
1.2 仪器
30W/5A型紫外灯,上海四通特种灯泡厂;SW-CJ-2FD型超净工作台,苏州安泰空气技术有限公司;HWS-250型恒温恒湿培养箱,上海比朗仪器制造有限公司;ZWY-2102型恒温振荡培养箱,上海沪粤明科学仪器有限公司;SB-C18型高效液相色谱仪,安捷伦;CX31型显微镜,奥林巴斯;WS-500YDA型灭菌锅,济南宁乐医疗器械有限公司;PHS-3C型pH计,上海盛磁仪器有限公司;PL3002型电子天平,瑞士梅特勒-托利多;PHCBI型超低温冰箱,日本三洋;50 L型六联发酵罐,上海百仑生物科技有限公司。
1.3 方法
1.3.1 菌悬液的制备
刮取活化培养的菌株B-1822-S-04孢子,与0.9%无菌生理盐水混合,置于旋涡振荡器上振荡20 s使孢子混合均匀,用双层无菌脱脂棉纱布过滤,得菌悬液,适当稀释控制孢子浓度约为106个·mL-1。
1.3.2 致死率和正突变率的测定
统计诱变处理平板上的菌落数,以未经诱变处理平板上的菌落数作为对照,按下式计算致死率:

1.3.3 效价的测定[10-11]
按1.3.1方法制备菌悬液,经种子和发酵摇瓶培养后,将发酵液于3 000 r·min-1离心10 min,取上清液,用0.44 μm过滤器过滤,采用HPLC法测定效价(头孢菌素C含量,下同)。
HPLC检测条件:安捷伦SB-C18色谱柱(4.6 mm×250 mm,5 μm),流速1.0 mL·min-1,进样量10 μL,柱温30 ℃,检测波长254 nm,流动相:0.01 mol·L-1乙酸钠∶乙腈=98∶2(体积比),pH值4.0。
1.3.4 紫外诱变
吸取5 mL菌悬液置于无菌玻璃平皿中,置于紫外灯下照射,间距15 cm;每隔一定时间(10 s、30 s、60 s、90 s、120 s、150 s、180 s)吸取菌悬液,稀释后涂布于PDA培养基平板上,以未经紫外灯照射的菌悬液作为对照,用黑纸包裹后置于30 ℃培养箱中培养7 d,统计平板上的菌落数,计算致死率,确定最佳紫外诱变时间。
在最佳紫外诱变时间下,再次进行紫外诱变培养,挑取形态、大小、色泽优良的单菌落,经种子和发酵摇瓶培养后测定效价。
1.3.5 紫外线和丙二酸复合诱变
将菌悬液紫外诱变一定时间(最佳诱变时间),稀释后涂布于含有不同浓度(0.1%、0.2%、0.4%、0.8%、1.0%、1.2%、1.5%)丙二酸的PDA培养基平板上,然后置于30 ℃培养箱中培养7 d,统计平板上的菌落数,计算致死率,确定最佳丙二酸浓度。
在最佳紫外诱变时间、最佳丙二酸浓度下,再次进行紫外线和丙二酸复合诱变培养,挑取形态、大小、色泽优良的单菌落,经种子和摇瓶发酵培养后测定效价,筛选头孢菌素C高产菌株。
1.3.6 高产菌株筛选及遗传稳定性实验
在确定的最佳复合诱变条件下,对菌悬液进行多次复合诱变处理,进一步筛选高产菌株。将最终选育出的高产菌株进行斜面传代培养,经种子和发酵摇瓶培养后测定效价,验证高产性能的遗传稳定性。
1.3.7 验证实验
在最佳复合诱变条件下,对筛选到的高产菌株进行50 L发酵罐小试。首先将摇瓶种子液接入15 L一级种子罐,再将一级种子液接入50 L二级种子罐,然后将二级种子液接入50 L发酵罐中,每12 h取样测定效价。整个过程严格按照工艺参数进行调控。
2 结果与讨论
2.1 紫外诱变结果
菌悬液经过不同时间的紫外诱变,稀释后涂布于培养基平板上,培养7 d后计算致死率,考察紫外诱变时间对致死率的影响,结果见表1。
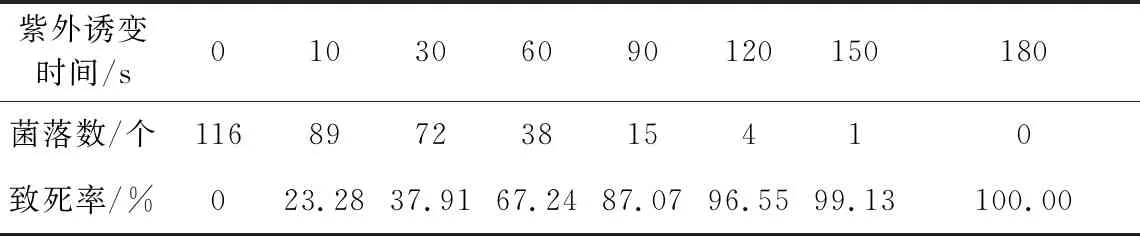
表1 紫外诱变时间对致死率的影响
由表1可知,随着紫外诱变时间的延长,致死率逐渐升高;0~90 s内致死率升高明显,90 s后致死率升幅趋缓;紫外诱变90 s时的致死率为87.07%,紫外诱变120 s时的致死率达到96.55%。根据前期实验,致死率在80%左右时正突变率较高,因此选择紫外诱变时间为90 s。
2.2 紫外诱变效价检测结果
菌悬液经过90 s紫外诱变后,通过培养筛选出形态、大小、色泽优良的菌株共83株,经种子和摇瓶发酵培养后,测定发酵液效价,结果见表2。
由表2可知,经紫外诱变后的效价基本呈正态分布,效价在3 000~3 999 mg·L-1的菌株最多,有25株;其次是效价在4 000~4 999 mg·L-1,有18株;效价高于出发菌株B-1822-S-04(效价为4 520 mg·L-1)的有16株,占总数的19.28%,其中效价最高达到6 251 mg·L-1,较出发菌株提高了38.29%。
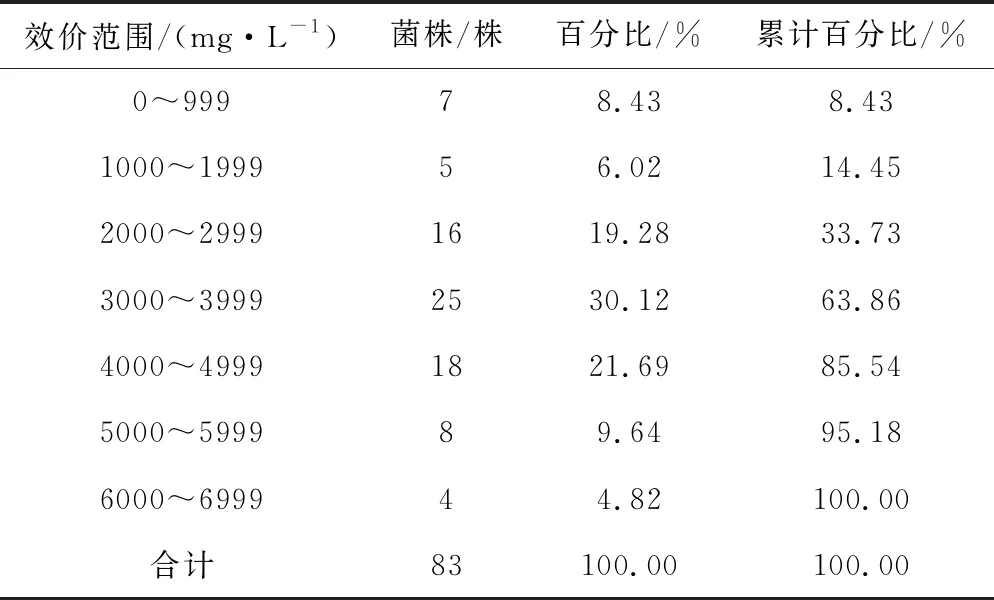
表2 紫外诱变后的头孢菌素C效价
2.3 紫外线和丙二酸复合诱变结果
菌悬液经过90 s紫外诱变,稀释后涂布于含有不同浓度丙二酸的培养基平板上,培养7 d后计算致死率,考察丙二酸浓度对致死率的影响,结果见表3。

表3 丙二酸浓度对致死率的影响
由表3可知,随着丙二酸浓度的增加,致死率逐渐升高;当丙二酸浓度增至1.2%时,致死率为100.00%。因此,1.0%是菌株对丙二酸的耐受临界浓度。
2.4 复合诱变效价检测结果
菌悬液经过90 s紫外诱变,稀释后涂布于含有1.0%丙二酸的培养基平板上,通过培养筛选出形态、大小、色泽优良的菌株共76株,经种子和发酵摇瓶培养后,测定发酵液效价,结果见表4。
由表4可知,经过复合诱变后,效价在4 000~4 999 mg·L-1的菌株最多,有19株;效价高于出发菌株的有22株,占总数的28.95%,其中效价最高达到6 871 mg·L-1,较出发菌株B-1822-S-04提高了52.01%。

表4 复合诱变后的头孢菌素C效价分析
2.5 高产菌株的筛选及其遗传稳定性
在紫外诱变时间为90 s、丙二酸浓度为1.0%的条件下,对菌株B-1822-S-04进行多次紫外和丙二酸复合诱变,筛选到10株头孢菌素C高产菌株,经种子和发酵摇瓶培养后测定效价,结果见表5。
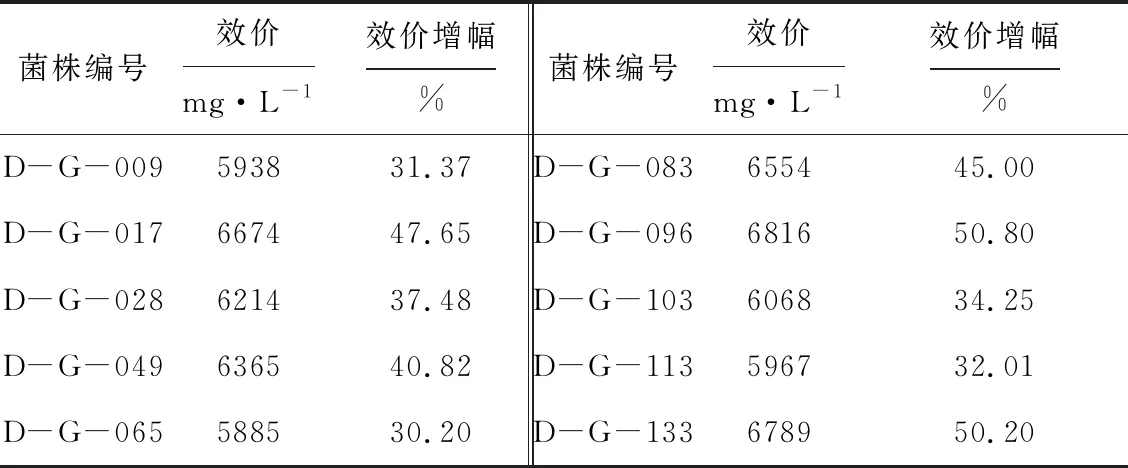
表5 高产菌株的效价
由表5可知,10株头孢菌素C高产菌株中效价较高的是菌株D-G-017、D-G-083、D-G-096和D-G-133,其效价分别为6 674 mg·L-1、6 554 mg·L-1、6 816 mg·L-1和6 789 mg·L-1,分别较出发菌株B-1822-S-04提高了47.65%、45.00%、50.80%和50.20%。
对4株高产菌株进行遗传稳定性实验,结果(表6)显示,传代5代后,4株高产菌株的效价虽有下降,但与出发菌株相差不大,说明这4株高产菌株的遗传稳定性较好。将筛选的4株高产菌株分别保存,供后续实验使用。
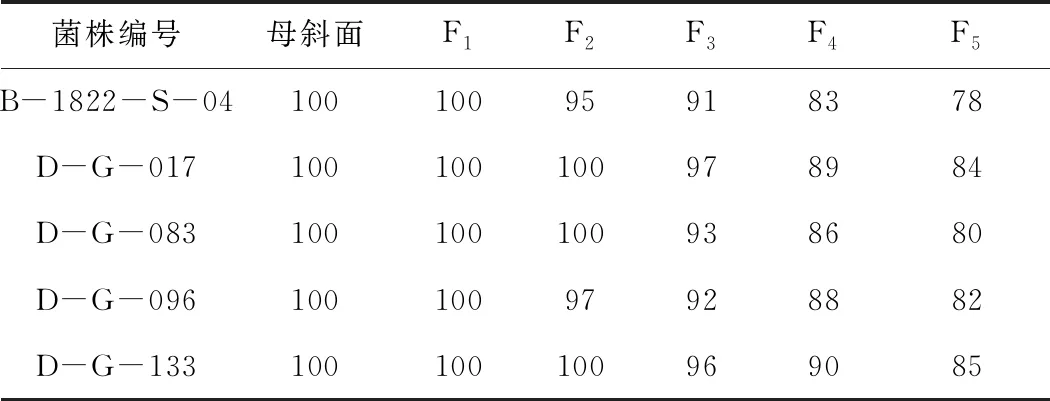
表6 4株高产菌株的遗传稳定性分析
2.6 高产菌株的小试发酵结果
将筛选到的4株高产菌株分别在50 L发酵罐中培养160 h,效价均呈上升趋势,其中菌株D-G-096的效价最高达到了29 270 mg·L-1(图1),较摇瓶发酵的效价(6 816 mg·L-1)提高了约4倍,较出发菌株50 L发酵罐的效价(13 868 mg·L-1)提高了111.06%;菌株D-G-133、D-G-017、D-G-083的效价也分别提高了102.57%、94.70%、73.56%。
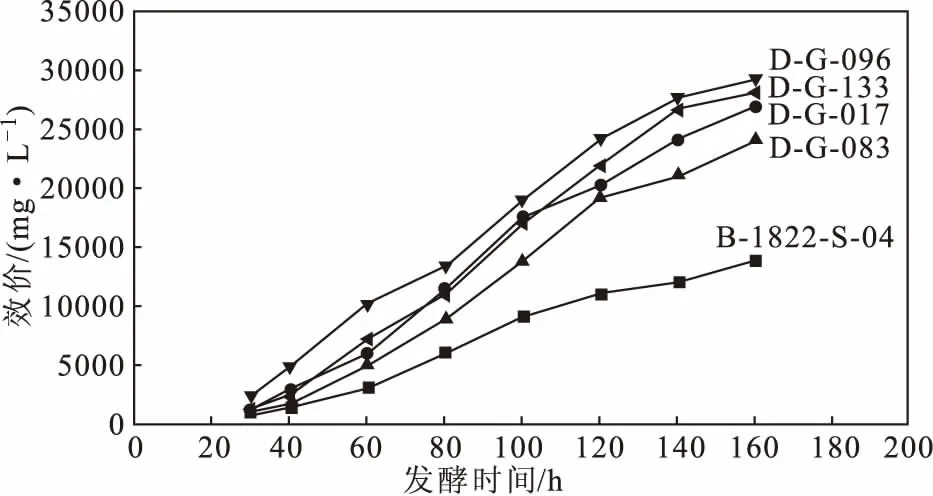
图1 高产菌株小试发酵过程中的效价变化
2.7 讨论
影响发酵水平的首要因素是菌种资源,性能优良的菌种具有效价高、性能稳定、不易退化变异、对原材料要求低等特点。本实验采用紫外线和丙二酸复合诱变的方法筛选头孢菌素C高产菌株,虽然最终筛选出的菌株D-G-096摇瓶发酵的效价为6 816 mg·L-1,比出发菌株提高了50.80%,但是实验周期较长,过程较为复杂;而传统诱变技术,例如孟国庆[12]、杜淑涛[13]通过原生质体融合技术,Sun等[14]、陈国枝等[15]、胡又佳等[16]通过基因工程技术,李英英等[17]采用ARTP诱变技术,也能筛选出头孢菌素C高产菌株,且简单快速、目的性更强。
本实验将筛选的4株高产菌株进行50 L发酵罐小试,其中菌株D-G-096的效价达到29 270 mg·L-1,是摇瓶发酵的4倍,较出发菌株的50 L发酵罐的效价提高了111.06%。牛永利[18]曾通过实验验证了50 L和5 t发酵罐效价没有太大变化,可以将50 L发酵罐的工艺结论应用到工业化生产中。但是由于菌种不同、培养基配方不同,后期还需要进一步验证500 L、5 t发酵罐的中试发酵情况,将发酵工艺更好地应用于工业化生产。
3 结论
以头孢菌素C产生菌顶头孢霉(Cephalosporiumacremonium) B-1822-S-04为出发菌株,经过紫外线和丙二酸复合诱变,筛选得到了4株头孢菌素C高产菌株D-G-017、D-G-083、D-G-096和D-G-133,其中菌株D-G-096头孢菌素C效价高达6 816 mg·L-1,较出发菌株提高了50.80%,且高产特性稳定;50 L发酵罐小试结果显示,菌株D-G-096的效价达到了29 270 mg·L-1,较出发菌株提高了111.06%,可作为优良高产菌株保存使用。

