舒更葡糖钠分离纯化工艺的研究
沈保涛,刘金明,成祥旭,张永振,张贵民(山东新时代药业有限公司,国家手性制药工程技术研究中心,山东 临沂 273400)
舒更葡糖钠(sugammadex sodium)是一种新型的选择性肌松药拮抗剂(结构式见图1),能选择性结合氨基载体类肌松药并终止其肌肉松弛效应。该药物是一种修饰的γ-环糊精,由8个毗邻的葡萄糖分子构成环状分子结构,具有亲脂性内腔,具有最佳的容纳氨基载体分子,8个带负电荷亲水的羧基侧链从环糊精分子边缘向外投射,侧链上的酸性功能基(COO-)增加了舒更葡糖钠内腔的亲脂性并能与罗库溴铵带正电荷的氮原子形成静电键[1-5]。同时,这些基团彼此排斥,因而保证了环糊精分子内腔的开放,一旦罗库溴铵的甾体核进入舒更葡糖钠内腔,带负电荷的羧基键紧紧地与罗库溴铵带正电荷的季铵分子结合。静脉注射舒更葡糖钠,其与血浆中游离的罗库溴铵结合后,减少血浆中游离药物浓度,导致神经肌肉接头处罗库溴铵返回血浆,并进一步与舒更葡糖钠结合,使罗库溴铵从效应室快速转移至中央室,从而使神经肌肉阻滞迅速逆转[6]。舒更葡糖钠作为一种新的肌松拮抗剂,固价格昂贵,目前在国内还没有普遍使用,但该药能快速、充分逆转肌松作用,降低术后肌松残余的发生率,能用于肝肾功能不全的患者,改善患者预后,使用时要警惕过敏反应和心血管不良事件的发生[7]。
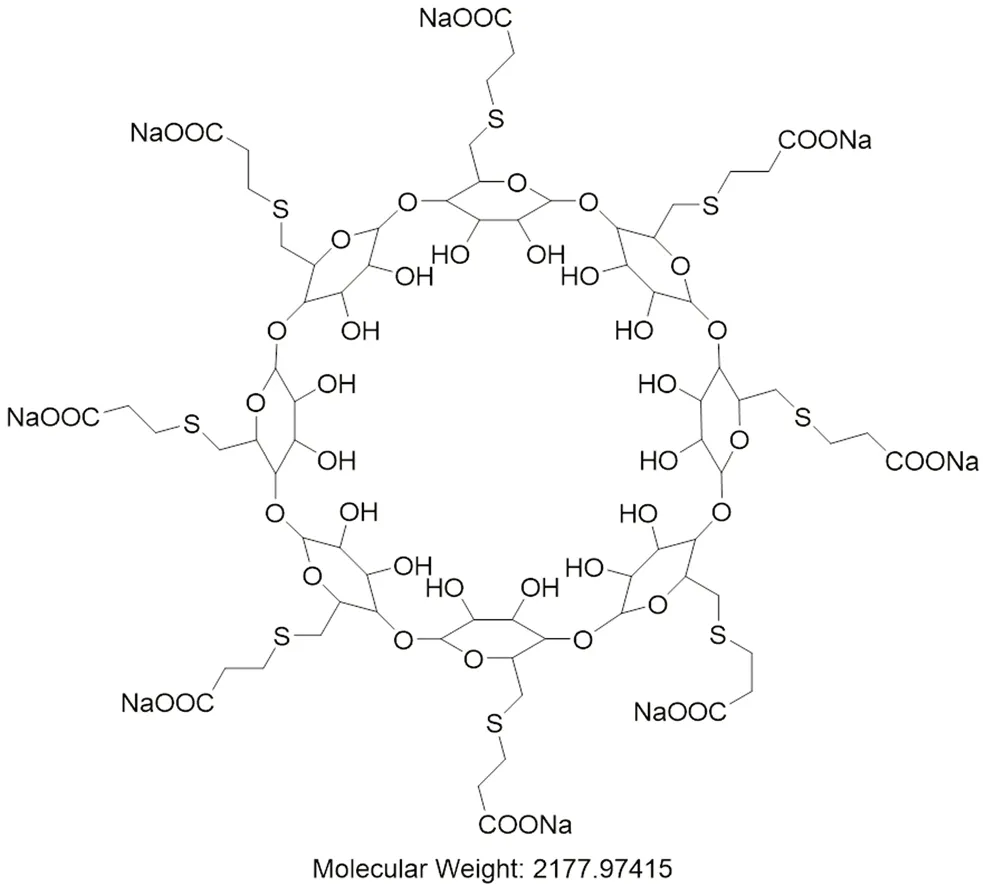
图1 舒更葡糖钠结构式Fig 1 Structure of sugammadex sodium
专利CN201610896608报道了一种舒更葡糖钠纯化方法,该方法主要采用离子交换树脂纯化,纯化后的舒更葡糖钠水溶液在乙醇中将产品析出[8]。但是该方法舒更葡糖钠会富集乙醇中的杂质,增加气相杂质的含量,不能保证终产品的纯度。专利CN109517093A报道了一种通过制备色谱柱和冷冻干燥获得最终纯品的方法[9],虽然该方法的纯度和收率都较高,但是经冷冻干燥处理后的舒更葡糖钠粉末的水分含量高达8.659%,尤其在温湿度较高的环境时水分含量更难控制,夏季湿度较高时水分很容易超过10%,而且乙腈溶剂残留达到0.7303%,超过了质量标准的限度要求。该文中对比例3采用公斤级喷雾干燥机MODEL SCL-12对溶液进行开放式空气喷雾干燥,得到舒更葡糖钠粉末纯度最高,能达到99.8%,但是该工艺在喷雾干燥后为了进一步控制水分含量还需要在50~80℃条件下进行真空干燥[10]。笔者通过试验发现氧气含量在0.1%以下进行喷雾干燥时,得到舒更葡糖钠粉末质量会更稳定,可在进行喷雾干燥前先用高纯氮气置换喷雾干燥系统中空气使其氧气含量低于0.1%,这样既能减少系统中由空气中引入的水分也能防止氧气对舒更葡糖钠的氧化,纯度>99.9%且水分<5.0%[10]。专利CN110627926A报道了多达21种舒更葡糖钠有关物质,有些是在空气中被氧化产生的非对映异构体杂质,有些是舒更葡糖钠在光照条件下产生的光降解杂质等,不仅如此,舒更葡糖钠特殊的中空锥形圆桶型结构及较强的水溶性特点,使其在生产过程中很容易包裹无机盐及小分子有机物等杂质,这给后续的精制纯化工艺带来非常大的难度[11]。本工艺在控制舒更葡糖钠的有关物质的同时,也能控制水分和溶剂残留,现报道如下。
1 仪器与试药
1.1 仪器
高效液相色谱仪(Agilent,1260 HPLC);动态轴向压缩柱制备色谱系统(北京创新通恒,LC6000型);真空冷冻干燥机(LABCONCO);旋转蒸发仪(BUCHI,R-220 pro);B-295SE型喷雾干燥仪(BUCHI);卡尔费休水分检测仪(METTLERTOEDO V30);气相色谱仪(SHIMADZU,GC 2010 plus)。
1.2 试药
磷酸二氢钠(分析纯,默克股份两合公司),磷酸、甲酸(分析纯,国药集团化学试剂有限公司),纯度检测用乙腈(色谱级,默克股份两合公司),制备用乙腈(制备级,潍坊中汇化工有限公司),制备用水为纯化水,分析用水为超纯水。
2 方法与结果
2.1 检测方法
2.1.1 有关物质检测方法 色谱柱:Phenomenex Aqua C18(2.0 mm×150 mm,3 μm,125 Å);检测波长:200 nm;柱温:40℃;流速:0.27 mL·min-1;流动相A:0.025 mol·L-1磷酸二氢钠水溶液(pH=3.0)∶乙腈=830∶205;流动相B:乙腈。梯度洗脱程序见表1。
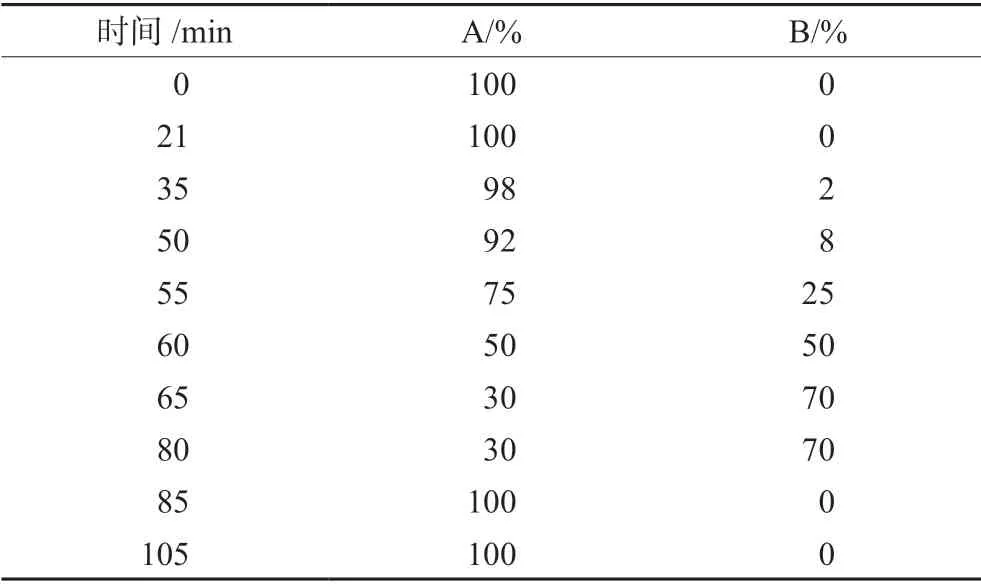
表1 梯度洗脱程序Tab 1 Gradient elution program
2.1.2 含水量检测方法 取舒更葡糖钠粉末50 mg,溶解于甲醇和甲酰胺的混合溶液中(体积比1∶1),使用卡尔费休水分检测仪进行检测。
2.1.3 残留溶剂检测方法 色谱柱:6%氰丙基苯基-94%二甲基聚硅氧烷为固定液的毛细管柱DB-624(0.32 mm×30 mm,1.8 μm);载气:高纯氮气;升温程序:40℃,维持6 min,以20℃·min-1的速率升温至180℃,维持4 min;检测器:220℃;顶空平衡温度80℃;维持30 min;分流比:10∶1;传输线:150℃;定量环:160℃;流速:2.0 mL·min-1。称取待测舒更葡糖钠粉末100 mg,溶解于2 mL水中作为待测样,按上述方法进行测定。
2.2 舒更葡糖钠粗品的合成
以γ-环糊精为起始原料,在N,N-二甲基甲酰胺(DMF)中与溴和三苯基膦发生溴代反应,γ-环糊精中葡萄糖6位的羟基被替换为溴基得到中间体溴代-γ-环糊精,再与3-巯基丙酸和氢氧化钠发生硫醚化反应,溴代-γ-环糊精转化为6-丙酸钠-γ-环糊精,即舒更葡糖钠[12]。本试验使用的舒更葡糖钠粗品(批号:200301B-1)是由公司彭祥龙博士等[13]合成的,纯度为69.79%,见图2。

图2 舒更葡糖钠粗品纯度检测谱图Fig 2 Purity detection spectrum of sugammadex sodium crude product
2.3 舒更葡糖钠的制备
2.3.1 制备柱装填 取干燥的Sepax HP C1810µm 120 Å填料300 g置于烧杯中,缓慢加入异丙醇并同向搅拌,保持总体积约800 mL,超声30 min后将匀浆液倒入DAC-50 mm柱中,通过调节气阀大小,使气压保持10 MPa装柱[14]。
2.3.2 一次制备 称取舒更葡糖钠粗品15 g加入1.2 L纯化水溶解再加入乙酸调pH 2.6后,加入约200 mL乙腈使其完全溶解,通过DAC-50 mm高压制备色谱系统进行一次制备纯化。具体方法如下:
填料:Sepax HP C1810 μm 120 Å;仪器:动态轴向压缩柱制备色谱系统;波长:200 nm;流速:60 mL·min-1;进样量:200 mL;流动相A:0.15%的甲酸水溶液,B:0.15%的甲酸乙腈混合液,梯度洗脱,程序见表2。
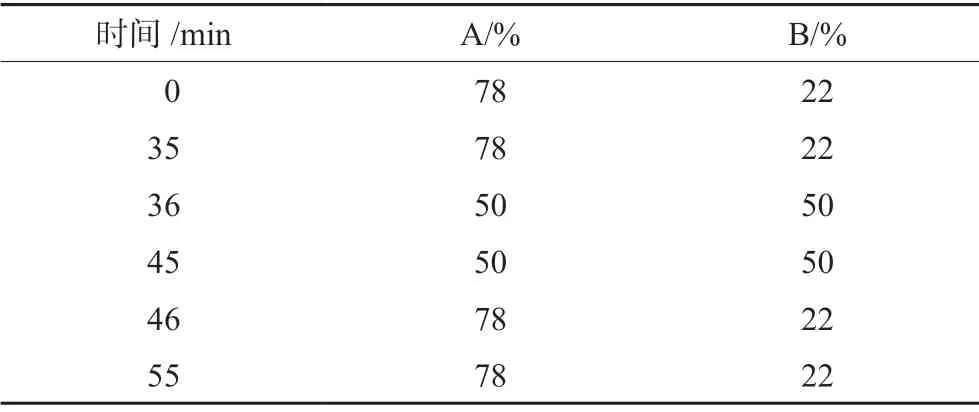
表2 梯度洗脱程序Tab 2 Gradient elution program
重复多次进样收集接出液,收集24.4 min峰吸收值1100~1000 AU的洗脱液,检测接出液纯度为97.62%,一次制备接出图谱见图3A,一次制备接出液纯度检测结果见图3B。

图3 舒更葡糖钠一次制备(A)及纯度检测(B)色谱图Fig 3 First preparation(A)and purity detection(B)chromatogram of sugammadex sodium
2.3.3 二次制备 将一次制备接出液加入1.5倍的纯化水稀释后经DAC-50 mm高压制备色谱系统进行二次制备,具体方法如下:
填料:Sepax HP C1810 μm 120 Å;仪器:动态轴向压缩柱制备色谱系统;波长:200 nm;流速:60 mL·min-1;进样量:2.5 L;流动相A:纯水,B:乙腈,梯度洗脱,程序见表3。

表3 梯度洗脱程序Tab 3 Gradient elution program
重复多次进样收集接出液,收集22 min峰吸收值300~200 AU的洗脱液即二次制备接出液,检测纯度为99.93%,二次制备色谱图见图4A,二次制备接出液纯度检测图见图4B。

图4 舒更葡糖钠二次制备(A)及纯度检测(B)色谱图Fig 4 Second preparation(A)and purity detection(B)chromatogram of sugammadex sodium
2.4 样品后处理
待冷阱降温到-20℃后,打开旋转蒸发仪水浴锅,温度设25℃,将二次制备接出液倒入旋蒸瓶中,打开真空泵,浓缩二次制备接出液至1.2 L,先放入冰箱内预冷后再缓慢加入预冻好的0.1 mol·L-1氢氧化钠溶液,在冰浴条件下搅拌调至pH 7.5左右,在氮气保护的条件下经0.2 μm滤膜过滤,收集滤液,分成3份,每份约400 mL,待用。
2.4.1 冷冻干燥处理及检测结果 取合格的舒更葡糖钠浓缩液400 mL放入冻干盘中,打开真空冷冻干燥机待冷阱降温到-50℃后在氮气保护的条件下把样品放入冻干仓内,放入样品盘前需用氮气彻底置换冻干机内空气。关闭进气阀,排水阀。运行冻干程序,样品经过升华、解析过程后形成舒更葡糖钠粉末。冷冻干燥参数见表4。

表4 冷冻干燥参数Tab 4 Freeze drying parameters
取样前先关闭真空泵用氮气经进气阀缓慢回填至常压后,关闭冷阱压缩机,收集舒更葡糖钠粉末,收率87.8%,纯度检测为98.13%,水分检测8.66%,乙腈残留0.7303%,纯度检测图谱见图5。

图5 舒更葡糖钠检测谱图Fig 5 Detection spectrum of sugammadex sodium
2.4.2 析晶干燥处理及检测结果 取合格的舒更葡糖钠浓缩液400 mL,在氮气保护的条件下加入700 mL甲醇中,有白色固体析出,过滤;将所得固体溶解于300 mL纯化水中,加入活性炭,加热至50℃搅拌1 h,趁热过滤得滤液,将滤液滴加入700 mL冷甲醇中,然后继续搅拌1 h析晶,过滤得滤饼;然后再次将滤饼溶解于300 mL纯化水中,加入活性炭,加热至50℃搅拌1 h,趁热过滤得滤液,将滤液滴加入700 mL冷甲醇中,然后继续搅拌1 h析晶,过滤得滤饼,将滤饼于50℃减压干燥得舒更葡糖钠粉末,收率86.5%,纯度检测为98.92%,水分检测10.22%,甲醇残留2.38%,纯度检测图谱见图6。

图6 舒更葡糖钠检测谱图Fig 6 Detection spectrum of sugammadex sodium
2.4.3 喷雾干燥处理及检测结果 取合格的舒更葡糖钠浓缩液400 mL,在氮气保护的条件下经0.2 μm滤膜过滤,通高纯氮气5~8 bar置换B-295SE喷雾干燥仪中的空气30 min,置Oxygen Analyser 检测氧气浓度低于0.1%;设定进口温度为150~160℃;设定抽气机的抽气速度为25 m³·h-1;设置喷雾流量计的流量为473 L·h-1;设置进样泵流速为3 mL·min-1;然后通过进样泵将舒更葡糖钠滤液输送至喷雾干燥仪,干燥结束,待入口温度降到90℃以下时从产品收集容器中收集舒更葡糖钠粉末,收率89.8%,纯度检测为99.94%,水分检测4.95%,乙腈残留0.0004%,纯度检测图谱见图7。

图7 舒更葡糖钠检测谱图Fig 7 Detection spectrum of sugammadex sodium
3 讨论
现有方法制备出的舒更葡糖钠粉末可能会产生溶剂残留超标、水分含量高、粉末性状不均一以及原料药在水中溶解性差等问题,本工艺提供了一种操作简单、条件温和、产品收率高、纯度高、性状均一、有机溶剂残留低、水分含量低、溶解性更好的舒更葡糖钠分离纯化工艺。
本工艺所使用的高压制备方法具有出峰快,稳定性高,重现性好等优点。喷雾干燥法是一种新型处理方法,试验结果表明经过喷雾干燥处理后的舒更葡糖钠能够控制其有关物质、水分和溶剂残留,且粉末性状和均一性更好,纯度能达到99.9%。通过该工艺可以有效避免析晶干燥过程中大量溶剂的使用,减少固体析出过程中的降解,相比真空冷冻干燥更能有效降低固体舒更葡糖钠纯品中水分含量和有机溶剂残留,值得推广使用。

