巧用四步法攻破电极反应式的书写
银秋兰
摘 要:电化学基础专题是高中化学基本理论中的重要内容,也是每年高考化学中的必考点,其中电极反应式书写是电化学的核心,更是教学的重点和难点。因此采用行之有效的方法去攻破电极反应式的书写这一难点,在实际教学过程中显得尤为重要。本文通过例题介绍四步法应用于不同类型电池电极反应式的书写,建立起书写模型,为教学实践提供参考,对学生正确、快速完成电极反应式的书写具有重要的指导意义。
关键词:氧化还原反应;守恒原则;电极反应式;四步法
电化学知识是历届各省高考化学必考内容,其中选择题及大题中都涉及到电极反应式的判断及书写,而电极反应式的书写对于很多学生来说都是一个难点,想要正确快速地书写电极反应式,笔者认为不仅要熟记电化学的基本知识及其相关规律,更重要的是要掌握电极反应式的书写技巧。在长期的教学过程中,笔者通过不断的摸索积累建立起一套轻松攻破电化学电极反应式的书写方法——四步法。以下笔者将通过具体的教学实例对该方法的应用进行详尽的阐明。
一、理论依据
无论是原电池还是电解池,其微观化学本质都是通过化学电池将一个氧化还原反应拆分成两个独立的氧化反应和还原反应,令氧化反应和还原反应分别在两极发生。即:
原电池→正、负极→负极失电子发生氧化反应、正极得电子发生还原反应
电解池→阴、阳极→阳极失电子发生氧化反应、阴极得电子发生还原反应
二、电极反应式书写原则
利用四步法解决电极反应式书写需要遵循以下书写原则:
1.电荷守恒、元素守恒原则:为使电极反应式等号两边满足电荷守恒、元素守恒,需要加入一些阴阳离子及物质。通常是①酸性溶液:在反应物中加H+,在生成物中加H2O。②碱性溶液:在反应物中加OH–,在生成物中加H2O。
2.共存原则:碱性溶液中 CO2不可能存在,也不会有H+参加反应或生成;同样酸性溶液,不会有 OH-参加反应或生成。根据此原则,物质得失电子后在不同介质环境中所存在的形式不同。
三、四步法书写电极反应式的技巧
书写电极反应式就是要写出氧化或还原这两个半反应式,而电极反应式同样要遵循元素守恒和电荷守恒。笔者在高考一轮复习中采用在练习中总结和反思的方式,教会学生四步法解决电化学方程式的书写,学生掌握情况较好,且具有举一反三的功效。具体操作如下:
1.先写出电极主要反应物和主要生成物;
2.由化合价升降写出得失电子数:
3.由电荷守恒写出箭头左边或右边相应的离子;
4.由元素守恒配平电极反应式。
例题1:以镁、石墨为电极,在次氯酸钠溶液中构成一次性电池,电池反应为 Mg+NaClO+H2O=NaCl+Mg(OH)2,则该电池正极反应式为_____________________________。
书写过程:
1.先写出电极主要反应物和主要产物 ClO – → Cl–
2.由化合价写出得失电子数(Cl元素由+1价变为-1价,得到2e-)
3.由电荷守恒,箭头左边有3个负电荷,右边也该有3个负电荷,右边加2OH-
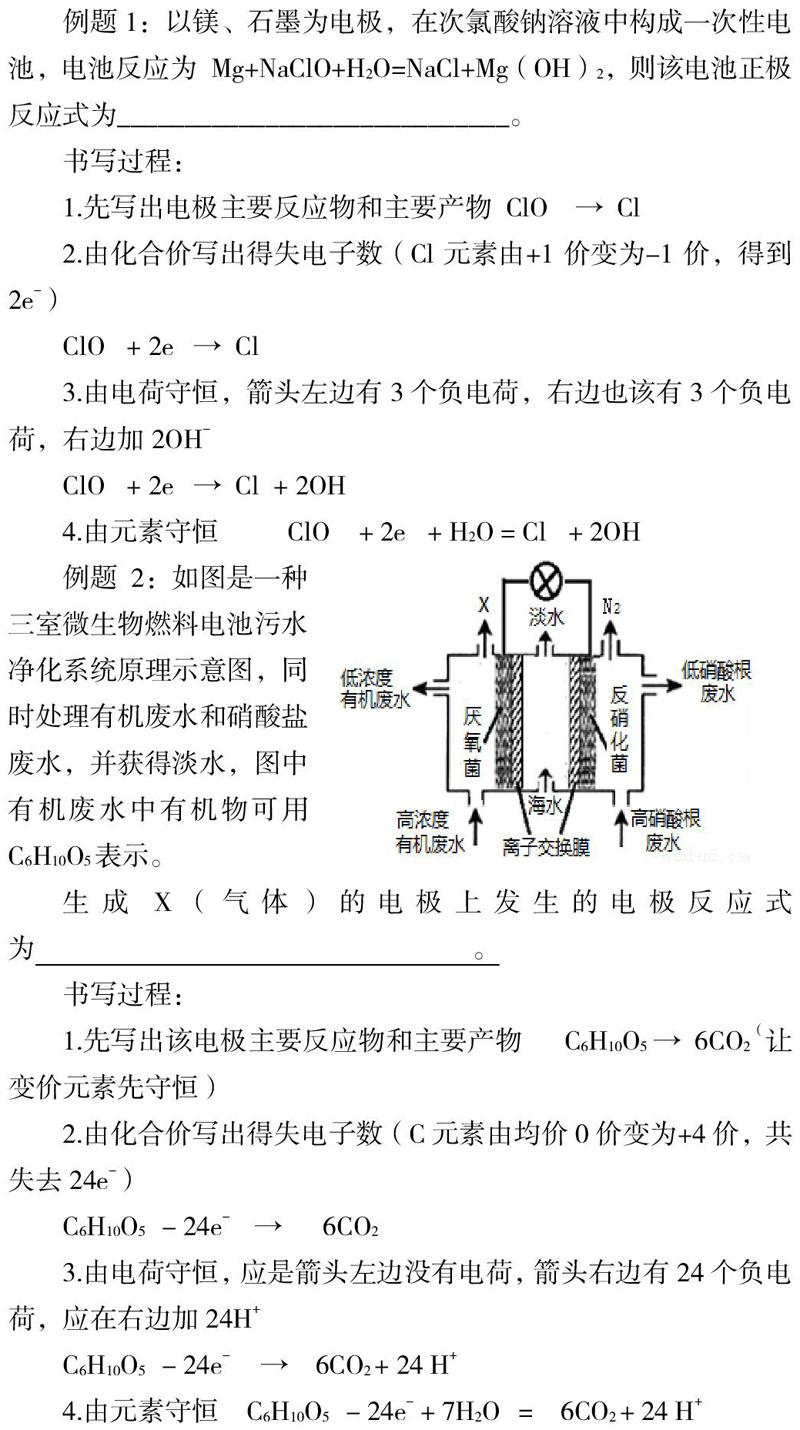
例题2:如图是一种三室微生物燃料电池污水净化系统原理示意图,同时处理有机废水和硝酸盐废水,并获得淡水,图中有机废水中有机物可用C6H10O5表示。
生成X(气体)的电极上发生的电极反应式为 。
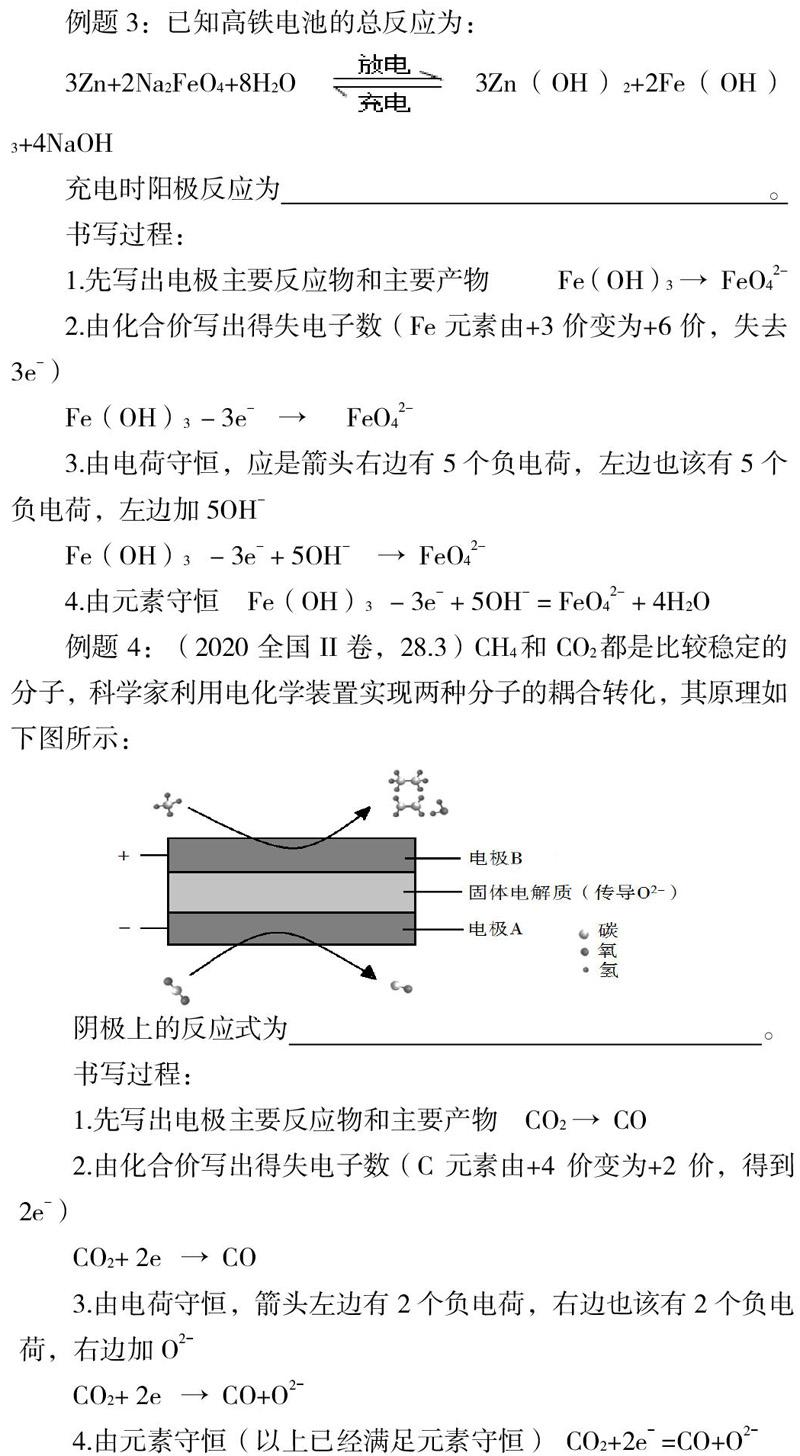
四步书写法可以概括成:列物质、标电子、电荷守恒、元素守恒,酸性环境的电极反应用H+来配平,碱性环境的电极反应用OH- 來配平。其他环境的电极反应像熔融碳酸盐环境下要用CO32?来配平,熔融金属氧化物环境下用O2? 来配平等。掌握这种方法,任何电极反应式的书写都会快速完成,不仅适用于大题中的填空也适用于选择题中的快速判断,为每位同学提供了高效的得分点。
参考文献:
[1]冯雁《原电池与电解池电极反应式的书写技巧》—《电大理工》2008年3月第1期
[2]文政民《新情境下电极反应式的书写》—《中学生理科应试》2020年第04期

