检测羊肠道病毒RT-PCR方法的建立及初步应用
董 坤,胡俊英,李卓宸,蔡梦露,章 凡,王玮玉,王浴光,王新平 (吉林大学 动物医学学院 教育部人兽共患病研究重点实验室,吉林 长春 130062)
羊肠道病毒(caprine enterovirus,CEV)感染是近年来国内外报道的新发传染病[1],临床上多以消化道和呼吸道症状为特征,发病羊群呈现腹泻、呼吸困难,某些羊群呈现较高的发病率和死亡率。作为新发传染病,CEV感染广泛存在于国内不同地区的羊群,给养羊业造成了较为严重的经济损失[2]。引起CEV感染的病原体为肠道病毒,属于小RNA病毒科(Picornaviridae)肠道病毒属成员,是引起人类与动物临床上以消化道、呼吸道、神经系统功能紊乱为特征的疫病的病原体之一[3-4]。根据国际病毒分类委员会(ICTV)的最新分类,肠道病毒属共含有12个肠道病毒种(A~L)及3个鼻病毒种(A~C),其中EV-E和EV-F主要感染牛,EV-G主要感染猪[5]。CEV作为新发现的病原体,目前被列为G种肠道病毒(EV-G)[6]。本实验室在国际上首次分离出的CEV-JL14毒株被ICTV收录为 EV-G20 的参考毒株[7]。由于CEV为新发疫病,有关其诊断与检测方法研究较少,虽然目前检测CEV的方法有病毒分离、电镜观察和夹心ELISA方法,这些方法均有其各自的优缺点以及适用性[8],但不适用于临床样品的快速检测。因此急需建立一种具有快速、简便、特异性好、灵敏度高、易操作等特点的检测手段,便于对临床样品进行快速检测。本研究针对严重危害养羊业发展的新发CEV感染,建立了一种特异、敏感、快速、操作简便且便于应用于临床样品检测的RT-PCR检测方法,为CEV感染的诊断提供有效的技术手段。
1 材料与方法
1.1 主要试剂TRIzol试剂、DNA Marker、Taq DNA聚合酶、M-MLV反转录酶等购自TaKaRa生物技术有限公司;胎牛血清(FBS)购自HyClone公司;DMEM细胞培养液购自Sigma公司;青霉素(160×104U/瓶)、链霉素(100×104U/瓶)、琼脂糖、核酸染料购自宝泰克生物科技(北京)有限公司;pGM-T载体购自安捷伦科技公司;DNA回收试剂盒购自天根生化科技(北京)有限公司。
1.2 病毒毒株及细胞培养CEV-JL14毒株、牛病毒性腹泻病毒(BVDV)CC13B 毒株由本实验室分离并保存。按照常规方法,应用Vero细胞进行病毒培养。临床粪便样品采自吉林省发生腹泻与呼吸道症状的疑似CEV感染羊群和临床健康羊群。将临床样品用PBS按照1∶10进行稀释,4℃、8 000 r/min离心20 min后取上清液通过0.45 μm微孔滤膜过滤除菌,-80℃保存备用。
1.3 病毒RNA提取及cDNA合成应用Vero细胞进行病毒的培养。用病毒液接种细胞,当约70%的细胞出现病变时收取细胞,应用试剂盒提取RNA,置于-80℃保存备用。病毒cDNA的合成参照产品说明书进行,反应体系:3 μL随机引物、3 μg RNA模板、1.5 μL M-MLV反转录酶、6 μL 5×RT Buffer、1.5 μL 10 mmol/L dNTP,用无RNase的ddH2O将反应体系补至30 μL。反应程序:30℃ 10 min,42℃ 59 min,70℃ 15 s,4℃ 1 min。制备的cDNA于-20℃保存。
1.4 引物设计与合成根据CEV-JL14毒株的基因组序列,设计合成1对CEV特异性引物,由生工生物工程(上海)股份有限公司合成,用于扩增CEV 5′UTR序列。引物序列:CEV-5′UTR-F:5′-CTTTGCACGCCTGTTTTCC-3′;CEV-5′UTR-R:5′-CACACGCTCGGAGGTTGGGAT-3′。预期扩增产物大小为497 bp。
1.5 RT-PCR扩增及反应体系优化以上述合成的cDNA为模板,应用特异性引物扩增目的序列,扩增产物经1%琼脂糖凝胶电泳验证。将PCR反应程序中的退火温度设置在51~60℃,进行退火温度的梯度试验,确定PCR反应的最适退火温度。
1.6 产物的克隆与测序将扩增的PCR产物,通过琼脂糖凝胶电泳回收后,与pGM-T载体连接,转化TOP10感受态细胞,挑取单个阳性菌落,提取质粒后送至生工生物工程(上海)股份有限公司测序,将测序结果与GenBank中的CEV序列进行比对,确认正确后,提取质粒,命名为pGM-T-5′UTR,使用超微量核酸蛋白分析仪测定其浓度并计算拷贝数。
1.7 特异性试验应用RT-PCR方法检测CEV、小反刍兽疫病毒(PPRV)、BVDV阳性样品,同时以未感染CEV的阴性样品和ddH2O为阴性对照,确定方法的特异性。
1.8 敏感性试验将构建好的阳性质粒进行10倍倍比稀释,以不同稀释倍数的质粒为模板,以ddH2O为阴性对照,通过上述优化后的RT-PCR方法进行检测,验证该方法的敏感性。
1.9 重复性与应用性试验应用RT-PCR方法重复检测上述样品3次,确定方法的重复性。将建立的RT-PCR方法与本实验室已建立的双抗体夹心ELISA方法进行比对,对28份临床样品进行检测。
2 结果
2.1 RNA提取与鉴定提取接毒细胞的总RNA,进行1%琼脂糖凝胶电泳,结果如图1所示,提取到的RNA质量较好,纯度较高。
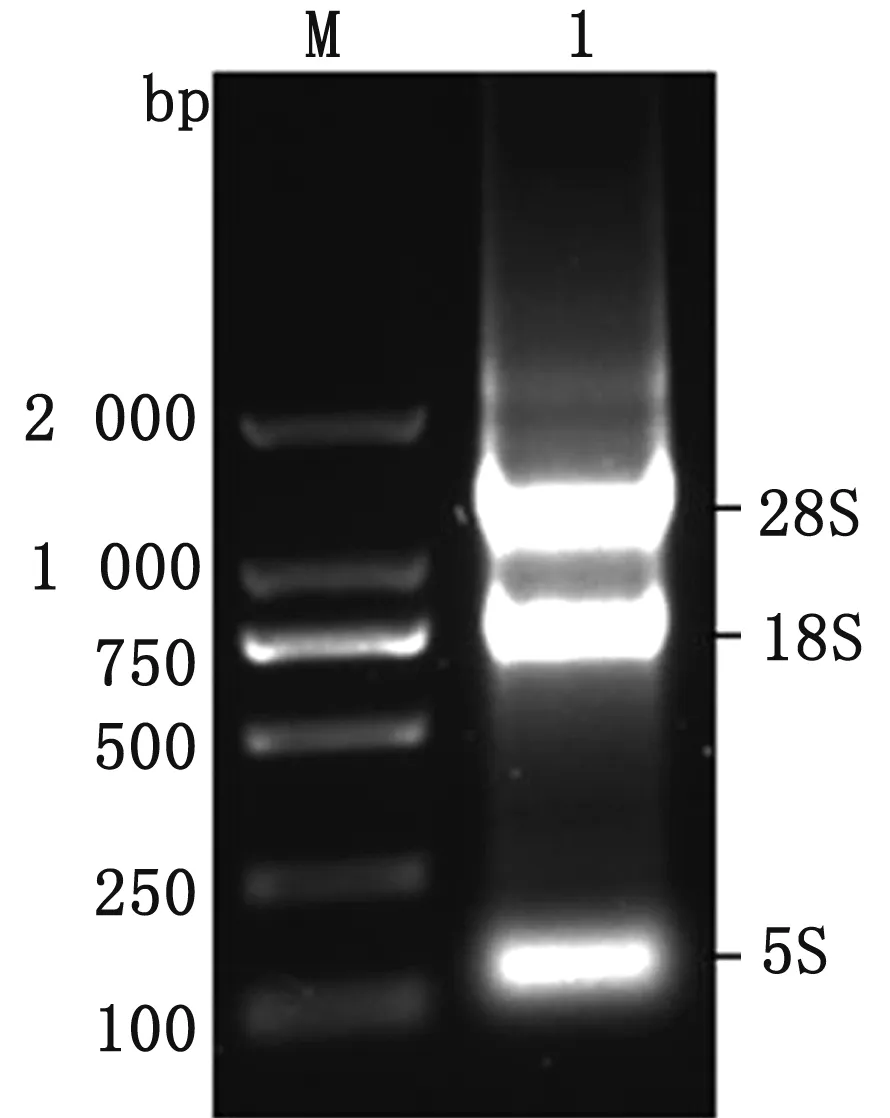
M.DL2000 DNA Marker;1.接毒细胞总RNA图1 总RNA琼脂糖凝胶电泳
2.2 目的基因扩增将提取的接毒细胞总RNA反转录成cDNA,以其为模板,利用CEV 5′UTR特异性引物,通过PCR扩增目的序列片段,并通过1%琼脂糖凝胶电泳对PCR扩增产物进行验证,结果如图2所示,扩增出497 bp的目的片段,与预期大小相符。
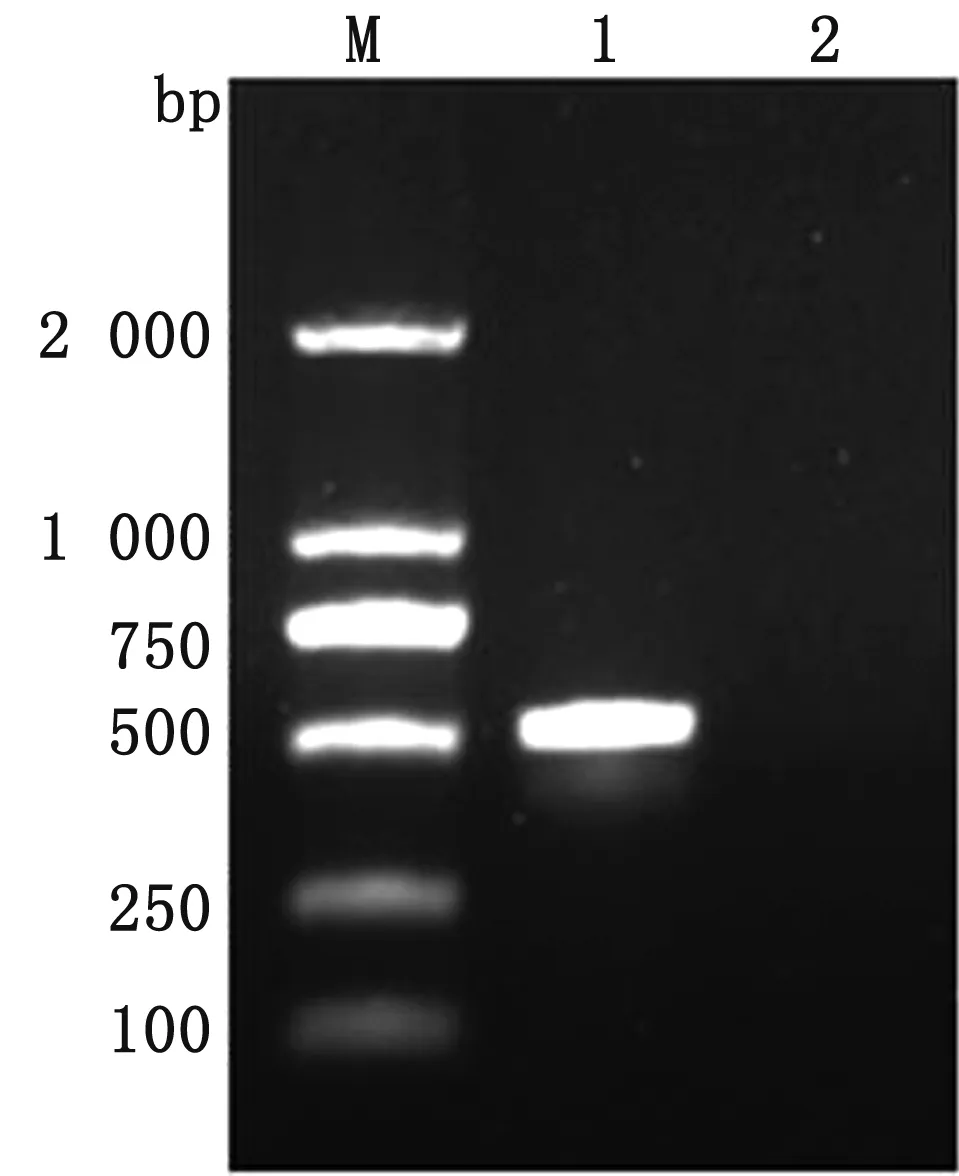
M.DL2000 DNA Marker;1.PCR扩增产物;2.阴性对照图2 PCR扩增产物的琼脂糖凝胶电泳
2.3 PCR反应条件的优化将PCR反应程序中的退火温度设置在51~60℃,进行退火温度梯度试验,并通过1%琼脂糖凝胶电泳对PCR扩增产物进行检测,确定PCR反应的最佳退火温度,结果如图3所示,在51~57℃时,目的条带均较亮,本研究选取54℃进行后续试验。

M.DL2000 DNA Marker;1~10.51~60℃;11.阴性对照图3 确定最适退火温度的梯度PCR扩增结果
2.4 特异性试验应用RT-PCR方法检测CEV、PPRV和BVDV阳性样品,以未感染CEV的阴性样品和ddH2O作为对照,扩增结果如图4所示,仅有感染CEV的样品检测结果为阳性,其余样品检测结果均为阴性,说明该方法具有良好的特异性。

M.DL2000 DNA Marker;1.CEV阳性样品;2~4.PPRV、BVDV、CEV阴性样品;5.ddH2O图4 RT-PCR方法特异性试验
2.5 敏感性试验所提取质粒的质量浓度为0.5 g/L,计算出pGM-T-5′UTR质粒的拷贝数为1.13×1011拷贝/μL,通过稀释使其质粒拷贝数为1.13×108拷贝/μL,再按照10倍倍比稀释,以稀释产物为模板,通过RT-PCR方法进行检测,确定方法的敏感性。结果如图5所示,该方法对CEV的最低检测限为1.13×103拷贝/μL,说明该方法具有较高的敏感性。
2.6 重复性与应用性试验应用RT-PCR方法重复检测上述样品3次,结果一致,证明该方法具有良好的重复性。应用建立的RT-PCR和双抗体夹心ELISA对28份临床样品进行检测,检测结果显示,28份临床样品中含有6份阳性样品和22份阴性样品,G种肠道病毒检出率为21.4%,两种方法的符合率均为100%。
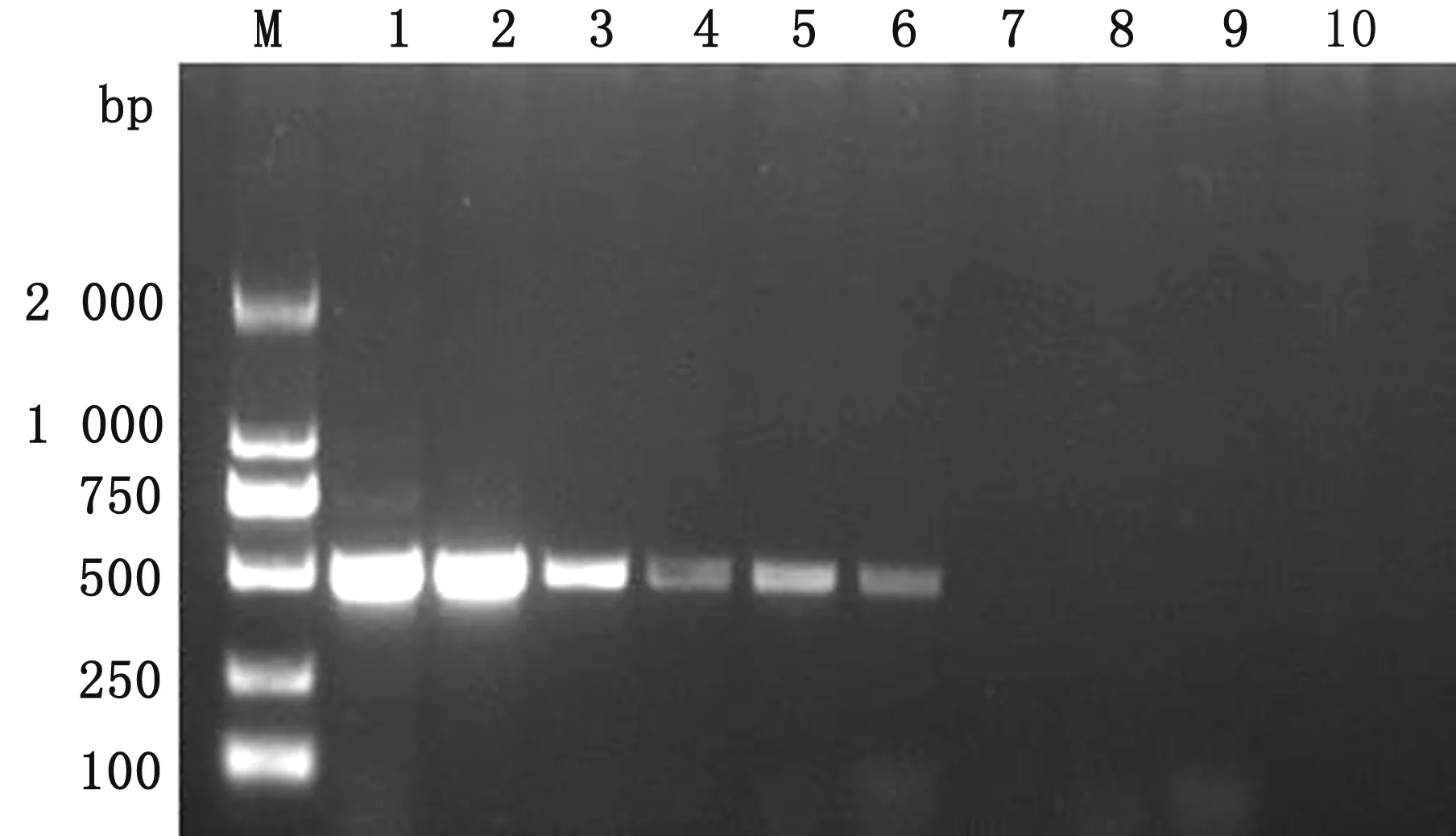
M.DL2000 DNA Marker;1~9.1.13×108~1.13×100 拷贝/μL pGM-T-5′UTR;10.阴性对照图5 RT-PCR方法敏感性试验
3 讨论
CEV为近年来出现于国内外的新发传染病,给养羊业造成严重的经济损失[9]。本实验室于2014年从发生严重腹泻的山羊中分离出国际上首株CEV-JL14毒株,该病毒株目前被ICTV收录为EV-G20的参考毒株[10-11]。CEV感染可引起以消化道、呼吸道和繁殖障碍为症状的疾病,如果与其他病原混合感染或发生其他病原的继发感染,会导致羊群的病死率增加。流行病学研究发现CEV可与PPRV混合感染而使羊群病死率明显增加,对养羊业的健康发展造成严重危害[12-13]。由于CEV感染是国内外近年来新发的疫病,有关该病的诊断与鉴别方法的研究匮乏,因此,建立肠道病毒检测方法将会为该新发病毒感染的诊断及流行病学研究提供技术手段。目前有关CEV感染的检测方法主要包括病毒分离鉴定和免疫学方法检测等[14]。病毒分离成本高、耗时长、分离难度大;由于毒株之间存在明显差异,用ELISA方法检测病毒抗原,容易出现假阴性,同时温度和时间等干扰因素对方法的重复性影响较大。RT-PCR是一种快速、准确、高效、可靠的检测方法,具有灵敏度高、特异性强、重复性好等特点,也是当前用于疾病快速诊断和检测的方法[15]。本研究根据G种肠道病毒毒株的保守区,设计引物并建立了检测CEV的RT-PCR方法,在特异性试验中仅扩增出CEV的目的条带,而对BVDV、PPRV和BEV的cDNA,未扩增出任何条带,表明此方法具有较高的特异性;同时通过敏感性试验确定了该方法的最低检测限为1.13×103拷贝/μL,表明该方法灵敏度较高。重复性与应用性试验结果进一步证明此方法重复性良好,有利于该疾病诊断方法的标准化,具有易于大规模应用的潜力。应用新建立的和已有的ELISA方法进行比对,对6份阳性样品和22份阴性样品进行检测,结果显示,两者的符合率为100%,表明该方法可替代现有的ELISA方法。本研究所建立的RT-PCR方法具有检测时间较短、敏感性高、特异性强、重复性好的特点,可为羊群CEV感染的快速检测及其流行病学调查提供有效的技术支撑。

