口蹄疫病毒样颗粒诱导的肥大细胞活化对IgG应答的影响
刘佳欢,崔 川,张俊娟,韩伟建,张义明,李丽敏,王家鑫 (河北农业大学 动物医学院,河北 保定 071000)
口蹄疫(foot-and-mouth disease,FMD)是由口蹄疫病毒(foot-and-mouth disease virus,FMDV)所引起的一种热性、急性和高度接触性偶蹄类动物传染病[1],目前预防FMD的主要措施是疫苗接种。虽然灭活疫苗在临床上广泛使用,但灭活疫苗接种1次后不能诱导持续的保护性免疫应答,而需要多次接种,且只能预防临床疾病而不能阻止持续性感染,其生产过程中还存在安全隐患[2-4]。病毒样颗粒(virus-like particles,VLP)是一种无致病性的蛋白质颗粒,不含核酸,极易被免疫细胞捕获诱导机体产生较强的体液免疫和细胞免疫应答,因此VLP被广泛用于新型疫苗的研发[5]。
肥大细胞(mast cells, MCs)广泛分布于小血管和淋巴管周围的结缔组织内,与树突状细胞(dendritic cell,DC)、巨噬细胞等一起构成机体抗病原入侵的第一道防线[6-7]。作为组织内的免疫细胞,MCs不仅参与炎症反应和纤维化,也发挥组织维持、血管生成、病原体清除和免疫调节的作用[8]。MCs通过其表面的模式识别受体识别细菌、寄生虫与病毒结构蛋白,从而引发MCs活化,释放预先形成的颗粒成分(组胺、蛋白酶等)、新合成的脂质介质和细胞因子,从而调节固有免疫及适应性免疫应答[9-11],发挥其清除病原的重要作用[12-13]。MCs分泌的肝素和TNF-α与壳聚糖按一定的比例混合制成颗粒作为佐剂,与流感病毒血凝素混合制成试验疫苗,用其免疫小鼠可有效模拟MCs的功能,从而诱导机体产生免疫应答抵抗致死量流感病毒的攻击[14]。MCs活化后可以诱导机体血清中IgG水平显著升高[15],表明MCs的活化产物可以诱导机体产生较好的体液免疫应答。小鼠腹腔MCs在体外可以通过清道夫受体、甘露糖受体、TLR2和TLR4识别FMDV-VLP,从而引起脱颗粒和细胞因子的分泌[16-17]。特别值得注意的是,FMDV-VLP诱导的腹腔MCs脱颗粒产物可以促进脾初始淋巴细增殖,而其分泌成分则可以直接启动脾初始B淋巴细胞增殖,从而抑制T淋巴细胞增殖[18],但对于FMDV-VLP诱导机体皮肤、淋巴结、脾等器官内MCs脱颗粒的作用尚不清晰。
因此,本研究制备了FMDV-VLP,用其免疫小鼠[16],利用冰冻切片技术研究小鼠组织中的MCs脱颗粒情况,通过ELISA方法检测小鼠外周血中FMDV特异性IgG水平及TNF-α、IL-10分泌情况,以期为研究FMDV新型佐剂及免疫应答机制提供理论基础与支撑。
1 材料与方法
1.1 实验动物6~8周龄的SPF级 BALB/c 小鼠(合格证书编号:11400700272257)购自北京维通利华实验动物有限公司,饲养在独立通风鼠笼中。
1.2 主要试剂HEK-293T细胞和重组质粒pET32a(+)-HBcAg(+)-VP1-VP4由本实验室保存;无内毒素质粒提取试剂盒购自北京康为世纪生物科技有限公司(CWS008);BL21感受态细胞购自北京全式金生物技术有限公司(CD201-01);Lipofectamin 2000 Reagent购自美国Invitrogen(11668030)公司;Opti-MEMⅠ无血清培养基(11058021)和DMEM高糖培养基(10373017)购自美国Gibco公司;超滤管购自Millipore公司(UFC500396);碳支持膜300目圆孔铜网购自新兴百瑞技术有限公司(T200);DAB辣根过氧化物酶显色试剂盒(PW0072)和2%磷钨酸染色液(PR0124844)购自北京雷根生物技术公司;甲苯胺蓝染色液试剂盒购自索莱宝科技有限公司(G3661);小鼠TNF-α(MTA00B)和IL-10(M1000B)定量ELISA检测试剂盒均购自美国R&D Systems公司;山羊抗小鼠HRP-IgG抗体购自中杉金桥生物技术有限公司(ZB-2035);新西兰胎牛血清购自Thermo Fisher Scientific公司(16140063)。
1.3 病毒样颗粒的制备及Western blot鉴定将重组质粒pET32a(+)-HBcAg(+)-VP1-VP4转化至BL21感受态细胞,过夜培养后通过无内毒素质粒提取试剂盒提取质粒。按照Lipofectamin 2000操作说明,将质粒与Lipofectamin 2000混合并转染HEK-293T细胞,收集转染后60 h的培养上清, 利用His标签镍离子蛋白纯化柱纯化目的蛋白。取纯化后的蛋白,加入等体积2×SDS上样缓冲液,振荡混匀后,100℃水浴5 min使蛋白质变性,12 000 r/min离心2 min收集蛋白进行SDS-PAGE,电泳后对纯化的蛋白进行Western blot鉴定。
1.4 VLP的透射电镜鉴定在超滤管中加入200 mg/L FMDV VLP溶液200 μL,然后加入10 mL 经过0.22 μm滤膜过滤的超纯水,浓缩至1 mL,重复3~4次,最后1次浓缩至200 μL。取20 μL浓缩液滴至透射电镜铜网上,干燥后用2%磷钨酸进行负染色,自然干燥后通过透射电镜观察。
1.5 动物试验将20只BALB/c小鼠随机分为2组。初次免疫采用颈背部多点注射方式,50 μg/只,注射剂量为0.2 mL(VLP组);对照组小鼠注射同剂量PBS(PBS组)。首免后14 d进行加强免疫,VLP组和PBS组的免疫剂量和途径均相同。对免疫后14,28 d的小鼠进行眼球采血,分离血清保存备用;颈椎脱臼法处死小鼠,分别取脾脏、颌下淋巴结、颌下腺和皮肤,浸泡于4%多聚甲醛中,室温保存备用。
1.6 MCs染色将上述组织在30%蔗糖的PBS中过夜脱水处理,用OTC包埋剂进行包埋,用-20℃恒温冰冻切片机切成4 μm厚度的组织切片,用4%多聚甲醛固定后使其自然干燥;使用甲苯胺蓝浸染组织切片10~15 min(具体的染色时间根据切片的厚度和组织不同而定);染色后用蒸馏水轻轻冲洗,用0.5%冰乙酸分化切片,直到细胞核和颗粒清晰可见;用95%乙醇和无水乙醇使组织切片快速脱水,经二甲苯透明后用中性树胶封固组织切片。光学显微镜下随机观察5个视野,统计MCs及其脱颗粒状况。
1.7 细胞因子检测使用 ELISA定量检测试剂盒分别测定小鼠血清中TNF-α和IL-10水平,具体操作方法按照说明书进行。每孔加入50 μL Assay Diluent RD1-63或Assay Diluent RD1W,再加入50 μL 标准品、样品,室温孵育2 h;每孔加入400 μL洗液,除去残液,总共洗涤5次;每孔加入100 μL Mouse TNF-α Conjugate或Mouse IL-10 Conjugate,室温孵育2 h;洗涤5次,加入100 μL Substrate Solution,避光室温孵育30 min;加入100 μL Stop Solution,测定各孔D450 nm与D570 nm值。
1.8 FMDV特异性抗体检测采用间接ELISA方法检测血清中FMDV特异性IgG抗体。用VP1蛋白包被96孔板底部,4℃过夜;PBST洗涤3次后,用封闭液 (5%脱脂牛奶,PBS配制) 37℃封闭1 h;加入血清样本,37℃孵育1 h;加入山羊抗小鼠HRP-IgG抗体,37℃孵育1 h;加入TMB底物,孵育后终止,测定各孔D450 nm值。
1.9 统计学处理将细胞因子ELISA试验所获得数据用ELISACalc软件绘制标准曲线并对结果进行分析。使用GraphPad Prism 6.0 绘图并使用Two-way ANOVA 方法进行统计学分析。
2 结果
2.1 FMDV-VLP的Western blot鉴定结果如图1A所示,在约47 kDa处出现1条蛋白条带,与预期大小相符;将蛋白转膜后通过Western blot鉴定,在47 kDa处可见特异性条带,与预期大小相符,表明纯化的蛋白为FMDV-VLP(图1B)。
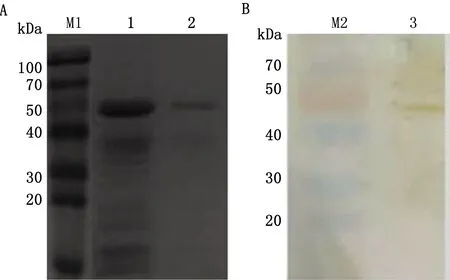
A.FMDV VLP的SDS-PAGE结果(M1.蛋白Marker;1.纯化前的转染后60 h细胞培养上清;2.纯化后的转染后60 h细胞培养上清)。B.FMDV VLP的Western blot鉴定结果(M2.蛋白Marker;3.纯化后的转染后60 h细胞培养上清)图1 FMDV VLP的SDS-PAGE分析和Western blot鉴定
2.2 FMDV-VLP的透射电镜鉴定结果如图2所示,FMDV-VLP直径大约为30 nm,表明FMDV VP1-VP4 可以通过乙肝病毒核心抗原自组装成FMDV-VLP。
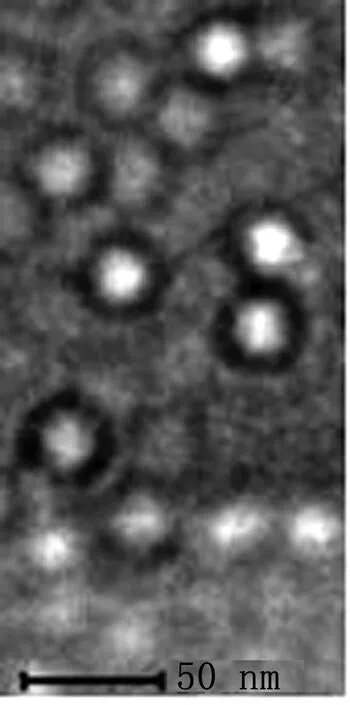
图2 FMDV-VLP的透射电镜观察结果
2.3 FMDV-VLP诱导小鼠MCs脱颗粒的观察对小鼠皮肤、颌下淋巴结、脾脏和颌下腺切片的甲苯胺蓝染色(图3,4)显示,14 dpi,MCs主要分布在表皮的小血管周围结缔组织中,并且VLP组MCs明显脱颗粒,基本处于完全活化状态;28 dpi,VLP组MCs在皮下组织中开始增多,且脱颗粒的MCs有增多的趋势。在颌下淋巴结中,MCs主要分布在被膜下窦、副皮质区和髓质中;PBS组髓质中MCs非常少;14 dpi,VLP组髓质中MCs脱颗粒数量增多但不聚集,呈现分散状态;而28 dpi,VLP组髓质中MC脱颗粒数量增多且呈聚集状态。在脾脏中,MCs主要分布在脾索、脾窦及边缘区,在被膜上和小梁内未见MC分布,且脾窦中MCs脱颗粒数量有从PBS组至VLP组,从14~28 dpi有增多的趋势。在颌下腺中,MCs散在分布于腺泡和腺导管周围,且MCs脱颗粒数量亦有从PBS组至VLP组,从14~28 dpi 有增多的趋势。以上结果表明,FMDV-VLP可在体内诱导小鼠MCs脱颗粒,由于接触抗原的时间顺序不同,在14 dpi,VLP组皮肤中主要是表皮内的MCs脱颗粒,而淋巴结中则主要是被膜下窦的MCs脱颗粒;在28 dpi,在VLP组皮肤中,主要是皮下组织中的MCs脱颗粒,而在淋巴结中,则主要是深层髓质的MCs脱颗粒。

注:箭头指向MCs;VLP组左侧一列为200倍放大的小鼠组织,右侧一列为400倍放大的小鼠组织;PBS组左侧一列为200倍放大的小鼠组织,右侧一列为400倍放大的小鼠组织图3 14 dpi组织中MCs甲苯胺蓝染色结果

注:箭头指向MCs; VLP组左侧一列为200倍放大的小鼠组织,右侧一列为400倍放大的小鼠组织;PBS组左侧一列为200倍放大的小鼠组织,右侧一列为400倍放大的小鼠组织.图4 28 dpi组织中MCs甲苯胺蓝染色结果
用甲苯胺蓝对组织切片染色,在光学显微镜下随机选取5个视野统计MCs的数量,用GraphPad Prism 6.0软件做图并进行统计。如图5显示,14 dpi VLP组的皮肤(P<0.01)、淋巴结(P<0.01)和脾脏(P<0.05)中MCs脱颗粒的数目均显著高于14 dpi PBS组,而14 dpi VLP组的颌下腺与14 dpi PBS组无显著性差异。28 dpi VLP组的皮肤、淋巴结、脾脏MCs脱颗粒的数目均极显著高于28 dpi PBS组(P<0.01),而28 dpi VLP组的颌下腺亦显著高于28 dpi PBS组(P<0.05)。结果表明,FMDV VLP可以诱导皮肤、淋巴结、脾脏和颌下腺中的MCs 脱颗粒,特别是皮肤和淋巴结的MCs;加强免疫后,VLP可以显著提高皮肤和脾脏内MCs活化水平(P<0.01)。
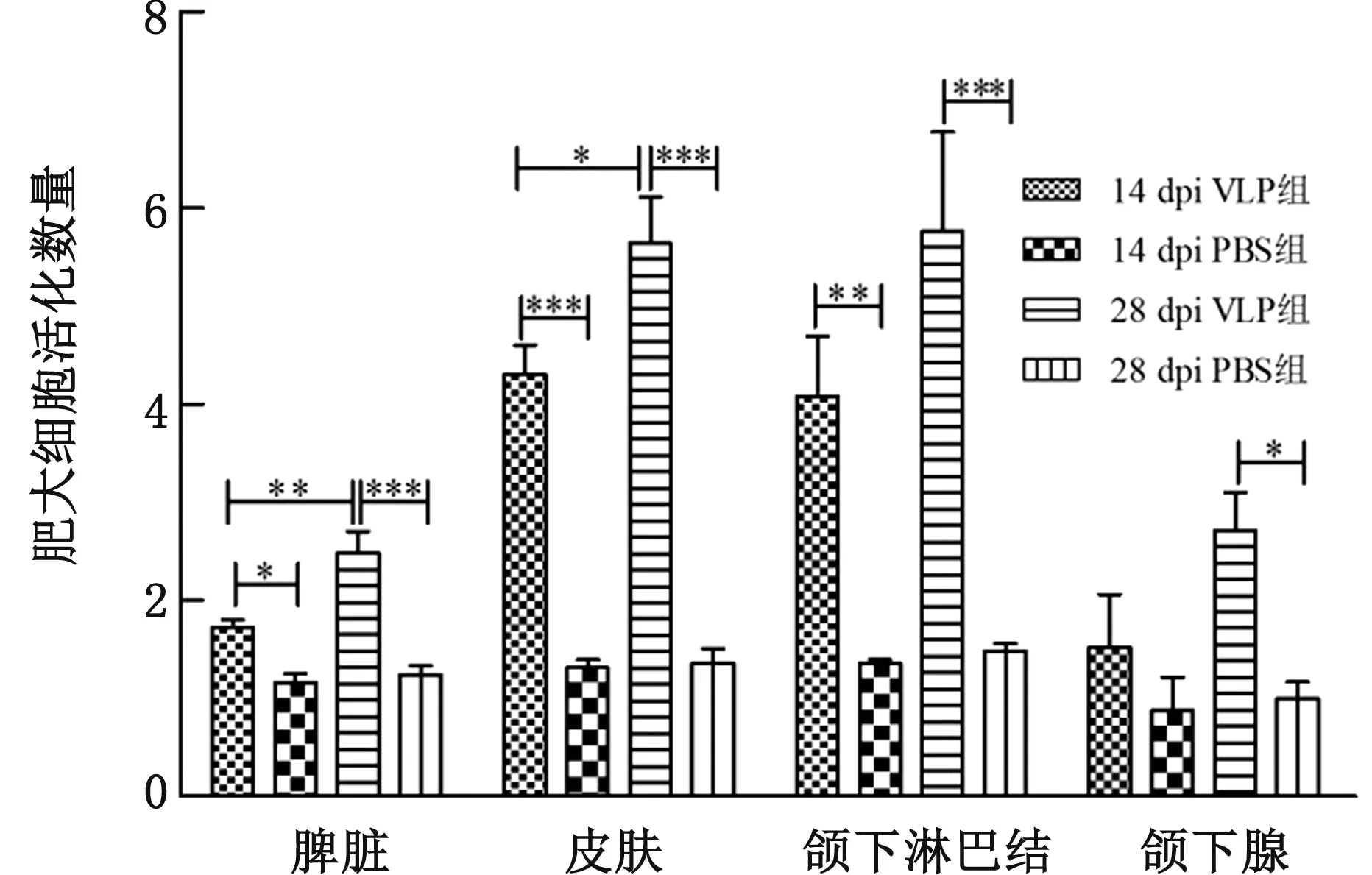
注:活化既包含体积变大的MCs和正在脱颗粒的细胞,又包括已经脱颗粒细胞质空泡化的MCs。***表示P<0.001;**表示P<0.01; *表示P<0.05;下同图5 小鼠组织MCs活化数量统计图
2.4 血液细胞因子检测采用ELISA法检测小鼠血清中TNF-α与IL-10水平,如图6所示,无论是初次免疫后还是再次免疫后,VLP组血清中TNF-α水平均显著高于对照组(P<0.05),而IL-10 水平无论是初次免疫后还是再次免疫后VLP组均与对照组没有统计学差异(P>0.05)。

图6 小鼠血清中TNF-α和IL-10水平
2.5 血清中FMDV-VLP特异性IgG检测用间接ELISA法检测血清中FMDV特异性IgG抗体,如图7所示,在14 dpi,试验组血清FMDV特异性 IgG呈阴性,而在28 dpi,试验组血清 IgG呈阳性,且显著高于14 dpi试验组的血清IgG水平。结果表明,加强免疫FMDV-VLP可以诱导机体产生良好的IgG免疫应答。
注:- -表示阴性和阳性的临界值图7 小鼠血清中FMDV特异性IgG抗体水平
3 讨论
MCs主要分布在皮肤、胃肠道以及鼻黏膜等病原微生物初次接触机体的场所,在抗细菌、抗寄生虫、抗病毒感染方面发挥重要作用[19-21]。MCs可通过其表面表达的多种模式识别受体识别病原微生物及其结构蛋白,引发自身活化,分泌预先储存的或新合成的颗粒,从而调节免疫应答,这对于科学设计FMDV 新型疫苗及正确使用FMDV 疫苗具有积极的指导意义。
已有的研究表明,FMDV-VLP可以诱导小鼠腹腔MCs(pMCs)脱颗粒,该过程由TLR2介导[16]。梁慧婷等[18]发现FMDV-VLP 刺激PMCs可引起明显的脱颗粒,pMCs脱颗粒产物对脾总淋巴细胞的增殖具有一定的促进作用。目前,关于MCs负载FMDV-VLP后脱颗粒水平的研究主要基于pMCs,并且是建立在体外模型的基础上。本研究对FMDV-VLP诱导小鼠体内组织MCs应答效应进行分析,试验结果显示,FMDV-VLP可以诱导皮肤、淋巴结、脾脏和颌下腺中的MCs 脱颗粒,且加强免疫后VLP可以显著提高皮肤和脾脏内MCs活化水平,这一发现将有助于进一步探究VLP对DC迁移和IgG形成的作用。
本研究发现FMDV-VLP刺激机体后TNF-α分泌显著升高,IL-10分泌无影响,且加强免疫后FMDV-VLP可以诱导小鼠体内组织中的MCs脱颗粒,VLP组皮肤、颌下淋巴结、脾脏和颌下腺内MCs的脱颗粒现象明显强于对照组。这一结果提示,如果有病原侵入皮肤,MCs会迅速作出应答。研究证实,MCs活化后可以促进DC和淋巴细胞向引流淋巴结迁移[15],而加强免疫后淋巴结中脱颗粒的MCs增多,意味着其促进其他部位DC向淋巴结迁移的可能性增大,这对于启动抗FMDV适应性免疫应答可能会起到十分积极的作用。脾脏主要应对血源性病原微生物,而皮下注射50 μg FMDV-VLP不一定能进入脾脏,所以脾脏MCs脱颗粒现象没有皮肤和淋巴结明显。MCs活化后可以分泌多种细胞因子和活性物质,在免疫调节方面发挥重要作用[22-23],这使得MCs活化剂或MCs脱颗粒产物表现出一定的免疫佐剂潜力。研究显示,MCs活化后可以诱导机体产生高水平的抗原特异性血清IgG[15],而这种现象的产生与MCs脱颗粒成分密切相关,其可以招募DC和淋巴细胞向引流淋巴结迁移,从而诱导机体产生高水平的体液免疫应答。本研究结果证明,小鼠免疫FMDV-VLP后可以引起组织中MCs活化,同时诱导机体产生较强的IgG应答,这为进一步探究FMDV-VLP在体内引起的免疫应答机制提供了理论基础。
本研究首次在体内探究了FMDV-VLP对鼠MCs脱颗粒的影响,表明VLP可以诱导组织内MCs脱颗粒,促进机体分泌TNF-α,并产生较强的IgG应答,提示MCs脱颗粒产物在诱导小鼠机体产生IgG应答方面可能发挥促进作用。在后续试验中,我们将结合MCs脱颗粒成分可以有效辅助VLP诱导机体产生免疫应答的现象,开发可以与VLP共同应用的免疫佐剂,为VLP疫苗新型佐剂的研发提供新思路与新方法。

