miR-634靶向CDCA5基因对非小细胞肺癌增殖、凋亡的影响
白燕 郭英 余宏鑫 王正煜 庞秋菊 贺凡 周庆元
(三二〇一医院呼吸与危重症医学科,陕西 汉中 723000)
非小细胞肺癌(NSCLC)是肺癌中最常见的组织学类型,约占肺癌总数的80%,其中约75%的患者发现时已经处于中晚期,是威胁人类健康的重大疾病之一,目前尚缺乏根治方法,5年生存率很低〔1,2〕。因此阐明NSCLC发生发展的机制,对改善非NSCLC的诊断方法和提高治疗效果意义重大。miRNA是一类内源性单链非编码小RNA分子,通过与靶基因的3′UTR结合,在转录后水平调控基因的表达,其异常表达与肿瘤的发生发展密切相关〔3~5〕。研究表明,miR-634在宫颈癌组织表达水平显著低于正常组织,miR-634可通过抑制mTOR的表达来抑制宫颈癌细胞的增殖、迁移和侵袭〔6〕;miR-634在肝癌组织和细胞中均为低表达,上调其水平可抑制肝癌细胞增殖、侵袭并诱导其凋亡〔7〕;miR-634在胶质瘤组织中表达下调,LncRNA DANCR在胶质瘤组织中表达升高,干扰 DANCR的表达调控miR-634的表达上调抑制胶质瘤细胞的增殖〔8〕。但miR-634在NSCLC细胞的增殖、凋亡的影响和具体分子机制目前还未见报道,因此本课题就miR-634在NSCLC中的表达情况及其对NSCLC细胞增殖、凋亡的影响和其具体机制展开研究,以期为NSCLC的早期诊断和治疗提供新的思路。
1 材料与方法
1.1材料 正常肺上皮细胞BEAS-2B和NSCLCA549、H1299、H1650细胞购自中科院上海生化细胞所细胞库;胎牛血清购自Gibco;1640培养基、胰蛋白酶购自Sigma;LipofectamineTM2000、Trizol总RNA抽提试剂购自Invitrogen;荧光定量试剂盒购自Roche;Western印迹用兔抗人CDCA5抗体购自Sigma Aldrich;CCK-8试剂购自Amresco;细胞凋亡试剂盒购自南京凯基公司。
1.2方法
1.2.1细胞培养采用含10%FBS、 160万U庆大霉素/ml的RPMI1640培养基培养细胞,并置于37℃、5%CO2、pH值7.2~7.4的无菌恒温培养箱中培养,选择对数生长期细胞进行后续实验。
1.2.2实时PCR 根据Trizol法抽提总RNA,催化逆转录合成cDNA,运用荧光定量qPCR试剂盒在实时荧光定量PCR仪上进行扩增,检测细胞中miR-634和CDCA5 mRNA的表达水平。miR-634引物为:上游5′-CCUUCAAUUUGACCGUCCU-3′,下游5′-AAUAAAACCAGGUCGAAUAGGU-3′;CDCA5引物为:上游5′-CCAGCCA G AAGTTAAAGG-3′,下游5′-AAGCCACCAACAGAAGG-3′;以U6为内参,引物为:上游5′-CTCGCTTCGGCAGCACA-3′,下游:5′-AACGCTTCACGAATTTGCGT-3′。反应条件:95℃ 30 s,60℃ 5 s,72℃ 1 min,共35个循环。所得结果直接在荧光定量操作系统进行比较分析,目标基因的相对定量用2-ΔΔCT计算。
1.2.3Western印迹法检测蛋白的表达 收集各组细胞,用RIPA细胞裂解液提取总蛋白并采用二喹啉甲酸(BAC)法测定蛋白浓度。各组蛋白上样后,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),电转至硝酸纤维素膜,用5%脱脂牛奶封闭1 h,加入1抗并摇床4℃孵育过夜,TBST洗涤2次,每次6 min,后加入相应二抗并室温孵育1 h,TBST洗涤2次,每次6 min,进行荧光显色10 min。
1.2.4细胞转染 收集对数生长期NSCLC A549细胞,用胰酶消化,接种于6孔板上,待细胞生长至70%时,按照脂质体LipofectamineTM2000转染试剂说明书将过表达miR-634的模拟物及其miR阴性对照分别转染至A549细胞中,分别标记为miR-634组和miR-NC组。转染4 h后,更换含血清的新鲜培养液继续培养48 h,收集各组细胞并采用RT-PCR检测转染效果。后续实验中,将A549细胞随机分为si-CDCA5组(转染沉默CDCA5的siRNA)、si-NC组(转染沉默CDCA5的阴性对照)、anti-miR-634组(转染干扰miR-634的模拟物)、anti-miR-NC组(转染干扰miR-634的阴性对照)、miR-634+pcDNA-CDCA5组(miR-634模拟物与pcDNA-CDCA5真核载体共转染)、miR-634+pcDNA组(miR-634模拟物与pcDNA空载体共转染)6组,采用上述方法转染后进行后续实验。
1.2.5CCK-8法检测细胞的增殖 按照每孔1×104个细胞每孔接种于96孔板,各组设4个复孔,放在37℃、5%CO2的培养箱中培养,至细胞密度长到50%~60%,每孔加入10 μl CCK溶液,继续培养,分别在24 h、48 h、72 h时检测490 nm处吸光度值。实验重复3次。
1.2.6流式细胞术检测细胞的凋亡 收集各组待测细胞,以每孔1×105个细胞种植于6孔板,根据AnnexinV-FITC试剂盒处理细胞,简要步骤如下:用缓冲液重悬细胞,轻摇至均匀避光孵育15 min,加入适量AnnexinV-FITC,避光条件下孵育15 min,采用流式细胞仪检测凋亡情况。
1.2.7双荧光素酶基因报告实验 采用TargetScan(http://www.targetscan.org/ )靶基因预测库预测到miR-634与CDCA5存在结合位点。猜测miR-634可能是CDCA5的一个靶基因。为验证这一猜想,构建野生型WT-CDCA5和突变型MUT-CDCA5的荧光素酶报告载体。参照1.2.4方法LipofectamineTM2000将miR-NC和miR-634分别与WT-CDCA5和MUT-CDCA5共转染,置于细胞培养箱中常规培养48 h。收集各组细胞,参照双荧光素酶基因报告实验检测试剂盒操作步骤进行检测。
1.3统计学方法 采用SPSS22.0软件进行t检验、单因素方差分析、SNK-q检验。
2 结 果
2.1NSCLC中miR-634、CDCA5的表达 与正常肺上皮BEAS-2B细胞相比,NSCLC A549、H1299、H1650细胞中miR-634表达水平均显著下降,CDCA5 mRNA和蛋白的表达量均显著升高(P<0.05)。见图1,表1。

图1 CDCA5蛋白在NSCLC和正常肺上皮细胞中的表达

表1 检测NSCLC和正常肺上皮细胞中miR-634和CDCA5的表达
2.2过表达miR-634抑制NSCLC A549细胞的增殖 与miR-NC组相比,miR-634组NSCLC miR-634表达水平明显升高(P<0.05),成功构建了miR-634过表达的A549细胞。与miR-NC组相比,miR-634组细胞周期蛋白(Cyclin)D1表达量显著下降,p21和p27蛋白表达量显著上升(P<0.05);转染24 h后,miR-634Z组细胞活性较miR-NC组显著下降(P<0.05),见表2,图2。可见miR-634对NSCLC A549细胞的增殖具有抑制作用。

表2 过表达miR-634对NSCLC A549细胞增殖及相关增殖蛋白的影响

图2 miR-634过表达对NSCLCA549细胞增殖相关蛋白表达的影响
2.3过表达miR-634促进NSCLCA549细胞的凋亡 miR-634组凋亡率较miR-NC组显著上升(P<0.05),凋亡相关蛋白B细胞淋巴瘤(Bcl)-2表达量显著下降,Bcl-2相关X蛋白(Bax)和酶切含半胱氨酸的天冬氨酸蛋白水解酶(caspase)-3表达量显著上升(P<0.05),可见过表达miR-634对肺癌A549细胞的凋亡有促进作用。见图3,图4,表3。
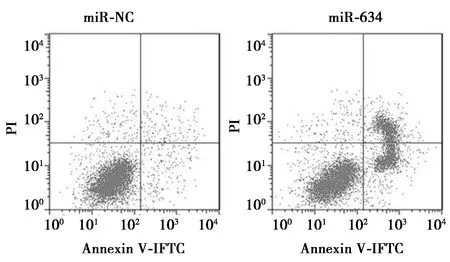
图3 细胞凋亡流式图

图4 miR-634过表达对NSCLC A549细胞凋亡相关蛋白表达的影响

表3 过表达miR-634对NSCLC A549细胞的凋亡及其相关蛋白的影响
2.4沉默CDCA5表达抑制NSCLC A549细胞的增殖并促进其细胞凋亡 与si-NC组相比,si-CDCA5组CDCA5蛋白表达量显著下降(P<0.05),表明成功构建了沉默CDCA5表达的A549细胞。转染24 h后,CDCA5组细胞活性无显著差异(P>0.05),转染48 h和72 h后,si-CDCA5组细胞活性较si-NC组显著下降(P<0.05);si-CDCA5组较si-NC组CyclinD1蛋白表达量明显降低,p21蛋白表达量明显上升(P<0.05),可见沉默CDCA5的表达抑制了肺癌细胞的增殖。与si-NC组相比,si-CDCA5组细胞凋亡率显著上升,Bcl-2蛋白表达量明显下降,Bax蛋白表达量明显上升(均P<0.05),可见抑制沉默CDCA5的表达抑制肺癌细胞的凋亡。见表4,图5。

图5 沉默CDCA5的表达对NSCLCA549细胞增殖和凋亡相关蛋白表达的影响

表4 沉默CDCA5的表达对NSCLC A549细胞增殖和凋亡的影响
2.5miR-634可靶向抑制CDCA5的表达 TargetScan(http://www.targetscan.org/ )软件预测结果表明miR-634和CDCA5之间存在互补结合位点,见图6。与miR-NC与WT-CDCA5共转染相比,miR-634与WT-CDCA5共转染后细胞荧光素酶活性显著降低,但miR-NC、miR-634分别与miR-CDCA5共转染后细胞的荧光素酶活性无明显变化(P<0.05),见表5,可见miR-634对CDCA5具有靶向作用。与miR-NC组CDCA5蛋白(0.67±0.06)相比,miR-634组(0.29±0.03)显著下降(P<0.05),anti-miR-634组CDCA5蛋白表达量(0.98±0.09)较anti-miR-NC组(0.63±0.06)显著升高(P<0.05),见图7,可见miR-634可负向调控CDCA5的表达。

图7 Western印迹检测CDCA5的表达

表5 双荧光素酶报告实验

图6 miR-634与CDCA5互补的核苷酸序列
2.6过表达CDCA5可逆转过表达miR-634对NSCLCA549细胞增殖和凋亡的影响 与miR-634+pcDNA组相比,miR-634+pcDNA-CDCA5组CDCA5、CyclinD1蛋白表达显著上升,p21蛋白表达显著下降(P<0.05);转染48 h后,miR-634+pcDNA-CDCA5组较miR-634+pcDNA组细胞活性显著升高(P<0.05);与miR-634+pcDNA组相比,miR-634+pcDNA-CDCA5组Bcl-2蛋白表达量明显上升,Bax蛋白和细胞凋亡率显著下降(P<0.05)。见表6,图8。可见过表达CDCA5能逆转过表达miR-634对NSCLCA549细胞增殖和凋亡的影响。

表6 过表达CDCA5逆转过表达miR-634对NSCLC A549细胞增殖凋亡的影响
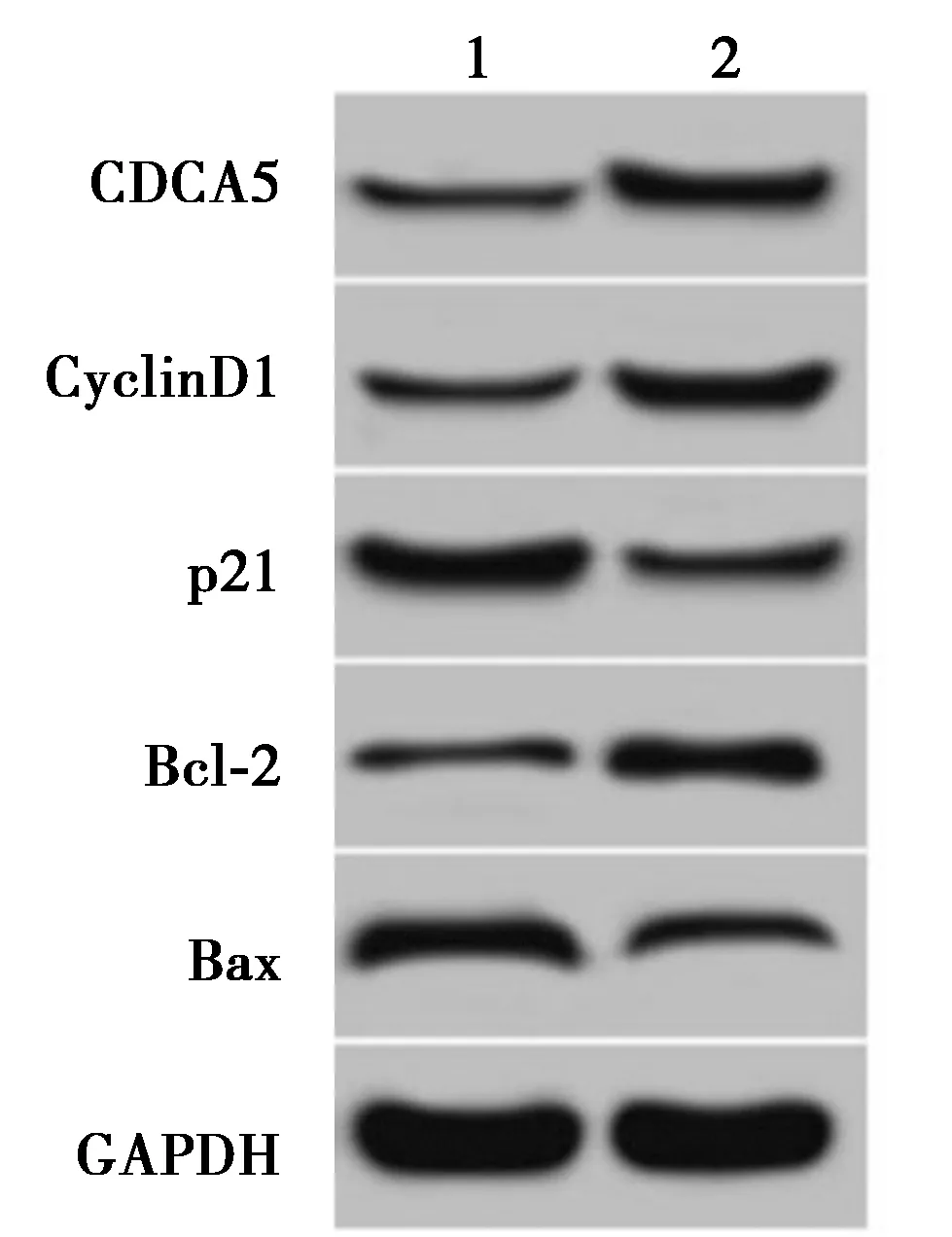
1~2:miR-634+pcDNA组,miR-634+pcDNA-CDCA5组图8 过表达CDCA5逆转过表达miR-634对NSCLCA549细胞增殖凋亡相关蛋白表达的作用
3 讨 论
肺癌是当今严重威胁人类健康的疾病,是我国发生率和死亡率最高的恶性肿瘤。NSCLC在肺癌的病理细胞学分析中最常见,由于NSCLC起病隐匿,初期症状无特异性,所以当确诊时多已经出现局部或者远处转移而失去手术切除根治的机会〔9,10〕,且很多患者的癌细胞对放化疗存在耐受性,因此,急需治疗NSCLC的新方法来提高患者的远期生存率和改善患者的生活质量。研究表明,miRNAs的异常表达与很多肿瘤的发生发展有关〔11~13〕。miRNA可通过调控下游靶基因的表达,参与肿瘤细胞的增殖、侵袭和转移,进而影响癌症的发展,并可作为预测癌症发生发展的指标〔14〕,故找到与癌症相关的miRNAs及下游靶基因将有利于癌症的治疗。研究发现,miR-634在宫颈癌、肝癌、胶质瘤、胰腺癌组织和细胞中表达下调,起到抑癌基因的作用〔15〕。CDCA5定位于人染色体11q13.1,确保有丝分裂后期姐妹染色单体准确分离〔16〕。研究表明,CDCA5的异常表达会导致细胞生长失去调控,并介导肿瘤的发生发展〔17〕,Zhang等〔18〕发现CDCA5胃癌组织中的表达显著上调,下调其表达可抑制胃癌细胞的增殖;陈野圳〔19〕发现沉默CDCA5基因有效抑制肝癌细胞的增殖;彭洪等〔20〕发现CDCA5在乳腺癌组织中表达明显高于癌旁组织,沉默CDCA5的表达能有效抑制乳腺癌细胞增殖。研究发现,在NSCLC的发生发展的过程中,CDCA5的表达逐渐升高〔21〕。本研究提示CDCA5是miR-634的下游靶基因。

