支撑喉镜-鼻内镜下治疗伴声音嘶哑喉良性病变的效果观察
张庆辉
(方城县人民医院耳鼻喉科,河南 南阳 473200)
喉良性病变类型较多,包括声带小结、声带息肉等,多见于过度发声或用嗓不当人群,在临床耳鼻喉科中属多发病,伴有声音嘶哑、喉部疼痛等症状,影响患者工作与生活[1]。喉良性病变患者保守治疗常复发,多数需接受手术切除,由于喉部视野暴露难度大,单纯支撑喉镜技术定位不准确,影响手术效果,随着内镜技术发展,鼻内镜逐渐应用于喉良性病变中,效果良好[2]。本文观察支撑喉镜-鼻内镜下喉良性病变摘除术效果,现报道如下。
1 资料与方法
1.1 一般资料
选择2018年1月至2019年8月本院收治的伴声音嘶哑喉良性病变患者94例,根据治疗方法不同分为对照组(n=46)和研究组(n=48)。对照组男18例,女28例;年龄22~65岁,平均(41.98±9.95)岁;病程6~32个月,平均(18.55±6.21)个月;其中声带息肉21例,会厌囊肿12例,声带小结10例,其他3例;病变部位:左侧23例,右侧16例,双侧7例。研究组男19例,女29例;年龄23~65岁,平均(43.71±10.12)岁;病程6~30个月,平均(17.61±5.64)个月;其中声带息肉23例,会厌囊肿11例,声带小结9例,其他5例;病变部位:左侧22例,右侧17例,双侧9例。两组患者一般资料对比,差异无统计学意义(P>0.05),具有可比性。
1.2 入选标准
(1)纳入标准:①患者因声音嘶哑入院检查,经喉镜检查、嗓音评估、病理检查确诊为喉良性病变;②药物保守治疗无效,符合手术适应证;③无严重出血性疾病或内科疾病;④临床资料完整。(2)排除标准:①喉结核、喉部恶性肿瘤等其他声带病变者;②癔症性声嘶或心因性发声困难者;③合并严重高血压、肺心病等心肺功能不全者;④合并上呼吸道感染者;⑤认知功能不全或伴有精神疾病者;⑥颈部外伤史或喉部手术史者。
1.3 方法
两组均在术前3d避免频繁用嗓,接受常规喉镜检查。
1.3.1 研究组
予以支撑喉镜-鼻内镜下病变摘除术治疗。气管插管全麻,实时监测生命体征、脑电双频谱指数(BIS)等,予以骨骼肌松弛药,头稍后仰,垫肩,固定头部,使用纱布保护门齿、嘴唇,经口插入支撑喉镜(左手提起硬管,右手拇指将其托起,右手其余4指合拢,下压上颌,插入喉腔,显露声带后部分,固定支撑喉镜),左手持鼻内镜(30°或70°)经支撑喉镜管内进入,于高清显示屏观察病变情况,分辨病变界限,术者右手持喉显微手术刀,于病变组织处切开(平行)声带,咬除病变,并清除黏膜下水肿、渗出疏松组织,于显示屏上窥见突起游离组织,修剪多余息肉黏膜及纤维组织,保证声带边缘修平,注意不可撕扯,结束前再次用鼻内镜检查喉部声带表面、喉室等是否有病变残留,对出血点给予肾上腺素(国药准字H41021054,遂成药业股份有限公司)棉球加压止血,将切除组织送病理检查。
1.3.2 对照组
予以支撑喉镜下病变摘除术治疗。采用1%丁卡因(国药准字H20093124,悦康药业集团股份有限公司)进行表面麻醉,患者取平卧位,在患者口腔内缓慢置入支撑喉镜,注意保护患者上切牙,将支撑喉镜放在护胸板上,明确病变部位、大小、根基,显露患者声门、声带等部位,在喉显微镜下直接使用翘头喉钳切除病变组织,将组织保存送检,然后修整手术创面与声带边缘,保证其平整,止血方法同研究组。
两组均在术后静脉滴注抗生素3d,雾化吸入地塞米松(国药准字H14020112,云鹏医药集团有限公司)5d,完全禁声1周,之后1周开始适当发声,避免声带黏连,期间避免辛辣刺激食物,禁烟酒。
1.4 观察指标
(1)手术效果:术后镜检病变完全清除,术后1个月声带边缘光滑,声门闭合良好,无充血,声音恢复正常为治愈;术后镜检病变清除,术后1个月声门闭合,边缘较为光滑,有轻微出血,发声较术前明显好转为有效;术后镜检病变组织清除,但声带明显充血肿胀,声门未闭合为无效。总有效率=(治愈例数+有效例数)/总例数×100%。(2)嗓音声学:使用多功能声学分析设备(德国XION)分析术前及术后1个月嗓音声学指标,保持周围环境安静,设置环境噪声<40dB,话筒与患者口距为5~10cm,按照要求发指定音调,录制3次,并保存,读取声样中振幅微扰(shimmer)、谐噪比(H/N)、基频微扰(jitter),取3次数值平均值。(3)疼痛介质:于术前及术后12h采集两组静脉血,转速3000r/min,离心10min,取血清,血清β-内啡肽(β-EP)水平使用酶联免疫吸附法检测,血清前列环素(PGI2)及神经肽Y(NPY)水平使用放射免疫法测定,上述试剂盒均来自上海泽叶生物科技有限公司。(4)并发症:统计比较两组感染、黏膜损伤、舌麻、声带黏连发生情况。(5)复发率:1年复诊监测中,患者重新出现声音嘶哑,镜检显示,病变组织重新长出,为复发。
1.5 统计学方法
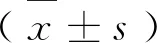
2 结果
2.1 手术效果
研究组总有效率为93.75%,对照组总有效率为76.09%,差异有统计学意义(P<0.05)。见表1。

表1 两组手术效果比较[n(%)]
2.2 嗓音声学
术后1个月研究组shimmer、jitter水平较对照组降低,H/N水平较对照组高(P<0.05)。见表2。
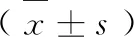
表2 术前术后两组嗓音声学比较
2.3 疼痛介质
术后12h两组血清NPY、β-EP、PGI2均较术前升高,研究组低于对照组(P<0.05)。见表3。
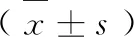
表3 术前术后两组疼痛介质水平比较
2.4 并发症发生率与术后1年复发率
研究组并发症发生率及术后1年复发率均低于对照组(P<0.05)。见表4。
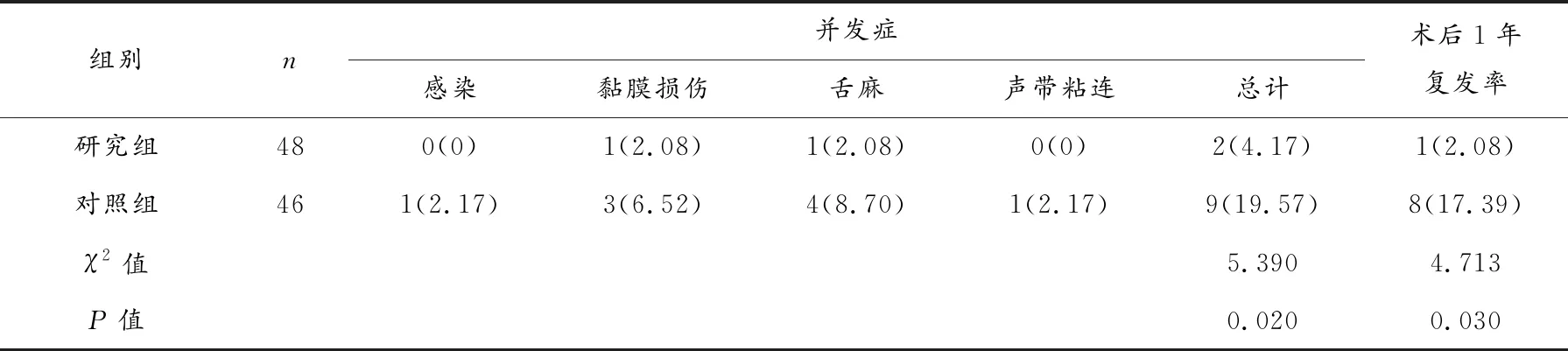
表4 两组并发症发生率与术后1年复发率比较[n(%)]
3 讨论
喉良性病变实质是在不同病因刺激下,引起喉部边缘血管扩张与组织水肿,导致水肿样纤维增生,出现声嘶与疼痛,切除病变组织是治疗的关键,可从根本解除病变,促进患者嗓音功能恢复[3-4]。
支撑喉镜技术发展成熟,可双手同时操作,治疗效果肯定,但受其镜身硬性直管状设计的影响,其仅能提供垂直轴视线,难以获取广角术野,暴露有限,易出现病变组织切除遗漏,且部分患者由于舌根颈粗短,增加视野暴露难度,影响整体手术效果[5]。对于上述缺陷,临床考虑联合鼻内镜进行手术操作,发挥鼻内镜控制旋转、自动调焦的优势,获取宽阔且清晰的视野,提高手术效果[6-7]。本文结果显示,研究组总有效率高于对照组,术后1个月shimmer、jitter、H/N水平优于对照组,且1年复发率低于对照组(P<0.05),说明支撑喉镜-鼻内镜下病变摘除术效果肯定,对嗓音功能改善效果明确,可保证长期效果,主要是全麻下患者声门松弛,可降低手术难度,鼻内镜经支撑喉镜插入后,可360°旋转,且具有放大功能,术野暴露广泛,避免咽喉损伤,且可绕过室带边缘对喉室、声门区等多个部位进行检查,更为精准,以减轻咽喉功能损伤,保障嗓音功能恢复,进而提高总有效率;其可对暗角及细小病变进行切除,最大程度切除病变组织,从而降低术后复发风险。另外在既往支撑喉镜术式应用过程中发现,黏膜损伤、舌麻等并发症发生较多,手术安全性有待提高,而应用支撑喉镜-鼻内镜下病变摘除术治疗,研究组并发症发生率低于对照组(P<0.05),说明本术式在最大程度切除病变组织的基础上,还提高手术定位准确性,降低其他黏膜、组织、神经等损伤发生风险,降低相关并发症发生率。同时在应用本术式时应注意,由于该术式为全麻操作,对于合并严重心肺疾病等患者禁用,对术者操作要求较高,应交付技术熟练的术者操作,以保证手术质量。
手术切除本身作为一种有创操作,可引起患者强烈的疼痛应激反应,在一定程度上影响手术效果,PGI2、β-EP属于强大的疼痛介质,可促进痛觉传导,在术后患者中呈高表达状态;而NPY属于保护介质,可抑制疼痛反应[8-9]。本文从疼痛介质方向分析支撑喉镜-鼻内镜下病变摘除术对患者手术应激的影响,结果显示,术后12h研究组血清NPY、β-EP、PGI2水平低于对照组(P<0.05)。在鼻内镜应用下分辨率高,清晰明亮,可窥清喉部组织全貌,对细微病变可做到精准切除,避免误伤其他正常组织,且在全麻应用下可提供良好手术条件,从而减轻手术疼痛应激。
综上,支撑喉镜-鼻内镜下病变摘除术治疗伴声音嘶哑喉良性病变患者,在提高手术总有效率、改善患者嗓音功能、降低并发症发生风险及复发率、减轻疼痛应激方面更具优势。

