去甲斑蝥素抑制基质金属蛋白酶-9蛋白表达对前列腺癌PC-3细胞迁移及侵袭力的影响
雒向宁,王文娟,李 凯,尤建军,张会波,刘 凯,杜宏宏,王 冬
前列腺癌是最常见的男性生殖系统恶性肿瘤,多见于60岁以上的老年男性。近10年以来,我国的前列腺癌发病率也呈逐年上升趋势,与发达国家比较,我国患者的初诊晚期前列腺癌发病率更高[1],无法进行根治性手术治疗。绝大多数晚期前列腺癌患者起初对抑制雄激素的药物治疗敏感。然而,经抑制雄激素的内分泌治疗平均2.5年后,上述患者均将转化为激素抵抗性前列腺癌(hormone refractory prostatecancer,HRPC),即对抑制雄激素的内分泌治疗无反应。HRPC病情进展迅速,生存期一般不超过18个月,但其发生机制至今仍未阐明,因此,探索HRPC的发生和进展机制并研发有效的治疗药物成为近年的研究热点。基质金属蛋白酶(matrix metalloproteinases,MMPs)现已被证实参与多种肿瘤的浸润、侵袭和远处转移过程。目前已有26种不同的MMPs成员被发现,其中MMP-9能够降解和破坏肿瘤细胞外基质,促进侵袭性伪足形成[2]。去甲斑蝥素(norcantharidin, NCTD)是从斑蝥虫体内提取的斑蝥素的去甲基化类似物[3]。NCTD具有较强的抗癌活性,目前已应用于多种恶性肿瘤的临床治疗。本实验重在研究NCTD能否下调前列腺癌PC-3细胞MMP-9蛋白表达,进而抑制PC-3细胞的侵袭力。
1 材料与方法
1.1 细胞株 前列腺癌PC-3细胞株购自上海细胞所国家细胞库。
1.2 主要试剂 NCTD(美国Aladdin公司,批号D131603-1g),顺铂(美国MCE公司,批号HY-17394),胞浆胞核蛋白提取试剂盒(南京凯基生物公司,批号KGP150),BCA蛋白浓度测定试剂盒(碧云天生物科技公司,批号P0010),小鼠单抗β-actin(武汉博士德生物工程有限公司,批号BM0627),鼠单抗MMP-9(美国abcam公司,批号Ab58803),transwell培养皿(美国Corning公司,批号 658042)。
1.3 主要仪器 实时荧光定量PCR仪(美国ABI公司),CO2恒温培养箱(日本SANYO公司),倒置显微镜(日本OLYMPUS公司),3001酶标仪(美国Thermo Fisher Scientific公司)。
1.4 细胞培养 PC-3细胞用含10%胎牛血清的完全培养基重悬,并置于37℃、 5% CO2细胞培养箱内培养。取对数生长期的PC-3细胞,加入预先配制不同浓度的含NCTD培养液,使NCTD最终浓度分别为12.5 μg/mL、25 μg/mL 和50 μg/mL,同时设立空白对照组和阳性对照组(顺铂浓度2.5 μmol/L)。
1.5 实时荧光定量PCR实验 Trizol试剂分别提取各组PC-3细胞的总RNA,然后按照Real-time PCR试剂盒的操作说明进行。PCR引物由西安科昊生物工程有限责任公司合成,MMP-9的上游引物序列为5’- GCTACCACCTCGAACTTTGAC-3’,下游引物序列为5’- TCAGTGAAGCGGTAC ATAGGG -3’,内参照β-actin的上游引物序列为5’-AGCGAGCATCCCCCAAAGTT-3’,下 游 引物序列为 5’-GGGCACGAAGGCTCATCATT-3’。PCR反应条件:50℃ 2 min、95℃ 10 min;95℃ 30 sec、60℃ 30 sec,40个循环。实验中每个样品重复检测3次,绘制熔解曲线,最终数据以2-△△Ct进行分析。
1.6 Western-blot实验 取各组PC-3细胞,加入裂解液并在冰上放置30 min,4℃,12 000 r/min离心5 min,采用BCA蛋白浓度测定试剂盒测定上清蛋白含量。 取40 μg总蛋白进行SDS-PAGE电泳,转膜,质量分数5%脱脂奶粉封闭,加入一抗鼠单抗MMP-9后4℃过夜,以β-actin小鼠单抗为参照,再加入二抗HRP-标记羊抗鼠IgG,室温孵育1 h。ECL曝光成像,化学发光系统分析结果。
1.7 细胞划痕实验 分别取空白对照组、12.5 μg/mL NCTD组、25 μg/mL NCTD组、50 μg/mL NCTD组、顺铂 2.5 μmol/L组PC-3细胞,用1640培养基调整细胞密度到2.5×105个/mL,置入6孔板,每孔2 mL细胞悬液,37 ℃培养过夜;6孔板中每孔预先在背后,用200 μL的枪头垂直于背后的横线划痕,过夜培养后,用PBS洗细胞3次,去除划下的细胞,加入无血清培养基,处理24 h后,取样拍照。
1.8 Transwell实验 分别取空白对照组、12.5 μg/mL、25 μg/mL、50 μg/mL NCTD 组、顺铂2.5 μmol/L阳性对照组中2.5×105个PC-3细胞,Transwell小室的上室底部中央垂直加入100 μL终浓度为1 mg/mL的Matrigel,37℃温育4~5 h使其干成胶状,待Matrigel干成胶状后,在Transwell上室分别接入200 μL上述各组细胞悬液,37 ℃,5% CO2培养箱培养24 h,70%冰乙醇溶液固定细胞1 h,0.5%结晶紫染液染色,用PBS清洗1次,用干净的棉球将上室一侧的未迁移的细胞擦干净,显微镜下观察拍照。
1.9 透射电镜观察 取空白对照组、12.5 μg/mL、25 μg/mL、50 μg/mL NCTD 组、顺铂 2.5 μmol/L阳性对照组的PC-3细胞悬液10 μL,使用1×PBS 50倍稀释后,10 μL滴加至铜网,25℃干燥12 h,Uranyl acetate复染,透射电镜下观察伪足形态并拍照保存。
1.10 统计学方法 采用SPSS 16.0统计软件对数据进行分析,计量资料以表示,两组独立样本间差异比较采用t检验,多因素比较采用单因素方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 实时荧光定量PCR检测各组PC-3细胞MMP-9 mRNA含量 结果显示,浓度为12.5 μg/mL、25 μg/mL和50 μg/mL NCTD作用各组PC-3细胞48 h后,MMP-9 mRNA含量分别比空白对照组下降了 13%、39%和58%(P<0.05),且 50 μg/mL NCTD浓度组较顺铂阳性对照组的MMP-9 mRNA含量下降45%(P<0.05)。见图1。

图1 NCTD作用PC-3细胞后MMP-9 mRNA的含量
2.2 Western-blot检测各组PC-3细胞MMP-9含量 结果显示,NCTD 浓度 12.5 μg/mL、25 μg/mL和50 μg/mL组的MMP-9表达水平均低于空白对照组,且随着NCTD浓度增大、MMP-9蛋白表达水平均依次降低,其中50 μg/mL NCTD组MMP-9蛋白表达水平较空白对照组显著减少,差异有统计学意义(P<0.05),见图2。

图2 NCTD作用PC-3 细胞MMP-9蛋白表达电泳图
2.3 NCTD对前列腺癌PC-3细胞的迁移和侵袭力的影响 细胞划痕实验结果显示,NCTD各浓度组划痕愈合面积与空白对照组相比减少,见图3。同时 Transwel小室法检测结果也发现,12.5 μg/mL、25 μg/mL和50 μg/mL NCTD组的侵袭细胞数分别为 (66.4±12.4)个、(53.4±8.1)个、(31.6±4.6)个,均较空白对照组侵袭细胞数(84.2±7.3)个明显减少,差异有统计学意义(P<0.05),见图4。

图3 NCTD对PC-3细胞迁移能力的影响(倒置显微镜,×100)
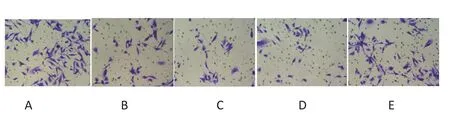
图4 NCTD对PC-3细胞侵袭能力的影响( 结晶紫,×200)
2.4 透射电镜观察结果 正常培养的PC-3细胞直径4 μm左右,细胞核大,核仁明显,细胞表面可见较多伪足样突起。与12.5μg/mL、25μg/mL、50 μg/mL NCTD共培养24 h后,PC-3细胞表面伪足样突起结构数量减少,随着NCTD浓度增加,伪足数呈明显递减趋势。见图5。
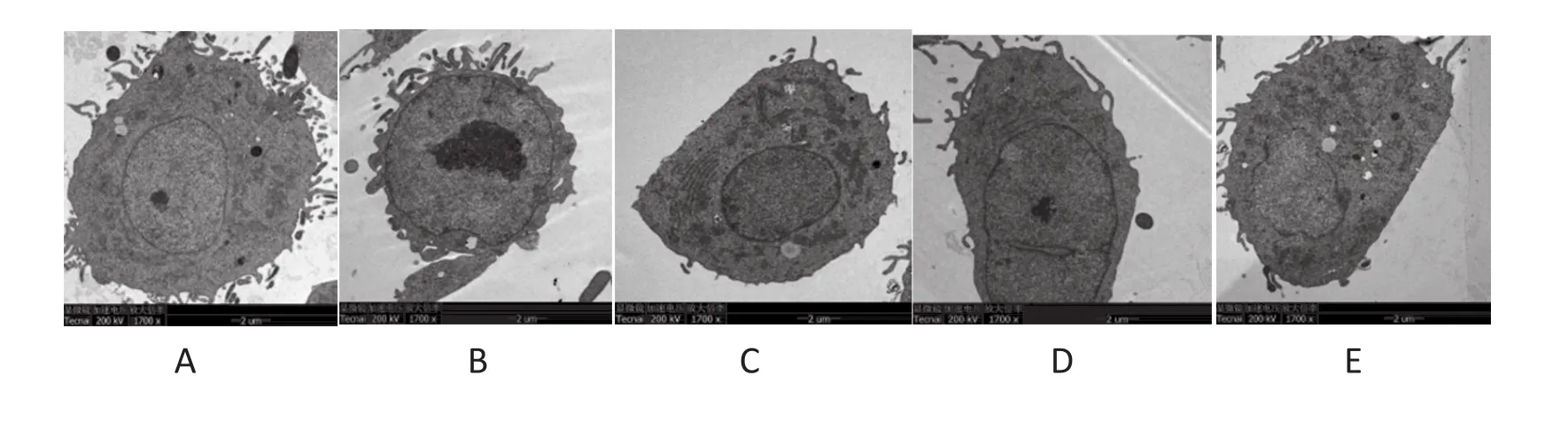
图5 NCTD对PC-3细胞伪足形态的影响(透射电镜,加速电压200kV,×5000)
3 讨论
侵袭和转移是恶性肿瘤的主要生物学特征,恶性肿瘤细胞浸润外周细胞内皮和基底膜,产生转移扩散[4]。细胞外基质包括基底膜和细胞间基质,分布在细胞表面或细胞间隙,是恶性肿瘤细胞局部浸润扩散的重要屏障。恶性肿瘤细胞局部浸润和侵袭的首要条件是降解细胞外基质,胶原蛋白是细胞外基质的基本骨架成分。MMP-9是降解细胞外基质重要的明胶酶[5],主要参与侵袭性伪足形成并促进体内细胞外基质的降解。近年研究发现,MMP-9 mRNA在前列腺癌组织中的表达显著高于良性前列腺组织,侵袭转移的前列腺癌组织MM-9 mRNA表达量显著高于非侵袭转移者,MMP-9过表达的前列腺癌患者预后差[6-7]。另有研究显示,下调MMP-9基因表达,能够抑制人前列腺癌PC-3细胞的侵袭及增殖,提示MMP-9可能在前列腺癌的侵袭转移中发挥重要作用[8]。
NCTD是由我国最先合成的唯一具有升高白细胞作用的新型抗肿瘤药物。NCTD作用细胞后可能导致线粒体膜电位改变和线粒体功能障碍,细胞内活性氧积累过多,最终导致DNA损伤并消耗 ATP,从而激活凋亡通路[9]。NCTD可能通过下调 ERK1 /2 信号途径来抑制肿瘤细胞增殖[10]。NCTD可抑制人黑素瘤M14细胞的迁移,其机制可能与下调MMP-9有关[11]。NCTD可能通过抑制miR-182-5p阻滞LKB1/AMPK信号通路和EMT发生抑制卵巢癌细胞增殖和侵袭[12]。NCTD可能通过提高TET1的表达量激活细胞内主动去甲基化,抑制肿瘤细胞的增殖和迁移[13]。有实验证实,NCTD能够显著抑制体外培养的皮肤鳞状细胞癌A431细胞的体外黏附、侵袭和迁移能力,其机制可能与其能下调内皮血管生长因子和基质金属蛋白酶-2蛋白表达水平相关[14]。NCTD用于治疗前列腺癌的研究较少,国内学者近期临床研究发现[15],NCTD联合紫杉醇治疗HRPC患者,效果明显优于单用紫杉醇,并可能会减少紫杉醇造成的不良反应。本课题组前期研究发现[16],NCTD能够诱导前列腺癌PC-3细胞的凋亡并干扰PC-3细胞的有丝分裂,进而对PC-3细胞增殖产生抑制作用。
本实验用不同浓度的NCTD作用PC-3细胞后,采用实时荧光定量PCR检测MMP-9 mRNA含量、Western-blot检测MMP-9蛋白表达量,结果发现NCTD各浓度组的PC-3细胞MMP-9 mRNA含量和蛋白表达量均较空白对照组减少。同时,PC-3细胞MMP-9 mRNA含量和MMP-9蛋白表达量随NCTD浓度增加呈逐渐减少趋势,存在剂量-效应关系。本次划痕实验和Transwell实验结果均提示NCTD能够降低PC-3细胞的外周迁移和侵袭力,并且NCTD浓度与PC-3细胞的侵袭力强弱之间存在剂量-效应关系。最后,本实验采用透射电镜观察的方法,对不同浓度NCTD作用后的PC-3细胞进行超微形态观察,与空白对照组相比,NCTD组PC-3细胞表面伪足数量减少,随着NCTD浓度增加,伪足数量程明显递减趋势。提示NCTD可减少PC-3细胞表面伪足的形成。
NCTD能够降低PC-3细胞的外周迁移和侵袭力,其机制可能与NCTD下调PC-3细胞MMP-9 mRNA含量和蛋白表达,减少PC-3细胞表面伪足有关。

