糖尿病大鼠与正常大鼠在创面愈合不同阶段炎症因子动态变化的差异性研究
张 臻,阙华发
糖尿病溃疡是糖尿病常见而又严重的慢性并发症之一,往往迁延难愈,并且极易复发。在创伤愈合过程中,炎症反应是创面修复的重要内容,为后续的修复或再生奠定了重要基础。本实验拟观察糖尿病性创面与正常创面在创伤愈合过程中不同时期炎症相关因子的动态变化的差异性,探讨影响糖尿病溃疡愈合的因素,为糖尿病性溃疡的治疗提供依据。
1 材料与方法
1.1 实验动物 3月龄SPF级雄性SD大鼠40只(上海毕凯医药科技有限公司提供,合格证编号:20180006007335),体质量 200~230 g。
1.2 主要试剂与仪器 白细胞介素(IL)-1β抗体(ab9722),工作浓度 1∶500 ;IL-6 抗体(ab9324),工作浓度1∶500;IL-10抗体(ab192271),工作浓度 1∶200 ;肿瘤坏死因子(TNF)-α 抗体(ab1793),工作浓度1∶100,以上抗体均购自美国abcam公司;病理切片机(RM2016),购自上海徕卡仪器有限公司;组织摊片机(KD-P),购自浙江省金华市科迪仪器设备有限公司;多功能化学发光成像仪(620028-08Q),购自上海勤翔科学仪器有限公司。
1.3 糖尿病溃疡大鼠模型建立 实验前12 h禁食,定量饮水。实验当日称体重,尾静脉采血和收集尿液,用血糖仪和试纸法分别测定基础血糖和尿糖,然后以pH值4.6,0.1 mmol/L的枸橼酸钠缓冲液溶解链脲佐菌素(STZ),配成1%溶液,以60 mg/kg剂量单次腹腔内注射STZ溶液,48 h后动物血糖浓度>16.65 mmol/L及尿糖为4个“+”时,即制成糖尿病鼠模型[1]。监测血糖,若血糖高于30 mmol/L,根据所测得的血糖水平,皮下注射胰岛素(2~4 U)/只,1次/d。饲养8周后,将糖尿病模型大鼠用电动剃毛器将大鼠背部毛发去除干净,随后以7%的水合氯醛(按1 mL/200 g麻醉剂量)腹腔注射麻醉,麻醉满意后,以呋喃西林消毒背部皮肤,在无菌条件下用外科方法作2个深达深筋膜、直径为1 cm的全层皮肤缺损,即制成糖尿病溃疡模型[2]。
1.4 分组与给药 将40只大鼠随机均分为正常组及糖尿病溃疡模型组。所有大鼠均用外科手术方法制作背部全层皮肤缺损模型。各组于创面造模后当日开始给药,换药前均以1/5000呋喃西林溶液清洁创面,外敷生理盐水纱布,外用两层消毒干纱布覆盖固定,每天换药、灌胃1次。
1.5 检测指标 分别于术后第3天(炎症期)、第10天(增殖期),将大鼠腹腔注射7%的水合氯醛麻醉,创面消毒后,用外科手法剪取创面肉芽组织,以4%多聚甲醛固定,用免疫荧光法测定M1、M2型巨噬细胞数量,免疫组化图像分析法检测IL-1β、IL-6、TNF-α和IL-10的表达水平。
1.6 检测方法 (1)免疫荧光:石蜡切片常规脱蜡、复水、抗原修复;用PBS清洗3次,每次5 min,1%BSA湿盒中室温封闭30 min,滴加1%BSA稀释的一抗混合液(CD163+CD68;CD86+CD68),湿盒中4℃冰箱孵育过夜,用PBS清洗3次,每次5 min,滴加PBS稀释的荧光二抗(1∶200),湿盒中37℃孵育50 min,PBS清洗3次,每次5 min,DAPI复染,PBS清洗3次,每次5 min,滴加2 μL的抗荧光猝灭液,封片,镜检。(2)免疫组化图像分析:每组每个时间点随机抽取6个标本作为实验样本,石蜡切片常规脱蜡,PBS清洗3次,每次5 min,向组织区域滴加1%BSA,室温湿盒封闭30 min,向组织区域滴加稀释后一抗溶液,4℃孵育过夜,PBS清洗3次,每次5 min,滴加二抗,37℃孵育50 min,用PBS清洗3次,每次5 min,滴加DAB工作液,湿盒孵育20~40 s,显微镜下检测染色程度,PBS清洗3次,每次5 min,苏木素复染6 min,水洗,吹干,树脂封片。通过显微镜、图像采集卡、数码相机采集数字图像,放大倍数为400倍,读取面积百分比值。每张照片随机选取3个视野,取面积百分比的均值为各炎性因子的表达水平。
1.7 统计学方法 应用SPSS 25.0进行统计学分析,最终数据均以表示。正常组与糖尿病溃疡模型组间对比用两样本独立t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 糖尿病创面和正常创面不同时期M1、M2型巨噬细胞数量的比较 免疫荧光检测创面M1和M2型巨噬细胞的表达水平,以CD68和CD86双标代表M1型巨噬细胞;CD68和CD163双标代表M2型巨噬细胞。第3天,糖尿病溃疡模型组M1型巨噬细胞数量明显减少,而M2型巨噬细胞表达无明显差别;第10天,两组M1型巨噬细胞数量区别不明显,糖尿病溃疡模型组M2型巨噬细胞数量明显减少(图1~4)。
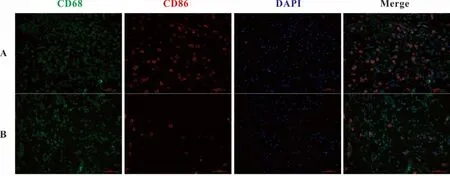
图1 创面第3天M1型巨噬细胞(CD68和CD86共表达)
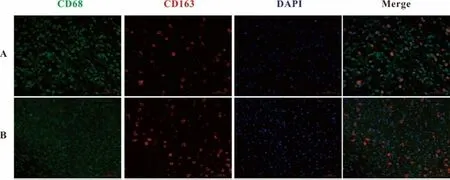
图2 创面第3天M2型巨噬细胞(CD68和CD163共表达)
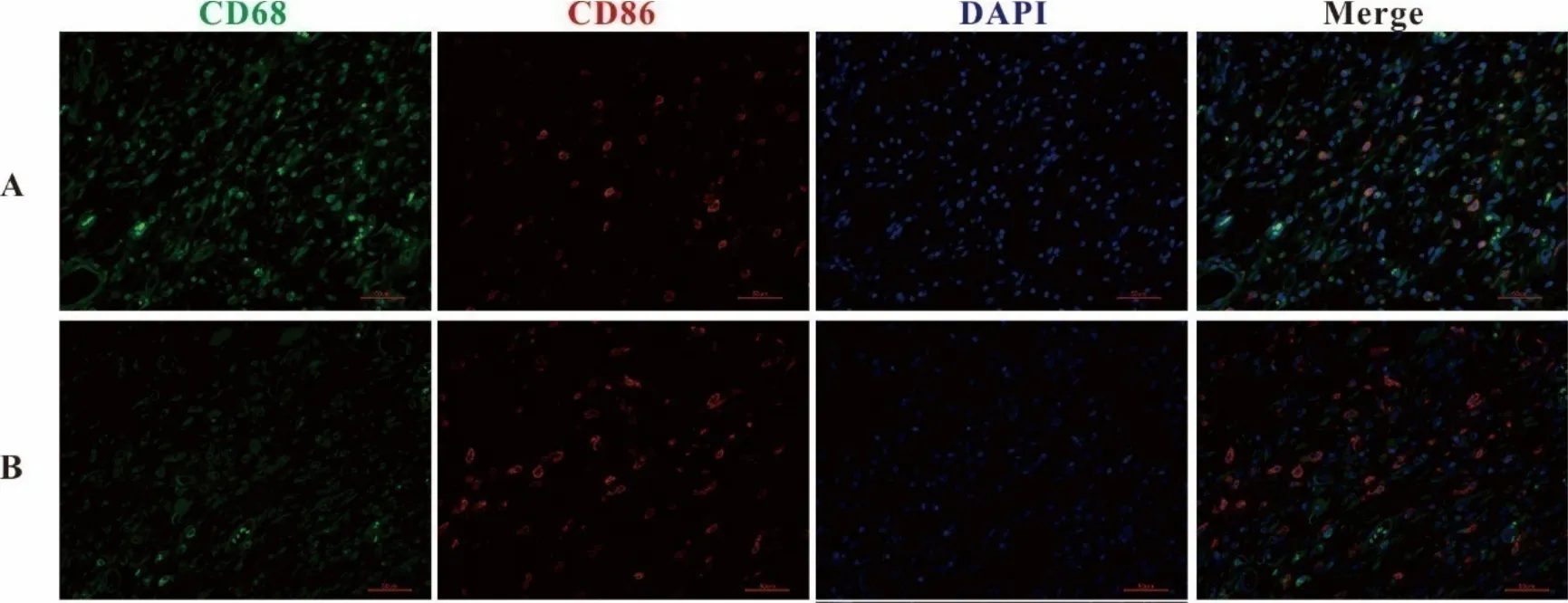
图3 创面第10天M1型巨噬细胞(CD68和CD86共表达)
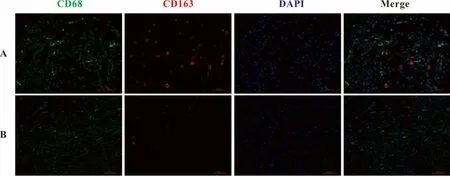
图4 创面第10天M2型巨噬细胞(CD68和CD163共表达)
2.2 糖尿病创面和正常创面炎症因子在不同时期的动态变化 正常组创面,增殖期IL-1β、IL-6的表达水平低于炎症期,IL-10水平高于炎症期,差异有统计学意义(P<0.05);TNF-α表达水平无统计学差异。糖尿病溃疡模型组创面,增殖期的IL-1β、TNF-α、IL-6、IL-10水平均高于炎症期,差异有统计学意义(P<0.01),见表1、2。
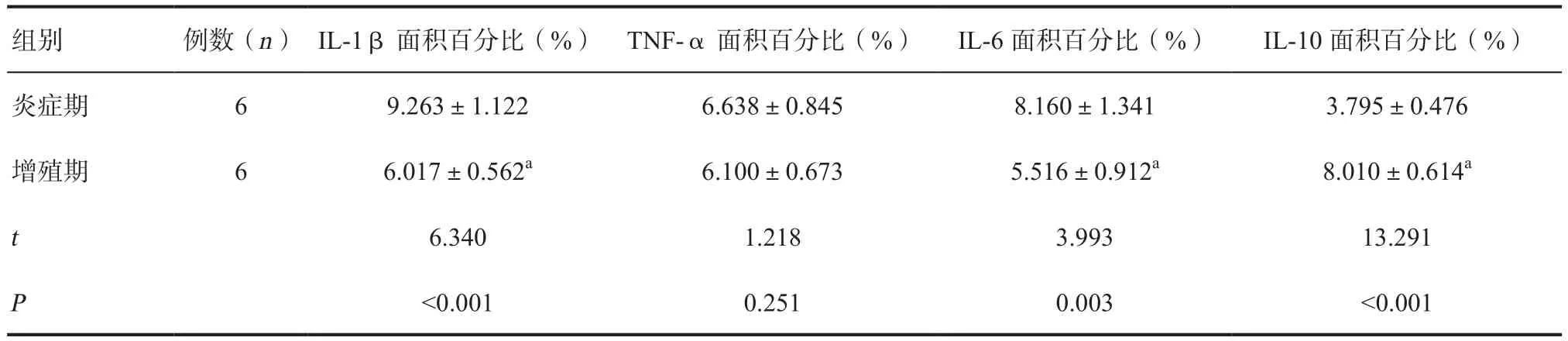
表1 正常组促炎因子在不同时期的动态变化
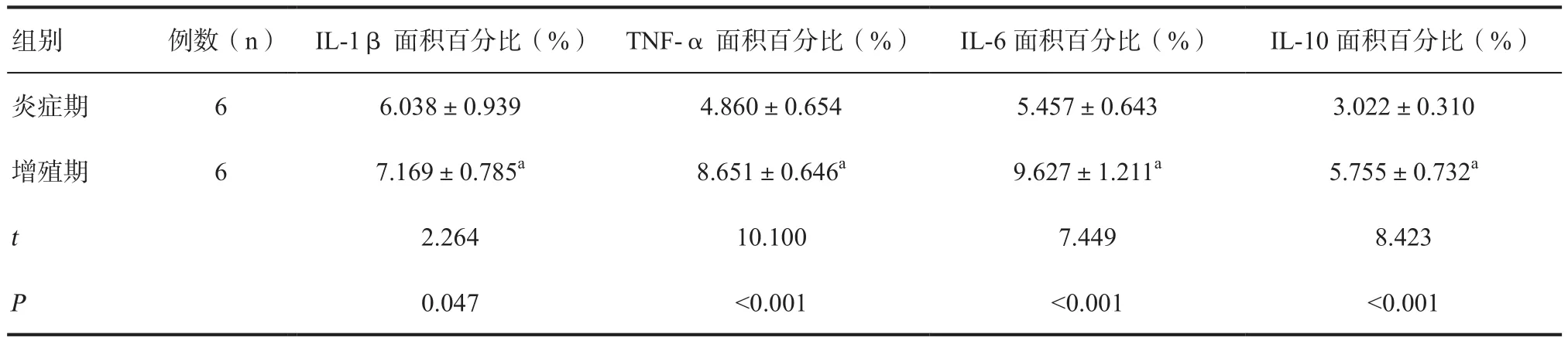
表2 糖尿病溃疡模型组促炎因子在不同时期的动态变化
3 讨论
创面修复是一个连续的复杂过程,包括炎症期、增殖期和重塑期。炎症期的病理过程主要包括单核/巨噬细胞和中性粒细胞等向创伤处迁移,同时释放多种炎症相关因子。增殖期由成纤维细胞和新生毛细血管网形成肉芽组织,填充局部的组织缺损,继而出现表皮细胞增殖,实现上皮重建。后期重塑期则包括成纤维细胞的继续增殖和以胶原为主的细胞外基质的沉积[3-4]。其中,炎症反应是创面修复的第一阶段,为后续的修复或再生奠定了重要基础,炎症阶段到修复重塑阶段的转变是创面愈合的关键,肉芽组织形成和上皮新生是创面修复愈合和组织再生过程中的重要内容。
现代病理学和有关大鼠创面愈合的前期基础研究认为,创伤后第3天前后是创面修复的第一阶段,是重要的炎症反应期,第10天前后是创面愈合后期重要的增殖阶段[5-6]。清除损伤组织和控制感染是炎症期重要的生理病理反应,大量单核细胞趋化到创伤局部,同时转化为巨噬细胞,与存在于中性白细胞中的弹性硬蛋白酶、胶原酶等众多蛋白酶家族一起协同作用,发挥相应的生物学功能,使坏死组织溶解,组织胶原纤维分解,吞噬微生物及异物、变性组织。巨噬细胞包括M1型巨噬细胞和M2型巨噬细胞,作为伤口愈合过程的关键调节因素,它们在创面的愈合中扮演了两种不同的角色,且一定程度上起到相反的作用,即M1型巨噬细胞促进炎性反应,而M2型巨噬细胞抑制炎性反应[7-8]。创面的炎性反应包括炎症细胞的浸润及炎性因子的释放。其中,IL-1、IL-6、TNF-α由活化的M1型巨噬细胞合成分泌,是重要的促炎因子,是感染或局部创伤后机体最早产生的多功能细胞因子之一。促炎因子的表达,能促进发挥吞噬细胞碎片、清除病原体的炎症反应,但在此过程中正常机体组织亦有受M1型巨噬细胞或过度炎症反应破坏的可能。同时,IL-6在一定程度上还能促进成纤维细胞迁移及胶原表达,因此在创伤早期可能有助于创伤愈合,但长时间持续高表达可能与纤维化即瘢痕形成有关。IL-10作为重要的抑炎因子,主要由M2型巨噬细胞促进其高分泌,能起到针对单核细胞、巨噬细胞的减活化作用,从而弱化其分泌促炎细胞的功能[9],具有抑制炎性反应的作用。并且,在创面炎症后期的转归阶段,巨噬细胞还能及时清除一定数量的中性粒细胞,从而避免过度的炎症反应对周围组织和细胞造成损伤。同时,M2型巨噬细胞还有着重要的促重塑作用,及促成纤维细胞迁移的作用。随着进入创面愈合的增殖阶段,组织开始修复,M2型巨噬细胞能恢复组织的稳态和平衡,合成胶原蛋白,分泌高水平的生长因子,如血管内皮生长因子(VEGF)、转化生长因子-β(TGF-β)等,有助于成纤维细胞和内皮细胞等的迁移和增殖、肉芽组织形成和血管生成,进而填补组织的缺损[10-11],加速创面的愈合和组织重塑,并且还能调节肌成纤维细胞的分化与凋亡等途径来减少纤维化,也就是在一定程度上抑制瘢痕的形成。研究证实由经典途径激活,并募集而来的巨噬细胞还可以转变成替代性途径活化的巨噬细胞,也就是M1型巨噬细胞可以向M2型巨噬细胞转变[12]。巨噬细胞的数量过多,存在时间过长,或表型转变不及时,都可能影响创面的正常愈合[13-14]。因此,巨噬细胞和相关的炎症因子是维护伤口愈合的重要防线,在影响溃疡愈合中的地位尤为重要。
免疫荧光实验结果显示,炎症期糖尿病溃疡模型组M1型巨噬细胞数量明显减少,而M2型巨噬细胞表达无明显差别,提示糖尿病性溃疡早期M1型巨噬细胞数量不足,可能导致炎症反应的正常功能无法正常发挥,进而影响创面愈合。而增殖期各组M1型巨噬细胞数量区别不明显。但糖尿病性模型组M2型巨噬细胞数量明显较少,提示在创面转归阶段,糖尿病性溃疡创面M2型巨噬细胞数量分泌不足,可能引起炎症反应不正常的强化和迁延,对周围组织和细胞造成损伤,同时影响M2型巨噬细胞增加VEGF表达和促重塑作用的正常发挥,从而影响创面愈合。
通过糖尿病溃疡模型组和正常组创面炎症因子前后动态变化的比较发现,正常创面增殖期的IL-1、IL-6、TNF-α与早期相比明显下降,IL-10明显上升,提示促炎因子数量的递减和抑炎因子的递增是炎症向修复过渡的正常过程。而糖尿病溃疡模型组创面IL-1β、TNF-α和IL-6在炎症期表达水平低下,无法如正常创面一样产生适度的炎症反应,不能快速清除阻碍创面生长的病原微生物和坏死组织,从而延迟了创面愈合进程,且在增殖期促炎因子反而较前明显升高,同时抑炎因子上升迟缓,故而不仅直接影响到早期炎症反应的程度,又使后期病态的炎症反应迁延不愈。因此,从动态观察角度可以发现,随着创伤修复过程由炎症期向增殖修复过程转变,促炎因子的转化和抑炎因子的调控可能是促使炎症期顺利过渡的关键因素,而糖尿病导致的慢性创面常常存在炎症因子转化过渡方面的功能障碍,可能是糖尿病性创面延迟愈合的重要因素之一。
综上所述,糖尿病性溃疡延迟愈合的原因可能与巨噬细胞表型和转化异常,以及炎症因子间的动态失衡有关。本研究分析结果可能为糖尿病皮肤溃疡的进一步相关研究提供了理论依据和作用靶点。

