注射用盐酸吉西他滨及其原辅料中丙酮、二氯甲烷、吡啶残留溶剂测定
熊欣,郭艳芳,钟振华,夏红英,刘贞,程奇珍
江西省药品检验检测研究院,国家药品监督管理局中成药质量评价重点实验室,江西省药品与医疗器械质量工程技术研究中心,江西 南昌 330029
注射用盐酸吉西他滨为处方药,国家基本药物目录品种。由美国礼来公司研发,商品名为Gemzar,1995年在英国上市,1999年进口我国。盐酸吉西他滨为二氟核苷抗代谢类药,被美国FDA批准为非小细胞肺癌、膀胱癌、胰腺癌以及乳腺癌的一线化疗药[1-5]。主要引起骨髓抑制,胃肠反应、肝肾损害、轻度蛋白尿和血尿、皮肤毒性等不良反应[6-7]。
参照企业提供的合成工艺,结合相关研究资料[8-12],本实验建立了气相色谱法测定注射用盐酸吉西他滨中3种有机溶剂残留量,并对收集到的样品及其原辅料中丙酮、二氯甲烷、吡啶进行检测。
1 仪器与试药
1.1 仪器
Agilent Agilent 7693型气相色谱仪(美国安捷伦科技有限公司);MS105 型电子天平(精密度:十万分之一,METTLER TOLEDO);ML204型电子天平(精密度:万分之一,METTLER TOLEDO)。
1.2 试药
盐酸吉西他滨(4家生产企业,8批次);注射用盐酸吉西他滨(8家生产企业,58批次);丙酮[色谱纯,永华化学科技(江苏)有限公司,批号:20150505,含量≥99.0%];二氯甲烷(色谱纯,禹王集团,批号: 2015032501,含量≥ 99.0%);吡啶(分析纯,西陇科学股份有限公司,批号:190109 2);N,N-二甲基甲酰胺(色谱纯,Anaqua Chemical supply,批号:38Y1805HY)。
2 方法与结果
2.1 注射用盐酸吉西他滨中丙酮、二氯甲烷与吡啶残留量的测定
2.1.1 色谱条件 色谱柱:DB-5毛细管柱(30 m×0.53μm ×5 μm),序列号:125-5035;载气:氮气;程序升温:起始温度为40 ℃,维持10 min,以每分钟20 ℃的速率升温至160 ℃维持5 min,再以每分钟40 ℃的速率升温至200 ℃,维持15 min;进样口温度:200 ℃;检测器温度:250 ℃;进样方式:直接进样;进样量:5 μL;氮气流速:3 mL/min;分流比3∶1。
2.1.2 对照品溶液的制备 称取丙酮、二氯甲烷与吡啶适量,加N,N-二甲基甲酰胺溶解并定量稀释制成含每1 mL含丙酮0.5 mg、二氯甲烷60 μg与吡啶0.2 mg的混合溶液,滤过,取续滤液,即得。
2.1.3 供试品溶液的制备 取本品3瓶内容物,混合均匀,称取适量(约含盐酸吉西他滨0.5 g),置5 mL量瓶中,加N,N-二甲基甲酰胺溶解并稀释至刻度,摇匀,滤过,取续滤液,即得。
2.1.4 系统适用性试验 取对照品溶液进样,各成分峰之间的分离度均应符合要求。出峰顺序依次为丙酮、二氯甲烷、吡啶,各峰之间的分离度均符合要求,系统适用性良好。
2.1.5 专属性试验 精密量取N,N-二甲基酰胺5 μL直接进样,记录色谱图。结果表明,空白溶剂对3种溶剂的测定无干扰。
2.1.6 线性 精密称取二氯甲烷0.122 0 g,置50 mL量瓶中,加N,N-二甲基甲酰胺溶解并稀释至刻度,摇匀,精密量取25 mL,置100 mL量瓶中,精密称取丙酮0.505 5 g、吡啶0.214 0 g,置同一100 mL量瓶中,用N,N-二甲基甲酰胺稀释至刻度,摇匀,作为混合对照品贮备液。
精密量取混合对照品贮备液0.5、1.0、1.0、1.0、2.0、4.0 mL,分别置50、50、20、10、10、10 mL量瓶中,用N,N-二甲基甲酰胺稀释至刻度,摇匀,作为混合线性系列标准溶液①②③④⑤⑥。按“2.1.1”色谱条件测定。以浓度(mg/mL)为横坐标,以峰面积为纵坐标,绘制标准曲线。结果表明,丙酮浓度在0.050 55~2.022 00 mg/mL范围内,线性关系良好;二氯甲烷浓度在0.006 1~0.244 0 mg/mL范围内,线性关系良好;吡啶浓度在0.021 4~0.856 0mg/mL范围内,线性关系良好。结果详见表1。

表1 丙酮、二氯甲烷与吡啶线性方程表
2.1.7 精密度试验 取线性系列标准溶液④,连续进样6次,记录色谱图,记录峰面积,计算峰面积RSD值。结果表明,丙酮、二氯甲烷与吡啶峰面积RSD值分别为0.4%、0.8%与1.1%,仪器精密度良好。
2.1.8 重复性试验 取批号为160904样品约0.95 g,精密称定,重复取样6次,分别置5 mL量瓶中,加N,N-二甲基甲酰胺溶解并稀释至刻度,摇匀,滤过,直接进样,记录色谱图,计算检出残留溶剂的量。结果表明,该样品检出丙酮,平均残留量为0.004 1%(n=6),平行性良好。
2.1.9 回收率试验 精密量取线性系列标准溶液①5mL,置25 mL量瓶中,用N,N-二甲基甲酰胺稀释至刻度,摇匀,作为回收率溶液①;分别精密量取混合对照品贮备液2、3 mL,分别置20、25 mL量瓶中,作为回收率溶液②③。
取本品内容物约0.47 g 9份,精密称定,置5 mL量瓶中,第1~3号样品分别加回收率溶液①溶解并稀释至刻度,摇匀,滤过,取续滤液;第4~6号样品分别加回收率溶液②溶解并稀释至刻度,摇匀,滤过,取续滤液;第7~9号样品分别加回收率溶液③溶解并稀释至刻度,摇匀,滤过,取续滤液,直接进样,记录色谱图,计算回收率。结果显示,丙酮、二氯甲烷与吡啶的平均回收率分别为96.7%、93.6%、90.5%(n=9),符合药品质量标准分析方法验证指导原则[8]中的回收率范围要求(85%~110%)。
2.1.10 最低检测限 精密量取线性系列标准溶液①1 mL,置100 mL量瓶中,用N,N-二甲基甲酰胺稀释至刻度,摇匀,精密量取2 mL,置10 mL量瓶中,用N,N-二甲基甲酰胺稀释至刻度,摇匀,直接进样5 μL,记录色谱图,二氯甲烷峰、吡啶峰信噪比约为3∶1。
精密量取线性系列标准溶液①5 mL,置10 mL量瓶中,用N,N-二甲基甲酰胺稀释至刻度,摇匀,直接进样5 μL,记录色谱图,丙酮峰信噪比约为3∶1。结果详见表2。
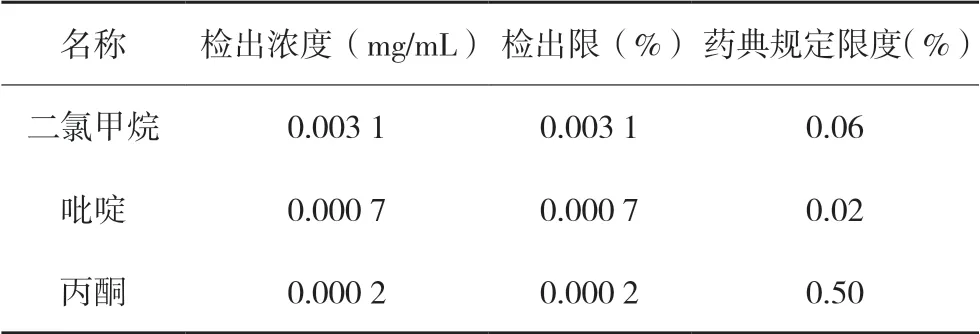
表2 最低检测限结果表
2.2 注射用盐酸吉西他滨测定结果
采用拟定方法对来源于8家生产企业的58批次注射用盐酸吉西他滨抽验样品进行检测,结果表明,58批次样品均未检出吡啶与二氯甲烷;有51批次检出丙酮,检出率为87.9%,平均检出量(以盐酸吉西他滨计)为0.048%,结果均符合药典要求。测定结果详见表3。
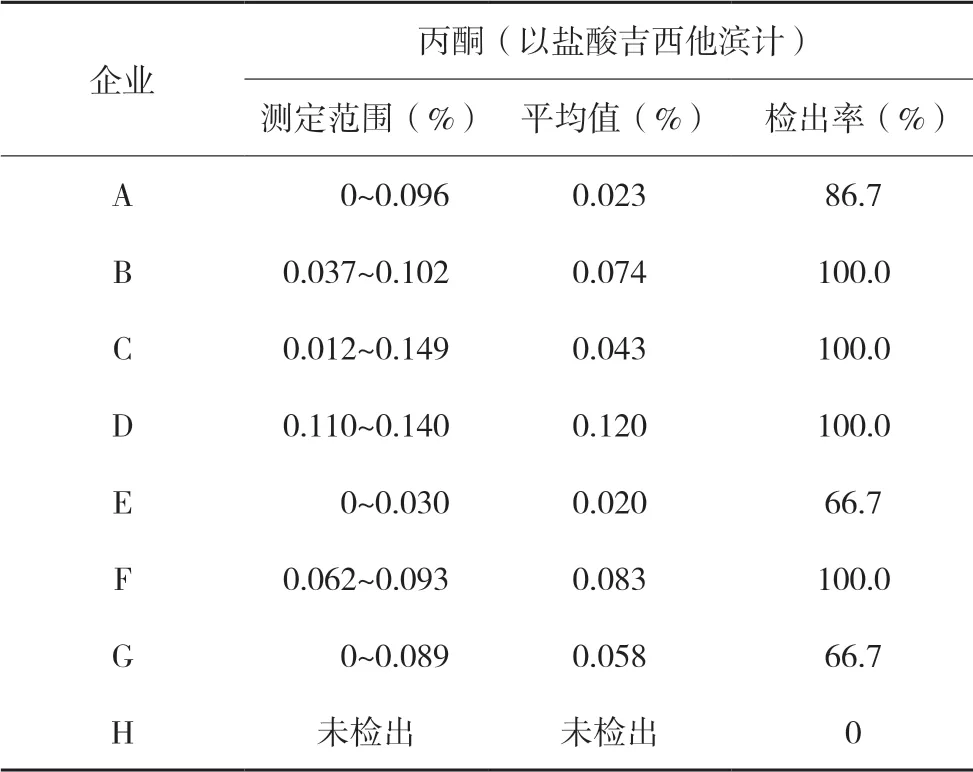
表3 各企业样品中丙酮检出量情况统计表
本次抽验样品有同企业同批号样品共9批次,结果表明,A企业批号为190102的3批次样品中丙酮残留量存在不同程度的批间差异,其中2批残留量约为另1批残留量的7倍,但检出量均较小。因制剂生产过程中不使用丙酮,结果的差异可能与原料生产过程中是否混匀或制剂的贮藏条件有关;其余同批号样品间丙酮残留量的差异不大。结果详见表4。
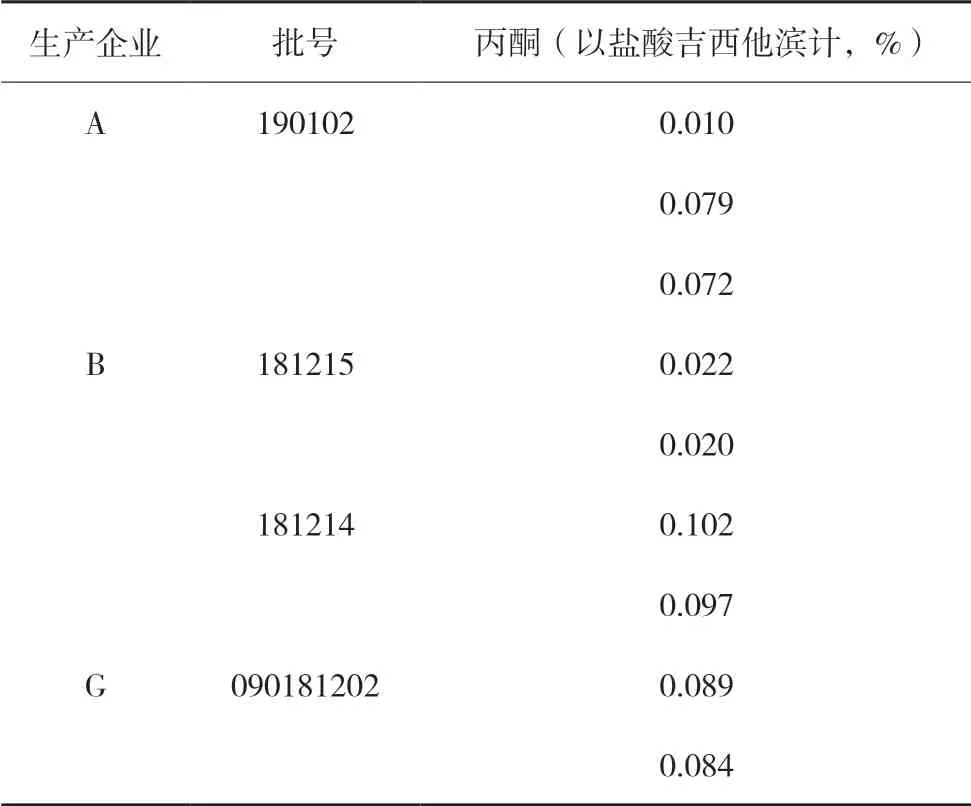
表4 各企业同批号样品丙酮检出量统计表
2.3 注射用盐酸吉西他滨原料测定结果
本次抽验共收集到8批次原料药,涉及原料药生产企业4家。根据4家企业提供的原料药合成工艺,不同企业使用的起始物料、合成路线及提纯工艺均不同,工艺中涉及使用的有机溶剂种类也有不同,同时原料药企业注册标准中的残留溶剂检查项对残留溶剂的检测方法以及检测溶剂种类也存在较大差异。
对该8批次原料药采用“2.1.1”色谱条件测定其残留溶剂,结果显示,8批次原料药中均未检出二氯甲烷与吡啶,仅来源于a企业的3批次原料药(批号不同)中检出丙酮,且该3批次原料分别由3家不同制剂企业提供,其含量分别为0.004 8%、0.009 6%、0.009 9%,平均含量为0.008 1%,均低于药典规定限度。结果详见表5。
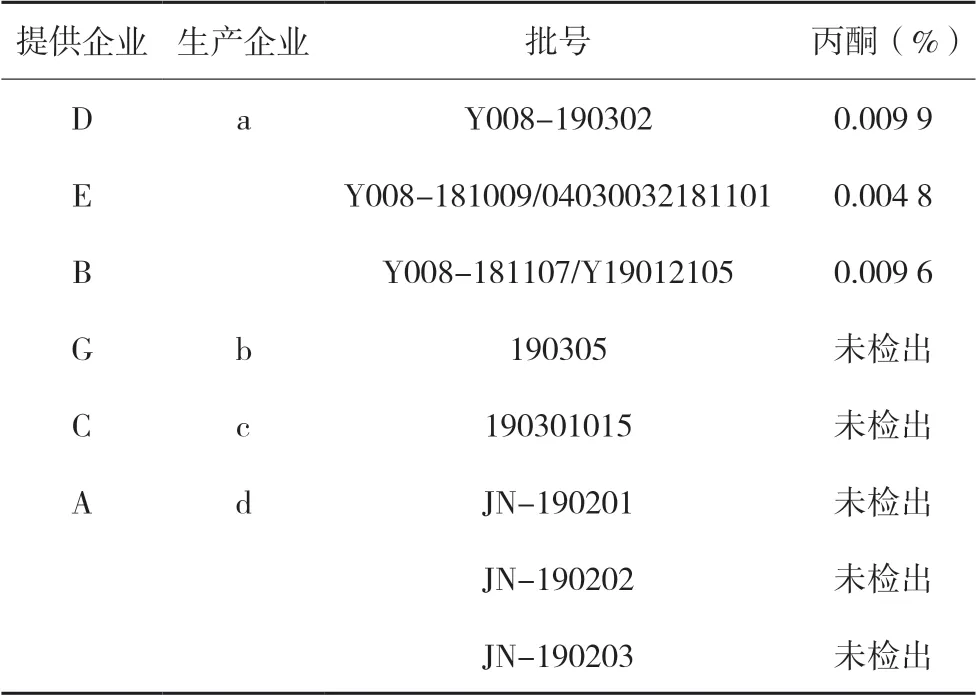
表5 盐酸吉西他滨原料中丙酮测定结果
原料药中主要检出丙酮,是源于吉西他滨在成盐工艺中使用了甲醇溶剂,成盐后用丙酮重结晶并洗涤。而制剂中检出了丙酮,提示制剂中的溶剂残留主要来源于原料药。
2.4 注射用盐酸吉西他滨辅料测定结果
通过发函调研,共收集到注射用盐酸吉西他滨国内9家生产企业的处方信息。所有企业的处方使用的药用辅料均为甘露醇(赋形剂)、醋酸钠(pH缓冲剂)与注射用水(溶剂,最终除去),pH调节剂为盐酸、氢氧化钠或醋酸钠,部分企业还使用了活性炭进行脱色、除热原等。 此次抽检样品涉及的8家企业处方与原研处方的原辅料成分一致,但是1家企业(A)的甘露醇处方量与原研不同;2家企业(F、G)的醋酸钠处方量与原研不同,并使用醋酸钠调节药液的pH值至规定范围。对8家企业提供的26批辅料进行了检测,结果三种残留溶剂均未检出。制剂企业提供的甘露醇、醋酸钠及活性炭辅料中,均未检出丙酮、二氯甲烷与吡啶。
3 结果与讨论
通过比较制剂使用的原料来源及批号发现,(1)同一批次制剂中未测定出丙酮,而其使用的2批次原料中仅1批测出丙酮;(2)同一制剂企业所有样品均有丙酮检出,而其提供的原料未检出丙酮;(3)同一制剂企业样品中有部分批次有丙酮检出,而其提供的3批原料均未检出丙酮;(4)同一制剂企业样品中有部分批次有丙酮检出,而其提供原料检出丙酮;(5)不同制剂企业采用同一原料企业提供的原料生产,原料中未检出丙酮,而制剂存在部分批次有丙酮检出、部分批次未检出的现象。产生以上现象的原因,可能与制剂使用的原料与本试验检测的原料批号不同,而原料丙酮残留量存在批间差异有关。制剂中的丙酮残留量可能为原料带入,且可能存在制剂生产过程或贮藏过程中造成丙酮的挥发或分解的现象。
因二氯甲烷与吡啶限度较低,顶空进样方法灵敏度欠佳,故选择直接进样法对丙酮、二氯甲烷与吡啶进行检测[13-14]。经方法学验证,本试验建立的定量检测注射用盐酸吉西他滨中3种有机溶剂的气相色谱法,操作简便、准确、经济、重复性好,可用于注射用盐酸吉西他滨中该3种溶剂残留量的日常检测,为制剂及原料药中残留溶剂的合理控制及其法定标准是否增订残留溶剂检查项提供数据依据。结合原料及制剂测定结果,建议原料与制剂生产企业优化生产工艺,严格控制内部工艺的稳定性,提高批间批内精密度。

