干扰UCP2保护H9C2心肌细胞免受缺氧诱导的细胞凋亡并抑制细胞自噬
张 莉 李 峰 刘悦雁 王艳梅 章辰琛
皖西卫生职业学院1.解剖教研室;2.生理教研室,安徽六安 237005
细胞凋亡导致的心肌细胞缺失已被证明与许多心血管疾病有关,如心力衰竭、进行性左心室功能障碍和扩张型心肌病[1]。心脏是一个持续需要ATP供给的高能量需求器官,来自线粒体的解偶联蛋白家族能够通过降低质子梯度来解偶联ATP合成。解偶联蛋白 2(uncoupling protein 2,UCP2)于 1997 年被发现,并在多种组织中发挥着重要作用,例如调节活性氧(reactive oxygen species,ROS)生成、调节胰岛素代谢、调节细胞凋亡等[2-4]。然而现有的文献中有许多相互矛盾的研究结果,一些研究显示UCP2具有心肌保护作用,而其他研究则显示出相反的作用。尤其是在心肌缺氧过程中,UCP2对心肌细胞的作用并不明晰。
心脏缺血再灌注可引起心脏组织不可逆损害,这其中主要的原因是心肌细胞缺氧(hypoxia)[5]。现有的研究显示,心肌细胞缺氧可导致细胞内ROS水平增高、Ca2+超载以及无机磷酸盐水平升高[6]。这些因素可导致线粒体内膜非选择性离子通道开放,引起线粒体内膜膜电位消失,呼吸链解偶联,细胞色素C 以及促凋亡因子外流,从而引起细胞凋亡[7-8]。自噬是广泛存在于真核细胞内的一种细胞分解自身构成成分的生理现象。现在的研究表明,缺血缺氧是细胞自噬激活的重要诱因之一[9]。自噬强度增加可促进细胞在缺血缺氧等状态下的存活,然而如果自噬水平过度上调,将引起自噬性细胞死亡,即Ⅱ型细胞程序性死亡[10]。在缺氧引起的细胞凋亡和自噬过程中,UCP2的作用仍不清楚。
本研究首先分析了大鼠心肌细胞H9C2在缺氧环境下UCP2的表达水平,随后检测了干扰UCP2对细胞内ROS 生成的影响。通过流式细胞仪检测干扰UCP2对H9C2缺氧后细胞凋亡的影响,通过蛋白免疫印迹检测干扰UCP2 对H9C2 缺氧后细胞损伤以及细胞自噬的影响。
1 材料和方法
1.1 细胞培养
大鼠胚源性心肌细胞H9C2购自中国科学院典型培养保存委员会细胞库(中国上海)。H9C2细胞膜拥有人心肌细胞的大多数特征,主要用来研究UCP2 在体外细胞培养中的作用。细胞培养在DMEM培养基(Gibco BRL,北京,中国)中,含有10%胎牛血清,培养条件为95%N2,5%CO2,37 ℃。细胞培养过程中定期传代。
1.2 细胞内ROS测定
使用非荧光探针DCFH-DA(Beyotime)对H9C2细胞中的ROS进行荧光检测。用胰蛋白酶将6孔细胞板中的细胞进行消化,离心收集。用DMEM稀释DCFH-DA 至 10 μm 后添加到 H9C2 细胞中,然后在37 ℃孵育20 min,随后用PBS 洗涤3 次。使用多功能微孔仪(Spectramax M5/M5)在488 nm激发波长和525 nm发射波长下读取DCF荧光。
1.3 RT-qPCR
为了检测UCP2 的mRNA 表达水平,使用Trizol试剂(Invitrogen Life Technologies)从H9C2细胞中提取总RNA,然后使用RT-PCR 试剂盒(TAKARA,日本)逆转录并合成cDNA。RT-qPCR 体系为10 uL,包含0.25 uL引物、5 uL SYBP 和4 uL cDNA。UCP2引物为:Forward:5′-GGG CAC CTG TGG TGC TAC CTG-3′;Reverse:5′-ATG-AGC-TTT-GCC-TCC-CGC-3′。
1.4 shRNA转染
通过上海基因有限公司合成shRNA-UCP2和阴性对照 shRNA-NC。 shRNA-UCP2 序列如下:Forward:5′-GCA CUG UCG AAG CCU ACA A dTdT-3′,Reverse:5′-UUG UAG GCU UCG ACA GUG C dTdT-3′。 shRNA-NC 序 列 Forward:5′-UUC UCC GAA CGU GUC ACG UTT-3′,Reverse:5′-ACG UGA CACGUU CGG AGA ATT-3′。根据制造商说明,使用 Lipofectamine 2000(Invitrogen Life Technologies,Carlsbad,CA,USA)转染。首先用无血清DMEM 培养基(GiBCO To,美国)分别稀释shRNA(nmol/L)和Lipofectamine 2000,并共同孵育20 min,然后将复合物添加到H9C2 细胞中,培养6 h 后,更换培养基。
1.5 细胞凋亡检测
H9C2 细胞用PBS 洗涤后用70%乙醇固定,然后将固定后的细胞在PBS 中洗涤2 次,随后用PI/FITC AnnexinV 染色(50 μg/mL RNA 酶),室温下避光孵育1 h。通过流式细胞仪分析细胞凋亡,利用FLOWJO软件进行统计。
1.6 蛋白质印迹
裂解细胞后用BCA 法进行蛋白定量。取等量蛋白样品(30 mg)上样,随后进行SDS-PAGE凝胶电泳。电泳结束后将蛋白转移到PVDF 膜(billerica,美国)。转膜结束后用5%脱脂牛奶室温下封闭1 h,随后一抗(1∶1000)孵育过夜。第2 天TBST 洗膜3 次,然后用辣根过氧化物酶标记的二抗孵育。TBST洗涤后显影成像。
1.7 统计学分析
采用GraphPad Prism 7 软件进行统计分析。所用数据表示为均数±标准误(±SEM),组与组之间比较采用独立样本t检验,多组之间比较采用单因素方差分析(One-Way ANOVA)。检验水准α=0.05。
2 结 果
2.1 缺氧环境下UCP2在心肌细胞H9C2中的表达
本实验通过RT-qPCR 检测缺氧环境下大鼠心肌细胞H9C2中UCP2的表达水平。实验结果显示,缺氧环境下UCP2 的表达量明显升高(图1A,P <0.001)。随后将 shRNA-UCP2 转染至 H9C2 中干扰UCP2的表达水平。转染shRNA-UCP2后的H9C2细胞均发出红色荧光,在荧光显微镜下记录带有红色荧光的细胞数目以及总细胞数目,确定24 h后的转染效率。在随机检测的600个H9C2细胞中,其转染效率为83.2%(图1B)。随后进一步通过蛋白免疫实验检测干扰后UCP2 的表达水平。实验结果显示,转染了 shRNA-UCP2 后 H9C2 细胞中 UCP2 的表达水平明显下降(图1C,P <0.01),同时免疫印迹实验也验证了H9C2 在缺氧培养后UCP2 的表达在蛋白水平上也明显升高(图1D,P <0.001)。
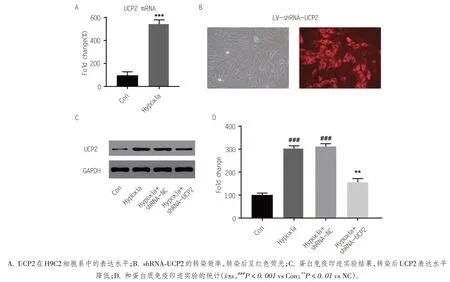
图1 缺氧环境下UCP2在心肌细胞H9C2中的表达
2.2 干扰UCP2对缺氧环境下心肌细胞H9C2细胞内ROS含量的影响
本实验通过非荧光探针DCFH-DA 与ROS 反应,检测细胞内ROS 水平。DCFH-DA 扩散至细胞中去乙酰化成为DCFH,随后DCFH 与ROS 在细胞内反应转化为可发出荧光的DCF。由于DCF 无法透过细胞膜,在荧光显微镜下观察荧光强度即可判断细胞内ROS的水平。实验结果显示,缺氧环境下H9C2 细胞内ROS 荧光强度明显升高(图2A),而干扰UCP2 表达后,可明显降低细胞内ROS 荧光强度(图2B,P <0.01)。因此,干扰UCP2可降低心肌细胞缺氧后ROS水平。

图2 干扰UCP2对缺氧环境下心肌细胞H9C2细胞内ROS含量的影响
2.3 干扰UCP2对缺氧环境下心肌细胞H9C2细胞凋亡的影响
通过流式细胞检测干扰UCP2对心肌细胞凋亡的作用。缺氧会引起细胞凋亡,而心肌细胞对于缺氧更为敏感。本实验通过流式细胞仪检测缺氧以及干扰UCP2对H9C2细胞的凋亡作用。实验结果显示,相比于正常环境下培养的H9C2 细胞,缺氧可显著增加H9C2细胞凋亡率(P< 0.001);干扰UCP2表达后,可显著降低H9C2细胞凋亡率(P<0.01),见图3。因此,干扰UCP2表达可降低由缺氧引起的心肌细胞凋亡。
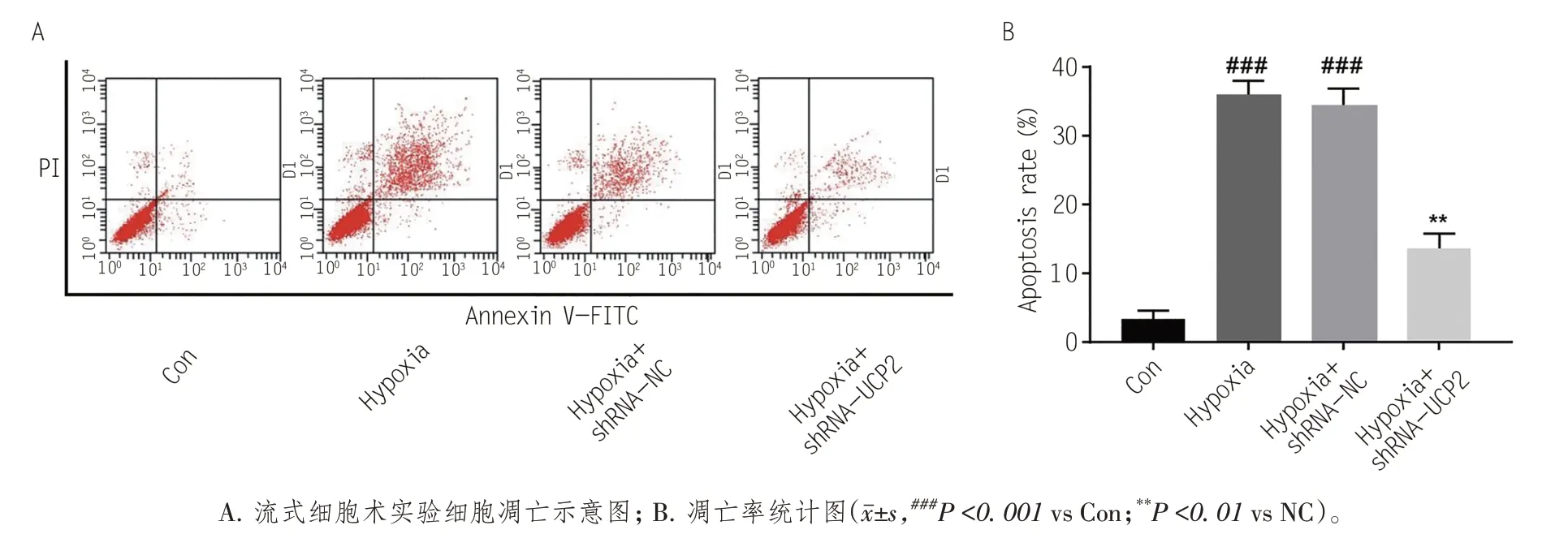
图3 干扰UCP2对缺氧环境下心肌细胞H9C2细胞凋亡的影响
2.4 干扰UCP2对缺氧环境下心肌细胞H9C2细胞损伤及炎症水平的影响
为了进一步研究UCP2在缺氧导致的心肌细胞凋亡以及损伤的作用,本研究通过蛋白免疫印迹检测了cleaved caspase-3 的表达水平。实验结果显示,缺氧环境下H9C2 细胞cleaved caspase-3 表达水平明显升高(P< 0.001),而干扰UCP2 可显著降低cleaved caspase-3的表达量(P< 0.01)。见图4。
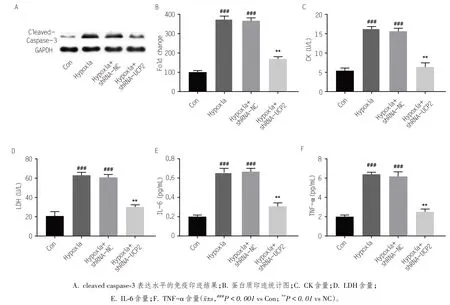
图4 干扰UCP2对缺氧环境下心肌细胞H9C2细胞损伤及炎症水平的影响
CK 和LDH 水平是衡量H9C2细胞(20-22)损伤程度的生化指标,细胞上清液中CK 和LDH 水平与细胞损伤程度呈正相关,而TNF-α和IL-6是心肌细胞缺氧损伤后重要的炎症因子。如图4 所示,H9C2 细胞缺氧培养后,细胞上清液中CK、LDH、TNF-α和IL-6的水平明显高于对照组(P< 0.001);而干扰UCP2 表达水平后,同样在缺氧环境下,H9C2 细胞上清液中 CK、LDH、TNF-α 和 IL-6 水平均显著下降(P<0.01)。我们的实验进一步说明了,干扰UCP2 可显著降低缺氧引起的细胞凋亡及损伤。
2.5 干扰UCP2对缺氧环境下心肌细胞H9C2细胞自噬的影响
为了研究干扰UCP2对缺氧引起细胞自噬的影响,采用蛋白印迹法分析了LC3-II/LC3-I、Beclin-1和p62 的蛋白水平。如图5 所示,缺氧显著增加了LC3-II/LC3-I和Beclin-1的表达水平,但显著降低了p62 的表达水平(P< 0.01),表明缺氧诱导了H9C2细胞自噬;干扰UCP2 的表达后,同样在缺氧环境下,H9C2 细胞中 LC3-II/LC3-I 和 Beclin-1 的表达水平显著降低,而p62显著升高(P<0.05)。因此,干扰UCP2表达可抑制缺氧诱导的心肌细胞自噬。

图5 干扰UCP2对缺氧环境下心肌细胞H9C2细胞自噬的影响
3 讨 论
再灌注疗法是目前临床急性心肌梗死的主要治疗手段,是一个缺氧后复氧的过程[11]。然而这种治疗方法可导致心肌细胞缺氧,引起一系列不可逆转的伤害。心脏是一个高能量需求器官,心肌细胞缺氧可引起电子传递链解偶联,最终引起细胞凋亡[12]。
在电子传递链中,解偶联蛋白是ATP和ROS产生的关键因子,通过跨膜转运H+降低线粒体质子浓度梯度从而生成ATP。当细胞遭受外界应激时,如缺氧,电子传递链解偶联,释放大量ROS[13]。在解偶联蛋白5种同系物中,UCP2在全身组织中普遍表达;例如肝脏、大脑、胰腺、脂肪组织、免疫细胞、脾脏、肾脏和心脏[14]。现有的研究表明,UCP2敲除小鼠的线粒体 ROS 含量增加[15]。此外,UCP2 还参与调节其他生理或病理事件,如动脉粥样硬化斑块的形成、食物摄入和代谢疾病[16]。鉴于UCP2 在调节线粒体ROS产生和细胞能量传递中的核心作用,本研究主要集中在UCP2对缺氧引起的心肌细胞凋亡以及自噬的影响。
本研究首先通过RT-qPCR 检测了缺氧环境下心肌细胞H9C2中UCP2的表达量,发现缺氧可显著引起UCP2表达升高。UCP2位于电子传递链中,在病理情况下,线粒体又是ROS的主要生产场所。随后我们应用ROS荧光反应检测了UCP2在缺氧环境下对细胞内ROS 生成的影响。我们通过RNA 干扰的手段,降低H9C2 内UCP2 的表达量,实验结果显示,干扰UCP2 表达后可显著降低缺氧引起的ROS水平升高。
目前,UCP2的确切生理作用尚不清楚,有研究证明UCP2 过度表达可导致细胞凋亡[17]。然而UCP2在缺氧导致的细胞凋亡过程中的作用并不清楚。在我们的研究中,流式细胞实验结果表明,干扰UCP2 表达后可显著降低缺氧导致的细胞凋亡率。细胞缺氧可导致线粒体内膜非选择性孔道开放,细胞色素c以及凋亡诱导因子外流。细胞色素c外流后生成凋亡小体复合物活化caspase9,最后激活caspase3 引起细胞凋亡。本研究检测了cleavedcaspase3以及细胞损伤相关因子,实验结果显示,干扰UCP2 表达可显著降低缺氧引起的cleavedcaspase3、LDH、CK、IL-6 和TNF-α 升高。然而有些实验表明,UCP2本身可引起细胞存活率下降,这与我们的抗凋亡结果相矛盾,这背后的抗凋亡机制还需要进一步研究。
自噬在各种生命活动中发挥着重要作用,例如加速细胞内的新陈代谢,或者在细胞处于缺血缺氧等状态时从分解产物中获得能量。大量研究表明增强的自噬促进了细胞在缺血缺氧等饥饿状态下的存活,然而过度的细胞自噬可引起细胞程序性死亡[18]。本实验研究了UCP2 在缺氧条件下对心肌细胞自噬的影响,通过蛋白免疫印迹法检测细胞自噬相关因子LC3-II/LC3-I、Beclin-1和p62,实验结果显示干扰UCP2 能显著逆转缺氧引起的细胞自噬。
综上,我们的实验结果证明,缺氧可引起UCP2表达升高,干扰UCP2 可显著降低缺氧引起的细胞凋亡及自噬。
利益冲突所有作者均声明不存在利益冲突

