Nrf2激活剂CDDO-EA抑制蛛网膜下腔出血后神经功能损伤及促进小胶质细胞M2型转化
董其威 赵华阳 任世浩 张朋杰 侯亚军 毛蕾蕾
山东第一医科大学(山东省医学科学院)生命科学研究中心,山东省高校脑微循环重点实验室,山东泰安 271000
蛛网膜下腔出血(subarachnoid hemorrhage,SAH)是由于脑底部或脑表面病变血管破裂致血液进入蛛网膜下腔所引起的急性病症,发病率仅次于脑梗死和高血压性脑出血,位居脑血管病第三位,其死亡率高达35%,大部分的幸存者晚期会出现运动神经功能缺损等终身残疾症状,具有高死亡率、高致残率的特点[1]。神经炎症损伤是SAH 后主要病理生理机制之一,SAH 发生后,局部小胶质细胞(microglia)迅速激活,启动效应物的释放和外周炎症细胞的募集。小胶质细胞具有较高的可塑性,在响应微环境触发时可以呈现截然相反的功能表型。一种表现型是“经典激活型”M1 型,释放破坏性的促炎介质;另一种表型是“选择性激活”抗炎M2 表型,与神经保护作用有关[2-3]。最近的研究表明,调节小胶质细胞向M2表型的极化可能是SAH后脑保护的重要治疗策略。
最近的研究表明,氧化还原相关的核因子2 相关因子(Nrf2)的激活有助于促进小胶质细胞激活后向M2 表型转化。活化的Nrf2 易位到细胞核,并与氧化应激细胞中的抗氧化反应元件(ARE)结合,从而触发抗氧化和抗炎基因的转录及其下游转录靶点血红素氧合酶-1(HO-1)的表达[4-5]。CDDO-EA及其类似物来源于齐果酸,已被证明在细胞培养和动物模型中均可激活Nrf2信号,表现出抗炎和抗氧化活性[6]。CDDO-EA具有较好的生物利用度,能有效穿透小鼠血脑屏障。然而,尚不清楚CDDO-EA 是否可通过激活Nrf2影响小胶质细胞极化,并进而影响SAH 后神经炎症反应,达到改善神经功能的作用。本实验采用小鼠大脑中动脉穿刺法制作SAH模型,探讨CDDO-EA 对SAH 后神经功能及小胶质细胞极化的影响。
1 材料和方法
1.1 主要药品与试剂
C57BL/6 小鼠(22~25 g)购自于山东朋悦实验动物中心,CDDO-EA购自于MedChemExpress公司,Nrf2单克隆抗体及β-actin一抗购自于Abcam公司,CD16 及CD206 一抗分别来源于BD Biosciences(553142)和R&D Systems(AF2535)公司。
1.2 实验分组及处理
选取50 只小鼠,随机分为假手术组(Sham)、SAH + PBS 组、SAH + CDDO-EA(10 μg、50 μg 、100 μg)5 组。应用大脑中动脉穿刺法制作 SAH 模型,术后48 h处死后取大脑皮层行Western blot评价Nrf2表达水平。随后选取最佳剂量50 μg作为治疗剂量,将30 只动物随机分为Sham、SAH + PBS 组、SAH+CDDO-EA(50 μg)3组,术后72 h进行神经功能评分后处死小鼠并留取脑组织进行冰冻切片。
1.3 小鼠SAH模型制作
采用国际上公认的血管内穿刺法制作SAH 模型。小鼠经异氟烷麻醉后仰卧并固定。沿颈中线剪开颈部皮肤及肌肉层,暴露并分离颈总动脉、颈外动脉及颈内动脉,将6-0尼龙线插入颈外动脉,随后途经颈总动脉进入颈内动脉,行经约10 mm后尼龙线到达大脑中动脉和颈内动脉的分叉处,感觉到阻力,继续行进2 mm 穿刺血管壁,10 s 后退出尼龙线并结扎颈外动脉残端,最后缝合伤口并消毒。这种模型可造成Willis 环动脉破裂出血,血液流入蛛网膜下腔,可以很好地模拟临床动脉瘤破裂造成的蛛网膜下腔出血。Sham组手术时,仅暴露并分离血管即可,不做插线及穿刺。
1.4 神经功能评分
神经功能缺损评分系统为修改的Garcia评分系统(表1),主要是对SAH后的神经功能做整体评估。神经功能缺损评分系统包括6项:自发性活动、前爪伸展、四肢运动对称性、攀爬、躯体感受、对刺激胡须的反应,总分18分。评分含3个等级,3~6分代表重度神经功能损伤,7~12 分代表中度神经功能损伤,13~18分代表轻度神经功能损伤。

表1 神经功能评分系统
1.5 Western blot
将动物麻醉后处死,在冰上留取特定部位的新鲜脑组织,冰浴下加组织裂解液匀浆,利用BCA 法测定蛋白浓度,加入蛋白上样缓冲液后95 ℃水浴中变性5 min即为上样标本。制备SDS-PAGE分离胶,加样后电泳分离蛋白,转膜到PVDF 膜上,用2%脱脂奶粉封闭2 h,一抗4 ℃孵育过夜,TBST 洗涤3 次后二抗孵育2 h,洗涤后加ECL 显色液,利用Bio-Rad ChemiDocTMMP 成像系统采集图像,用Image J软件计算蛋白条带的积分光密度值,以评估蛋白的表达量。
1.6 免疫荧光染色
本实验采用冰冻切片进行免疫荧光染色。小鼠处死后经灌注固定及脱水,OCT包埋切片25 μm。挑选脑片经PBS 漂洗及透化、封闭后,放入稀释好的一抗中,4 ℃孵育过夜,随后放入驴来源二抗中孵育1 h,洗涤。若进行免疫荧光双标染色,重复以上封闭及一抗、二抗孵育步骤。最后封片并用激光共聚焦显微镜(Nikon)扫描图像后进行图像分析。
1.7 统计学处理
使用SPSS 18.0软件进行统计学分析。实验结果以均数±标准差()表示,多组数据间比较采用单因素方差分析(one-way ANOVA),检验水准α=0.05。
2 结 果
2.1 Nrf2的表达
CDDO-EA 是一种NF-E2 相关因子2/抗氧化反应元件(Nrf2/ARE)激活剂,图1A 为CDDO-EA 的化学结构式。我们给予小鼠腹腔注射不同剂量(10、50、100 μg/只)的CDDO-EA,48 h 后收集各组动物大脑皮层做Western blot检测CDDO-EA表达量。如图 1B、C 和表 2 所示,与 PBS 对照组相比,50 μg 及100 μg 处理组脑内 Nrf2 表达量均明显增加(P<0.05);50 μg与 100 μg处理组相比差异无统计学意义(P> 0.05)。
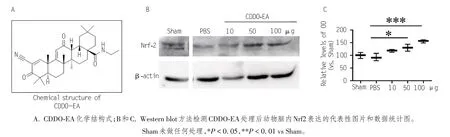
图1 CDDO-EA处理可上调脑内Nrf2的表达
表2 各组动物大脑皮层Nrf2蛋白水平的表达()

表2 各组动物大脑皮层Nrf2蛋白水平的表达()
注:与PBS组比较,aP < 0. 05,bP < 0. 001。
Nrf2 100±9.71 92.77±1189 118.12±4.66 130.25±11.21a 155.8±5.13b 15.44 0.0003组别假手术组(Sham)PBS CDDO-EA(10 μg)CDDO-EA(50 μg)CDDO-EA(100 μg)只数3 3 3 3 3 F P
2.2 SAH程度分级及神经功能评分
如图2A所示,术后24 h剥取大脑拍照,SAH组大脑颅底表面、Wilis环及脑干均有明显的出血。根据出血情况,进行SAH 程度分级评分,SAH + PBS 组与SAH + CDDO-EA 组之间差异无统计学意义(P>0.05),说明模型制作稳定,如图2B。术后72 h对各组动物进行神经功能评分,如图2C,SAH+PBS组神经功能评分比Sham组明显降低(P<0.01),说明SAH小鼠有明显的神经功能障碍,而给予CDDO-EA治疗后神经功能有所改善(P< 0.05)。
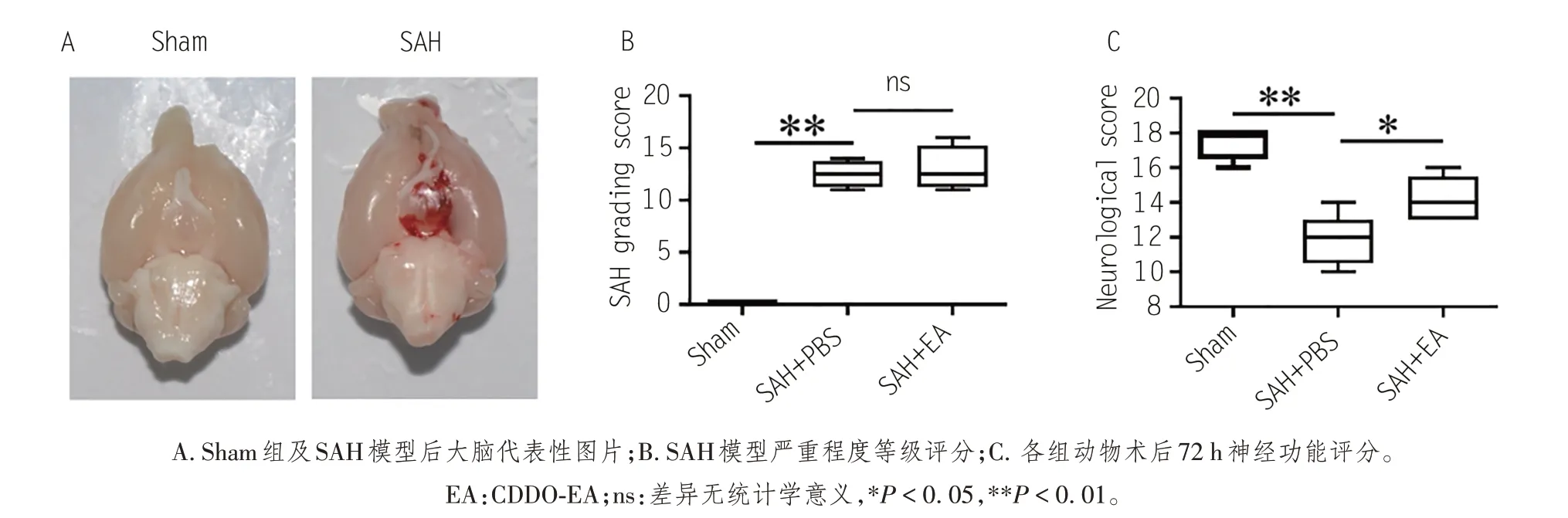
图2 CDDO-EA治疗能明显改善SAH后神经功能损伤
2.3 M2型小胶质细胞测定
术后72 h 对各组脑组织切片进行免疫荧光双标染色,见图 3、4 及表 3,选用 Iba-1 标记小胶质细胞,CD206 为M2 型小胶质细胞的特异性标志物。与Sham 组相比,SAH 术后皮层及海马的CD206 +Iba1+M2 型小胶质细胞均有所增加(P< 0.05),说明SAH 能激活小胶质细胞;CDDO-EA 治疗后M2型小胶质细胞比Vehicle 对照组明显增多,说明CDDO-EA 能促进活化的小胶质细胞向M2 型转化,发挥抑制神经炎症及促进吞噬碎片的功能。
表3 SAH后各组动物大脑CD206+M2小胶质细胞数()

表3 SAH后各组动物大脑CD206+M2小胶质细胞数()
注:与假手术组比较,aP < 0.05,bP < 0.01;与SAH+PBS 组比较,cP < 0. 001。
海马CA1区(%)2.86±0.08 19.85±5.95a 60.69±8.65c 74.35<0.0001组别假手术组(Sham)SAH+PBS(Vehicle)SAH+CDDO-EA(EA)只数3 4 4 F P基底皮层区(%)8.57±1.43 27.18±4.30b 82.11±5.80 299.8<0.0001

图3 CDDO-EA治疗可促进SAH后大脑皮层小胶质细胞向M2型分化
3 讨 论
神经炎症反应是SAH 后早期脑损伤的重要病理生理机制之一,与血脑屏障破坏、脑水肿及神经元凋亡等级联反应密切相关,是导致SAH神经功能受损的重要原因。大量研究表明,如果能有效调节SAH后的神经炎症反应,则可在很大程度上抑制脑损伤,减少神经行为及认知功能障碍。炎症机制已成为目前治疗SAH的关键靶点。
在生理条件下,转录因子Nrf2 是不活跃的,并与细胞质中的CNC 同源相关蛋白1(Keap1)结合在kelch样红细胞衍生蛋白上[7-8]。氧化应激时,Nrf2被Keap1激活释放,转位到细胞核并与ARE结合,激活其下游Ⅱ期解毒酶、硫氧还蛋白和HO-1 基因的表达,从而引起细胞对氧化应激的保护作用[9-10]。CDDO源自中国用于治疗肝炎的齐墩果酸[11],CDDO衍生物具有很强的抗癌、抗炎和抗氧化活性,如CDDO-IM(CDDO 咪唑酮)、CDDO-ME(CDDO 甲基酯)和CDDO-EA 等,是Nrf2 信号通路的有效激活剂[12]。本研究显示,腹腔注射CDDO-EA确实能够上调小鼠脑内Nrf2 的表达。在本课题组之前的研究中发现CDDO-EA 能够通过上调Nrf2 的表达有效抑制缺血性脑梗死模型后神经炎症反应,但是CDDO-EA 对SAH 模型是否有治疗作用尚未见有报道,本研究结果提示该药物用于治疗SAH 小鼠可以明显改善术后神经功能。

图4 CDDO-EA治疗可促进SAH后大脑海马区域小胶质细胞向M2型分化
SAH 可诱发强烈的抗原特异性与非特异性的免疫反应,包括小胶质细胞、星形胶质细胞、中性粒细胞等对损伤作出快速反应并迁移至损伤部位,尽管这些免疫细胞有助于清除血肿及组织修复,但是同时会释放大量的促炎因子引发神经细胞凋亡,导致神经功能缺失[13-14]。小胶质细胞是中枢神经系统疾病固有免疫反应最重要的调节者,是一把双刃剑,它具有M1和M2两个极化表型,M1型通过释放大量促炎性因子介导神经元损伤及细胞凋亡;M2 型可释放IL-10等抑炎因子及神经营养因子抑制神经损伤,还可通过吞噬细胞碎片促进神经再生[15]。SAH 后以释放促炎因子为特点的M1型小胶质细胞过度激活,而以吞噬细胞碎片、血凝块,促进修复为主的M2 型小胶质细胞相对弱化,两者具有同源性,在脑内不容易被区分开[16-17]。先前的研究表明,Nrf2的激活可使小胶质细胞的极化向抗炎M2表型转变[18-19]。我们的研究结果显示,SAH 术后皮层及海马的CD206+Iba1+M2 型小胶质细胞均比Sham 组有所增加,说明SAH能激活小胶质细胞;而CDDO-EA治疗后M2 型小胶质细胞比Vehicle 对照组明显增多,因此,本研究证实了CDDO-EA可通过上调Nrf2的表达进一步促进小胶质细胞向M2型极化转变。
综上所述,CDDO-EA 可能通过上调Nrf2 的表达干预SAH后脑内小胶质细胞极化类型,促进其向抑炎促修复M2 型转化,进而有效抑制过度的神经炎症反应,改善神经功能。本研究可能为CDDO-EA用于临床治疗SAH提供研究依据。
利益冲突所有作者均声明不存在利益冲突

