去泛素化酶BAP1在肝细胞癌发展中的功能研究
仲彤,王艳双,王婵娟,张晓莉,王泽,张令强,崔春萍
作者单位:100850 北京,军事科学院军事医学研究院生命组学研究所
原发性肝癌(hepatocellular carcinoma,HCC)是危害人类健康的重大疾病,在中国的癌症死亡率中排名第二[1]。我国是病毒性肝炎高发区,HCC 的发病率位居世界首位,每年死于 HCC 的患者占全球 HCC 死亡人数的 50% 以上[2]。近年来,随着多种治疗方法和药物在临床上的应用,肝癌患者的预后得到了明显改善,但由于频繁的术后复发和治疗抵抗的发生,总体来看治疗效果仍然不尽人意。因此,深入研究肝癌发病机制并发展新的治疗策略是关系我国人民健康的重大科学问题。
去泛素化酶(deubiqutinase,DUB)是泛素化修饰途径中一类重要的调节分子,能够通过特异性剪切或加工泛素链来控制底物蛋白的稳定性和
生物活性,进而参与机体的生理和病理过程。目前报道的 DUB 家族成员超过 100 个,根据其功能和结构特点分为 6 个亚家族(USP、UCH、OUT、MJD、JAMM 和 MCPIP),但目前对其结构、功能和作用的分子机制了解并不多[3]。近年来的研究显示,DUB 成员在 DNA 损伤修复[4]、机体生长发育[5]、免疫调控[6]以及肿瘤发生发展[7]等重要生理和病理过程中发挥功能。BAP1(BRCA1 association protein 1),即 BRCA1(breast cancer type 1 susceptibility protein)结合蛋白 1,是定位于细胞核中的一个 UCH(ubiquitin carboxyl hydrolase)亚家族去泛素化酶。目前的大部分研究显示 BAP1 在肾透明细胞癌、葡萄膜黑素瘤、胸膜间皮瘤、胆管癌等肿瘤中突变或缺失,且其过表达能够抑制肿瘤细胞的生长,被认为是一个抑癌基因[8-9]。而近期的研究则报道 BAP1 能够通过调控 KLF5 的去泛素化,促进乳腺癌的生长[10]。因此,BAP1 在不同类型肿瘤中可能有着不同的功能和作用机制。Jhunjhunwala 等[11]通过分析 30 例 HCC 病人的外显子测序数据,2014年首次报道了 HCC 存在BAP1 突变(D84V)。同年,Janku 等[12]分析了14 例高转移 HCC 病人肿瘤组织的二代测序数据,并报道了两个 BAP1 突变。目前对 BAP1 突变和表达变化的临床意义及其功能和调控的分子机制的报道仍然较少。Hirsch 等[13]采用 RNAseq和全基因组或全外显子组测序方法分析了 151 例肝肿瘤,包括 126 例 HCC,15 例 FLC 和 10 例混合 FLC/HCC。经 Western blot 实验验证并对比TCGA 数据库后,鉴定出由 BAP1 驱动的 HCC亚组,其具有纤维状样特征和 PKA 途径失调,这可能是 BAP1 肿瘤与 DNAJB1-PRKACA FLC 之间临床和组织学相似性的根源。Ningarhari 等[14]在1502 例患者(978 例 HCC)的肿瘤和非肿瘤肝组织中测量了 TL,并通过基因组、外显子组、靶向或 RNA 测序分析了 TERT 改变和 HCC 的表达、临床和分子特征,发现在肝中长端粒的肝癌通常是具有祖细胞特征和 BAP1 突变的 TERT 野生型。虽然 BAP1 失活可能通过表观遗传调控在 TERT表达中起作用[15],但其研究结果提示,TERT 的弱表达表明 BAP1 失活可能与端粒维持的另一机制相关,尚待确定。因此,深入研究 BAP1 表达及突变与 HCC 的临床相关性,阐明 BAP1 调控肝癌细胞生物学特性的功能作用,探索其作用的分子机制具有重要意义。
本文通过分析 TCGA 数据库中 375 例 HCC病人的基因组和转录组数据,发现与正常肝组织相比,BAP1 在 HCC 组织样本中突变差异显著,且BAP1 突变与病人预后良好密切相关。细胞学实验显示敲低 HCC 细胞中 BAP1 表达能够显著抑制细胞的生长和迁移。而 BAP1 的错义点突变导致其促肿瘤生长的功能丧失。该研究提示 BAP1 作为一个促癌基因调控 HCC 生长,可能是 HCC 治疗的一个潜在靶点。
1 材料与方法
1.1 材料
细胞培养器材购自美国 Costar 公司;实验用6~7 周龄 BALB/c 裸鼠购自北京维通利华公司;Anti-BAP1(SC-28383)购自美国 Santa 公司;G418 购自美国 Thermo Scientific 公司;小牛血清购自美国 Gibco 公司;胰蛋白酶购自美国 Sigma公司;DMEM 培养基购自美国 Hyclone 公司;点突变试剂盒购自日本 Toyobo 公司;电泳仪、电转仪购自美国 Bio-Rad 公司;transwell 小室购自美国康宁公司;其他试剂均为国产分析纯试剂。肝癌细胞系 LO2、HepG2、SK-Hep2、PLC-PRF-5、SMMC7721 、 Bel7402 、 Huh7 、 MHCC-97L 、MHCC-97H、MHCC-LM3 均为本实验室冻存;质粒:pcDNA-BAP1、pcDNA-BAP1C91S、GST-BAP1、shBAP1#3、shBAP1#6 由中国科学院陈策实教授实验室赠予。
1.2 方法
1.2.1 细胞培养 细胞于 10% 小牛血清DMEM 培养基中贴壁培养,于 37 ℃、5% CO2的饱和水汽二氧化碳培养箱中培养。
1.2.2 BAP1 点突变体构建 首先将引物稀释为10 pmol/L:灭菌蒸馏水 35 μl,10 × Buffer for iPCR 5 μl,2 mmol/L dNTPs 5 μl,引物 1(10 pmol/μl)1.5 μl,引物 2(10 pmol/μl)1.5 μl,质粒 DNA 1 μl,KOD-Plus 1 μl;总体积 50 μl。用 DnpI 对模板质粒 DNA 进行消化;PCR 结束后,加入 2 μl DpnI,37 ℃ 反应 1 h。PCR 产物自身环化:DnpI 处理后 PCR 产物 2 μl,灭菌蒸馏水 7 μl,高效连接试剂 5 μl,T4 Polynucleotide Kinase 1 μl;总体积15 μl。16 ℃ 反应 1 h。转化:取出 100 μl DH5α 感受态细胞,置于冰上溶解;然后取出自身环化产物10 μl,加入感受态细胞中,轻轻混匀并于冰上放置30 min;42 ℃ 热激 90 s,然后冰浴放置 2 min;加入 900 μl 无双抗的 LB 培养基,37 ℃ 振荡培养 1 h;取适量涂布于适当的抗生素 LB 平板;最后置于 37 ℃ 培养箱中培养过夜约 6 h。突变体的确认:挑取 4~8 个菌落用内切酶处理后电泳,根据酶切图片确认是否突变;对必要片段测序以确定序列。质粒提取:收取 16 h 前摇的菌,置于离心机离心 15 min,转速 4000 r/min,弃去上清液;每管加入含有 RNA 酶的重悬液 250 μl,轻轻重悬;再加入 250 μl 的裂解液,轻轻上下翻转 10 次混匀,静置 4 min;最后加入中和液中和,轻轻上下翻转 10 次混匀,并于离心机离心 15 min,转速12 000 r/min;将上清置于质粒吸附柱中,于离心机离心 1 min,转速 12 000 r/min,并重复此步骤;加入 500 μl 洗液洗第一次,离心机离心 1 min,转速 12 000 r/min;再加入 700 μl 洗液洗第二次,离心机离心 1 min,转速 12 000 r/min;室温静置5 min 晾干,往吸附柱中加入 50 μl 去离子水,离心机离心 2 min,转速 12 000 r/min;收集质粒并检测质粒浓度。
1.2.3 回转稳定株构建 将 shRNABAP1#3、shBAP#6 转入到 pLKO.1-puro 慢病毒载体中,载体骨架为 pCMV-Myc,用 pLKO.1-puro-shBAP1逆转录病毒感染 SMMC7721 和 Bel7402 细胞;48 h 后,使用终浓度为 3 μg/ml 的嘌呤霉素筛选1 周,收集稳定的 BAP1 敲低细胞系;然后,将pcDNA3.1(-)-Myc-BAP1WT、pcDNA3.1(-)-Myc-BAP1G45R、pcDNA3.1(-)-Myc-BAP1C91S、pcDNA3.1(-)-Myc-BAP1H169Q、pcDNA3.1(-)-Myc-BAP1F170V、pcDNA3.1(-)-Myc-BAP1W196G 和pcDNA3.1(-)-Myc-BAP1W202L 质粒加入到SMMC7721 和 Bel7402 BAP1 稳定敲低的细胞系中;使用终浓度为 350 mg/ml G418 筛选 3 周,得到过表达 BAP1 点突变的稳定株;最后进行Western blot 验证。
1.2.4 克隆形成实验 取对数生长期的细胞,加入胰蛋白酶消化,轻轻吹打;使用细胞计数仪对细胞进行计数,每个六孔板铺 1000 个细胞;置于含有 CO2的细胞培养箱中静置培养 2~3 周,每隔2 天换液一次;当六孔板中出现较大的细胞克隆时,弃去培养液;先用 PBS 洗 3 次,加入 4% 的多聚甲醛固定 15 min;弃去固定液,使用 0.1% 结晶紫染色液染色 25 min;最后用肉眼直接计数克隆形成率。
1.2.5 细胞迁移实验 将 SMMC7721 细胞或Bel7402 细胞以 1 × 105个/孔接种在 transwell 板小室的上室中,加入 100 μl 无血清 α-MEM 培养基,底部加入 200 μl 含有高浓度血清(20%)的DMEM;使细胞在含有 5% CO2的细胞培养箱中迁移 12~18 h。将 transwell 小室取出,将靠近下室膜那一面的细胞用棉签轻轻擦去;另一面的细胞用 4% 多聚甲醛室温固定 30 min,结晶紫染色20 min,用 PBS 清洗 3 遍;最后在显微镜下观察并计数。
1.2.6 免疫印迹分析 用预冷的 1 ml PBS 洗涤细胞,加入预冷的细胞裂解液(106个/50 μl);4 ℃ 放置 30 min 以上使细胞彻底裂解,随后12 000 r/min、4 ℃ 离心 30 min,收集上清。蛋白定量后,进行 SDS-PAGE 凝胶电泳,将蛋白转移至 PVDF 膜上,置于 5% 脱脂牛奶中封闭,然后用一抗 4 ℃ 孵育过夜,TBST 洗涤 3 次,每次5 min,加二抗孵育 1 h,TBST 洗涤 3 次,每次15 min,ECL 显色,放射自显影。
1.2.7 裸鼠成瘤实验 选用 6~7 周龄,雄性裸鼠18 只,分为 3 组,每组 6 只;裸鼠接种后分笼饲养,皮下瘤接种的细胞量为 2 × 106个/只;接种的体积为 100 μl,细胞悬液的浓度为 2 × 107个/ml;肿瘤细胞注射使用 1 ml 的注射器,接种时,针头在裸鼠皮下组织进针约 1 cm 深度;接种后一周左右可见到皮下开始出现肿块,皮下成瘤的周期为35 d;不同的细胞类型和接种的细胞数量会影响皮下成瘤的时间,使用游标卡尺定期测量肿瘤的大小,每 3 天测一次,肿瘤不宜生长过大,一般不要超过 1000 mm3;当肿瘤长到合适大小时处死裸鼠并进行解剖,对接种瘤进行观察、测量,记录;多聚甲醛固定,用于后期的免疫组化、免疫荧光等实验。
1.2.8 临床数据分析 从 TCGA(https://gdcportal.nci.nih.gov/)下载肝癌临床指标数据(包括肿瘤分期、分化程度)及术后生存期数据;利用χ2test检测候选基因突变、表达量与肿瘤分期、分化程度等临床指标的相关性;利用 log rank test、cox 回归分析检测候选基因突变、表达量与术后生存期的相关性;从 TCGA 下载肝癌体细胞突变数据文件(376 个);统计 100 个基因在 376 个样本中的突变频率,筛选高频突变基因。
1.2.9 外显子序列分析 从 NCBI(https://www.ncbi.nlm.nih.gov)查询 BAP1 外显子序列,利用NCBI 中 BLAST 工具将实验所用人正常肝细胞LO2 及 9 种肝癌细胞系 BAP1 外显子序列测序结果与 NCBI 查询到的 BAP1 外显子理论序列进行对比分析,确定实验用肝癌细胞系的 BAP1 外显子是否发生突变。
2 结果
2.1 TCGA 数据中 BAP1 的突变频率、类型及其表达变化的分析
利用 TCGA(The Cancer Genome Atlas)数据库,分析了 100 个 DUBs 在人 HCC 样本中的突变情况。我们一共获得了 375 例 HCC 患者的364 个有效样本,共 44 845 个体细胞突变数据,利用 Maftools 软件绘制基因突变图谱。在突变图谱中,TP53 突变率最高,约为 28%,而显著突变的 DUBs 家族成员只有 BAP1,突变率约为5.31%,如图 1所示。
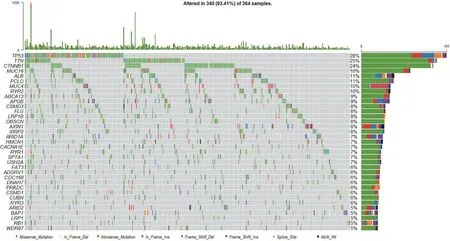
图1 TCGA 数据库中 HCC 样本突变基因图谱Figure 1 Mutant gene map of HCC samples in TCGA database
利用 Maftools 软件分析 BAP1 基因突变的分布情况,如图 2所示,375 例肝癌样本(包含2 例复发的样本)中有 22 例出现突变,其中包含2 个突变缺失、9 个移码突变、5 个无义突变、6 个错义点突变。具体分析发现,6 个错义点突变,分别为 G45R、C91S、H169Q、F170V、W196G 和W202L,其中有 5 个错义点突变位于 BAP1 的UCH(ubiquitin C-terminal hydrolases)结构域。
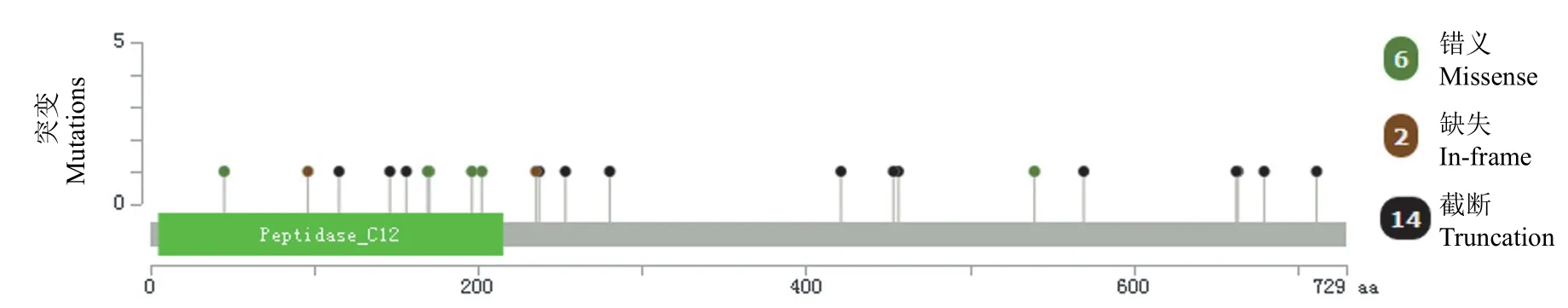
图2 TCGA 数据库中 BAP1 基因突变位点注释Figure 2 Annotation of BAP1 gene mutation site in TCGA database
2.2 BAP1 的突变及表达变化与临床病理指标的相关性分析
生存分析结果显示,BAP1 错义点突变与HCC 患者较好的预后相关(图 3A)(P=0.0316),即 BAP1 突变的 HCC 病例中存活期显著高于无BAP1 突变的病例。分析表达量(RNA-Seq)数据显示 BAP1 突变的 HCC 组织中,其 mRNA 水平均显著下降(图 3B)。
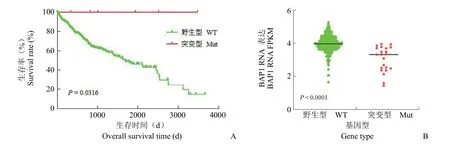
图3 BAP1 突变与患者预后的相关性(A:BAP1 突变患者预后良好,n=365;B:BAP1 mRNA 在 HCC 组织中表达量分析,n=371)Figure 3 Correlation between BAP1 mutation and patient outcome (A:Patients with BAP1 mutation had a good prognosis,n=365;B:Analysis of expression level of BAP1 mRNA in HCC tissues,n=371)
进一步分析发现,在 371 例 HCC 样本中BAP1 mRNA 呈高表达(图 3B),而且在男性中的表达水平显著高于女性(图 4A),生存分析显示BAP1 mRNA 高表达与患者较差的预后密切相关(P=0.0207)(图 4B)。
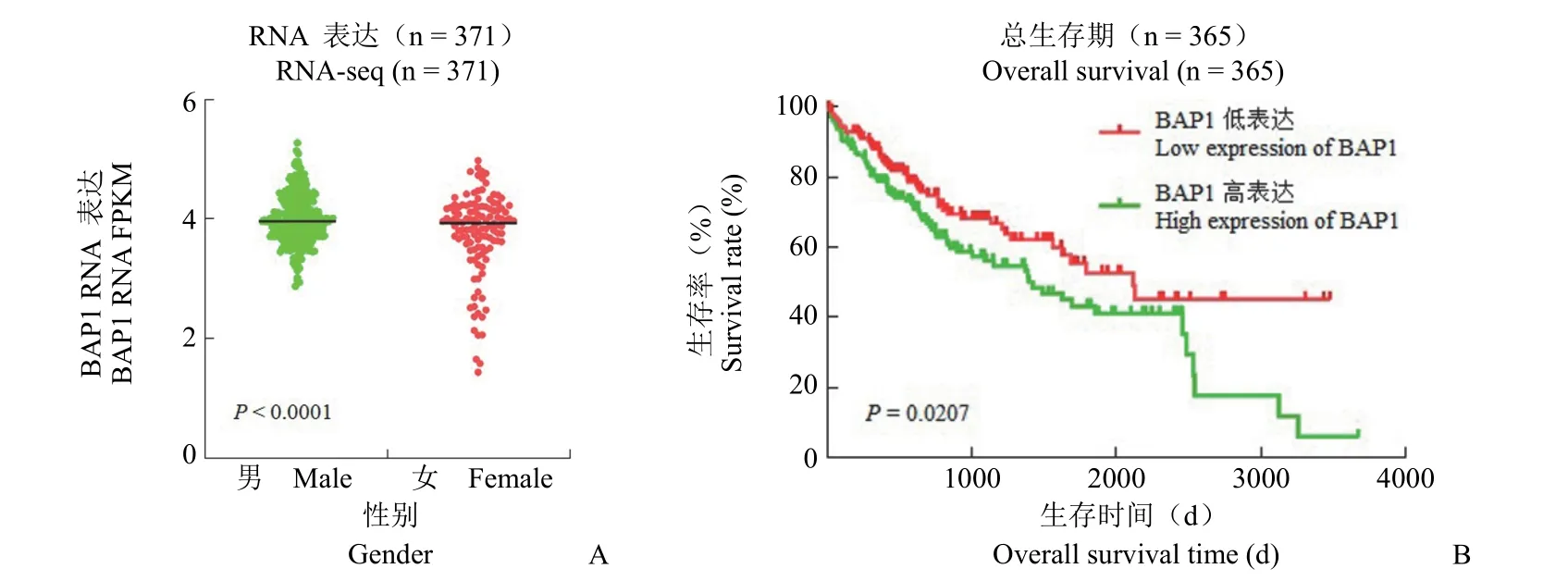
图4 HCC 组织中 BAP1 mRNA 表达及其与患者预后相关性(A:BAP1 mRNA 表达存在性别差异;B:BAP1 mRNA 高表达提示预后差)Figure 4 BAP1 mRNA expression in HCC tissues and its correlation with patient prognosis (A:Sex difference in BAP1 mRNA expression;B:High expression of BAP1 mRNA pointed the poor prognosis)
2.3 BAP1 敲低抑制 HCC 细胞的生长和迁移
为了研究 BAP1在肝癌细胞中的功能,首先检测了 BAP1 在人正常肝细胞 LO2 和不同肝癌细胞系中的表达情况,Western blot 结果显示,BAP1 在 8 种肝癌细胞系中呈高表达,而在 Huh7细胞系中表达缺失(图 5A)。同时,对实验使用的人正常肝细胞和 9 种肝癌细胞系中 BAP1 的外显子进行了测序比对,结果显示 9 种肝癌细胞系及人正常肝细胞均表达野生型 BAP1,结合 q-PCR结果,显示 Huh7 中 BAP1 的 mRNA 表达水平并未下降(图 5B),提示 Huh7 细胞系中 BAP1 的表达缺失可能涉及到蛋白质翻译后修饰的调控。
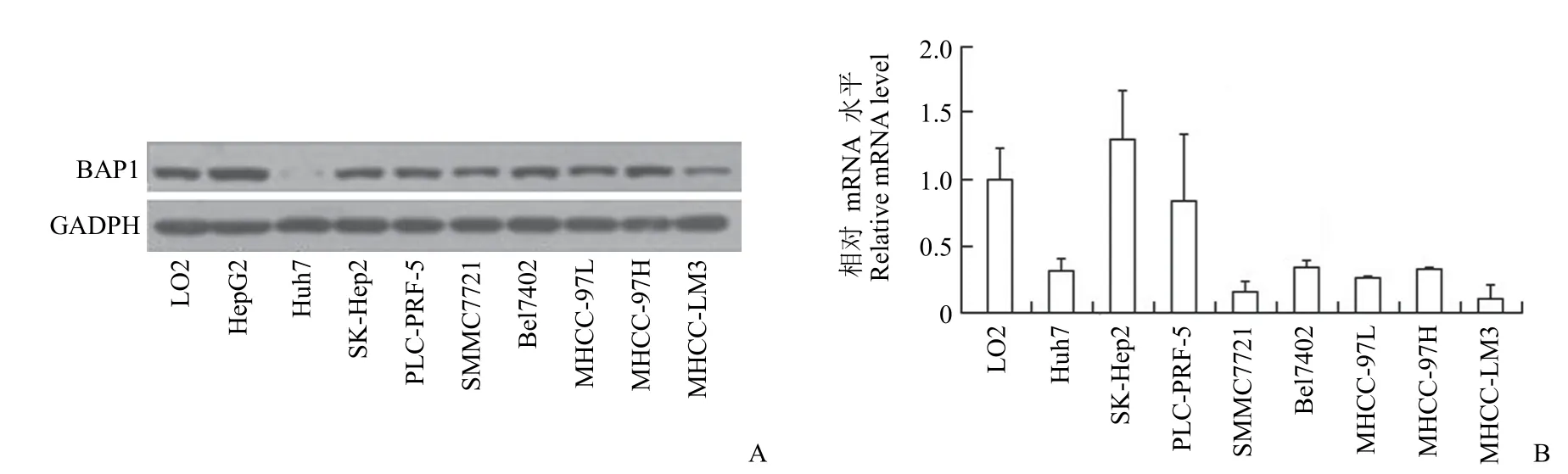
图5 BAP1在肝癌细胞系中的表达变化(A:蛋白表达水平;B:mRNA 表达水平)Figure 5 Expression changes of BAP1 in hepatoma cell lines (A:Protein expression level;B:mRNA expression level)
根据 BAP1 在不同肝癌细胞系中的基础表达水平,利用 shRNA 技术,成功建立了BAP1 稳定敲除的 SMMC7721 和 Bel7402 肝癌细胞系(图6A)。利用 CCK8 检测试剂盒检测细胞增殖情况,发现 BAP1 敲低抑制肝癌细胞的增殖(图 6B)。Transwell 实验证实 BAP1 敲低抑制肝癌细胞迁移(图 6C)。
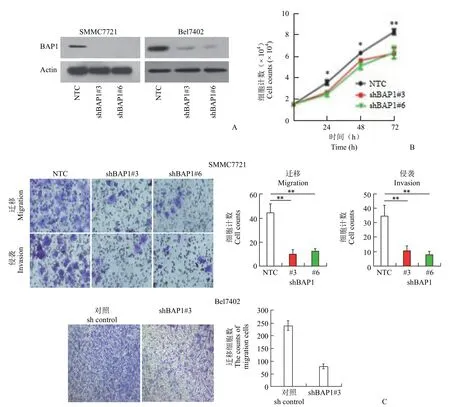
图6 BAP1 敲低抑制肝癌细胞的生长和迁移(A:SMMC7721 和 Bel7402 细胞系 BAP1 敲低稳定株构建成功;B:细胞增殖检测;C:细胞迁移、侵袭检测和统计学分析;*P <0.05,**P <0.01)Figure 6 BAP1 knockdown inhibited the growth and migration of HCC cells (A:SMMC7721 and Bel7402 cell lines BAP1 were successfully constructed;B:Cell proliferation detection;C:Cell migration,invasion and statistical analysis;*P <0.05,**P <0.01)
2.4 BAP1 敲低抑制 HCC 细胞在裸鼠皮下的成瘤能力
利用裸鼠皮下移植瘤模型检测 BAP1 在体内对肝癌细胞生长的影响,发现与对照组(NTC 组)相比较,BAP1 敲除的 SMMC7721 细胞在裸鼠皮下的生长变慢(图 7),提示 BAP1 敲低显著抑制肿瘤细胞生长。
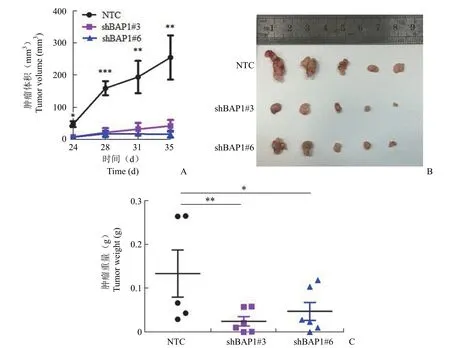
图7 BAP1 敲低抑制肝癌细胞在裸鼠皮下的生长[A:使用公式(长度 × 宽度2)/2 将平均肿瘤体积作为时间的函数作图,(*P <0.05、**P <0.01、***P <0.001),与对照组 BAP1 NTC 肿瘤进行比较;B:小鼠切除的肿瘤;C:肿瘤重量统计分析(*P <0.05、**P <0.01),与对照组 BAP1 NTC 肿瘤进行比较]Figure 7 BAP1 knockdown inhibits subcutaneous growth of hepatocellular carcinoma cells in nude mice[A:Plot average tumor volume as a function of time using the formula (length × width2 × 1/2) (*P <0.05,**P <0.01,***P <0.001) to compare with BAP1 NTC tumors in the control group;B:Tumors resected in mice;C:Statistical analysis of tumor weight (*P <0.05,**P <0.01) to compare with BAP1 NTC tumors in the control group]
2.5 BAP1 错义点突变抑制其促肿瘤生长的功能
为了进一步分析 BAP1 错义点突变对其功能的影响,构建了携带 BAP1 野生型及不同的突变体(包括 BAP1G45R、BAP1C91S、BAP1H169Q、BAP1F170V、BAP1W196G 和 BAP1W202L)的真核表达载体。分别将野生型和不同突变体的 BAP1过表达质粒转染致BAP1 敲低的 Bel7402 细胞和Huh7 细胞(BAP1 表达缺失)中。通过 G418 连续筛选,获得稳定过表达 BAP1 野生型和不同突变体的 Bel7402 和 Huh7 细胞系(图 8)。

图8 稳定过表达野生型和不同突变体 BAP1 的肝癌细胞系的建立Figure 8 Establishment of HCC cell lines stably overexpressing wild-type and different mutants of BAP1
利用经典的克隆形成实验分析错义点突变对BAP1 促细胞增殖的影响。细胞培养 3 周后进行平板计数,发现 BAP1 敲低细胞增殖受到抑制,而当过表达入 pcDNA3.1(-) 载体的 BAP1WT 质粒后,细胞增殖数目有所增多,而过表达 BAP1G45R、
BAP1C91S、BAP1H169Q、BAP1F170V、BAP1W196G
和 BAP1W202L 这 6 个突变体后,Bel7402 细胞的增殖能力受到明显抑制(P<0.01)(图 9A)。同时,利用 Huh7 细胞检测错义点突变对 BAP1 功能的影响。细胞培养 3 周后统计克隆形成率,检测这 9 种细胞的增殖能力,发现与对照组(BAP1 WT)相比,BAP1 突变的细胞株增殖能力受到明显抑制(图 9B)。
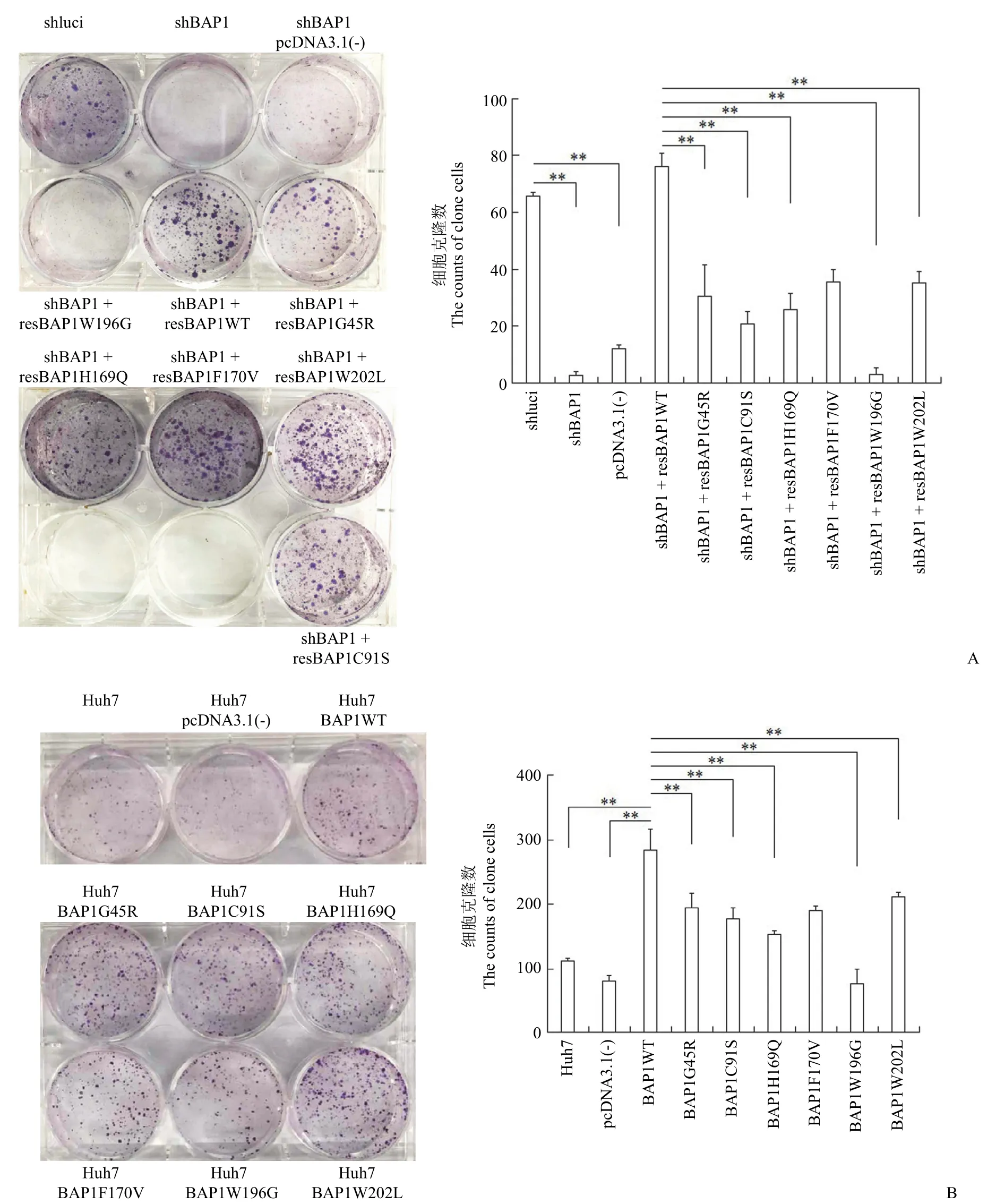
图9 BAP1 错义点突变对肝癌细胞生长的影响[A:Bel7402 克隆形成实验检测细胞增殖和统计学分析(**P <0.01);B:Huh7 克隆形成实验检测细胞增殖和统计学分析(**P <0.01)]Figure 9 Effects of BAP1 missense point mutation on the growth of hepatoma cells[A:Cell proliferation and statistical analysis by Bel7402 clone formation assay (**P <0.01);B:Huh7 clone formation assay to detect cell proliferation and statistical analysis (**P <0.01)]
2.6 BAP1 错义点突变抑制其促肿瘤迁移的功能
利用 transwell 实验检测细胞的迁移能力,结果显示 BAP1 敲低细胞迁移能力受到抑制,而当过表达入 pcDNA3.1(-) 载体的 BAP1WT 质粒后,细胞迁移能力增强,过表达 BAP1G45R、BAP1C91S、BAP1H169Q 、 BAP1F170V 、 BAP1W196G 和BAP1W202L 这 6 个突变体后,Bel7402 细胞的迁移能力受到明显抑制(P<0.01)(图 10A)。同时利用 Huh7 细胞系检测细胞迁移能力,结果显示G45R 和 W196G 突变显著抑制了 BAP1 促进细胞迁移的能力(图 10B)。

图10 BAP1 错义点突变对肝癌细胞迁移能力的影响[A:Bel7402 transwell 检测细胞迁移和统计学分析(**P <0.01);B:Huh7 transwell 检测细胞迁移和统计学分析(**P <0.01,***P <0.001)]Figure 10 Effects of BAP1 missense point mutation on migration of hepatoma cells[A:Bel7402 transwell assay for cell migration and statistical analysis (**P <0.01);B:Huh7 transwell assay for cell migration and statistical analysis (**P <0.01,***P <0.001)]
2.7 BAP1 错义点突变抑制其促进裸鼠成瘤的能力
为进一步在体内验证错义点突变对 BAP1 功能的影响,利用裸鼠皮下移植瘤实验,检测过表达野生型 BAP1 和突变型 BAP1(G45R 和 W196G)对肝癌细胞 Bel7402 裸鼠皮下移植瘤生长能力的影响。选用 6~7 周龄的裸鼠皮下注射稳定过表达BAP1 野生型和突变体的肝癌细胞,通过两个参数——肿瘤体积生长速率(mm3/d)和最终肿瘤体积(mm3)分析。肿瘤细胞注射 35 d 后,发现 BAP1 WT 组肿瘤体积最终达到 138 mm3,而 BAP1G45R组和 RAP1W196G 组最终体积分别为 37 mm3和48 mm3,显著小于对照组(WT),提示 G45R 和W196G 位突变抑制了 BAP1 的促瘤作用,如图 11所示。

图11 BAP1 错义点突变对肝癌细胞在裸鼠皮下生长的影响[A:肿瘤重量统计分析 **P <0.01,与 WT BAP1 肿瘤进行比较;B:裸鼠成瘤;C:小鼠切除的肿瘤;D:使用公式(长度 × 宽度2)/2 将平均肿瘤体积作为时间的函数作图,*P <0.05、**P <0.01,与 WT BAP1 肿瘤进行比较]Figure 11 Effect of BAP1 missense point mutation on subcutaneous growth of hepatocellular carcinoma cells in nude mice[A:Statistical analysis of tumor weight **P <0.01,compared with WT BAP1 tumors;B:Tumor formation in nude mice;C:Tumors resected in mice;D:Average tumor volume plotted as a function of time using the formula (length × width2 × 1/2),*P <0.05,**P <0.01,compared with WT BAP1 tumors]
3 讨论
人类 BAP1 基因定位于 3 号染色体(3p21),在很多肿瘤细胞中该区域都会出现缺失或重排[16]。BAP1 作为一个 DUBs,可通过与多种蛋白形成三元复合体结构,在不同类型的细胞中发挥调节细胞生理活动、促进细胞增殖和细胞周期的功能[17-18],干扰细胞中的 BAP1 表达时,会出现细胞 G1/S期过度延迟;敲除 BAP1 后,细胞生长减缓[19]。近年来尽管有研究报道 BAP1 在 HCC 组织中存在突变,但其突变和表达的临床意义以及在 HCC发生发展中的功能作用未见任何报道。
在本研究中,我们阐明了 BAP1 体细胞突变和表达与 HCC 的临床相关性,通过分析 TCGA 数据库 375 例 HCC 患者的 377 个样本(包含 2 例复发的样本),共 44 845 个体细胞突变数据,发现与正常肝组织相比,BAP1 在 22 例 HCC 组织样本中存在显著突变,此外,我们结合 BAP1 的 RNA表达量(RNA-Seq)数据分析,发现 BAP1 mRNA在 HCC 组织中高表达,生存分析数据显示 BAP1 mRNA 高表达与病人预后差密切相关。结合TGCA临床数据发现,BAP1 突变的 HCC 组织中,mRNA水平均显著下降,生存分析数据显示 BAP1 突变与病人良好预后密切相关,提示 BAP1 突变抑制肿瘤的生长,BAP1 突变在 HCC 中作为一个抑癌因子发挥功能。同时,经过 Western blot 检测了BAP1 在多种肝癌细胞中高表达。进而建立了BAP1 稳定敲低的肝癌细胞系,发现 BAP1 敲低能够抑制细胞增殖、迁移能力以及抑制裸鼠的成瘤等生物学特性,提示 BAP1 在 HCC 组织中发挥一定的促癌功能。
然而本研究仍然有很多问题没有解决,比如缺乏本地肝癌样本测序数据对 BAP1 的突变频率、类型与其表达的变化的分析,缺乏 PDTX(patient-derived tumor xenograft)小鼠模型[20]对BAP1 突变的 HCC 样本在体内生长、转移及耐药特性的分析;在 BAP1 作用机制方面,BAP1 为何在肿瘤细胞中高表达、其具体的机制是什么、BAP1突变发挥抑癌作用的具体机制是什么、是否依赖其去泛素化功能发挥作用?这些问题需要我们进一步筛选并鉴定肝癌细胞中 BAP1 相互作用蛋白,揭示其作用的分子机制,探索 BAP1 突变对其去泛素化酶功能及其靶蛋白泛素化状态的影响,BAP1 的突变及其影响的靶蛋白去泛素化在HCC生长转移中的作用。
虽然目前 BAP1 在 HCC 中的作用机制尚未明确,但是我们可以通过了解 BAP1 已知的底物及作用机制作为研究的理论基础。BAP1 和 ASXL1可组成多梳组抑制去泛素化复合物(polycomb group repressive deubiquitinase complex,PR-DUB),参与调节基因沉默。敲除 BAP1 基因,会明显影响 PcG基因的表达。PcG 蛋白是形成多种蛋白复合物的一组蛋白,参与多种生理学进程,由两个核心复合体PRC1(polycomb repressive complex 1)和 PRC2(polycomb repressive complex 2)组成,分别负责组胺泛素化和甲基化。PRC2 中的催化亚基 EZH2组胺甲基转移酶可催化组胺 H3 赖氨酸 27 三甲胺(H3K27me3),这个与染色质转录阻抑相关,是PcG 蛋白引起基因沉默的标志,并为 PRC1 的识别和结合提供位点。PRC1 中 BMI-1/RING1 的E3 连接酶亚基使组胺 H2A 的赖氨酸 119 泛素化(H2AK119Ub1),可修复抑制状态的染色质和使基因沉默。H2AK119Ub1 被认为通过诱导染色质结构的改变来抑制 RNA 多聚合酶复合物的稳定性,最终导致转录沉默[21]。这些发现提示 BAP1 转录失调是一种潜在的致癌机制[22]。目前已知的 BAP1的另一底物是 HCF-1(hot cell factor-1),HCF-1 由HCF-1N 和 HCF-1C 组成,参与众多组胺修饰活动,调控细胞周期进程[23]。
BAP1 在其他类型肿瘤中作用机制的研究方法和结论同样也值得我们学习参考。例如:童也等[24]在 2020年通过对从 GEO 数据库中获取的BAP1 敲低的骨肉瘤细胞芯片数据集的研究分析发现,与骨肉瘤细胞比较,BAP1 敲低的骨肉瘤细胞中共筛选出差异表达基因 461 个,其中上调64 个、下调 397 个,主要富集的信号通路有细胞周期和 DNA 复制相关通路,BAP1 敲低的骨肉瘤细胞差异表达基因蛋白互作网络中度值的核心基因是 CDK1。在 BAP1 抑制条件下,骨肉瘤细胞CDK1 表达同时下调,两者协同影响骨肉瘤的发生、发展。Liu 等[25]通过在 6 个头颈鳞状细胞癌(HNSCC)细胞系、3 个人乳头瘤病毒(human papillomavirus,HPV)阴性和 3 个 HPV 阳性中过表达、敲除和保留了 BAP1,并在体外和在 HNSCC小鼠异种移植模型中检测其对放射敏感性的影响印证了 BAP1 可能通过 H2Aub 的泛素化和 HR的调节而诱导 HNSCC 细胞的辐射抗性,且与HNSCC 患者预后差有关,可能是治疗 HNSCC 的潜在靶点。Jha 等[26]为研究 BAP1 与葡萄膜黑色素瘤的关系,将 69 例患者分为 a 组(lbd >15 mm &tumor thickness ≥ 8 mm)和 b 组(lbd ≤ 15 mm &tumor thickness <8 mm),接受免疫组织化学治疗,评估了 BAP1 蛋白的表达,对每组 5 例标本进行BAP1 基因突变分析。研究发现,ATM 与 BAP1 的丢失是一个独立的预后标志物,会导致转移风险的增加。
本研究为我们深入理解去泛素化酶调控肝细胞癌的发生发展的作用和分子机制积累数据,可为临床 HCC 靶向治疗药物的设计提供理论依据,为临床肿瘤的诊断、治疗等提供新思路,具有重要的科学意义。
——一道江苏高考题的奥秘解读和拓展

