不同荧光标记检测抗体组合及不同抗凝剂对流式测定食蟹猴T淋巴细胞亚群的影响
姜华,刘丽,李路路,苗玉发,文海若,孙立,王欣,张颖丽,李伟,霍艳,耿兴超
作者单位:100176 北京,中国食品药品检定研究院/国家药物安全评价监测中心药物非临床安全评价研究北京市重点实验室
流式细胞术是当代最先进的细胞定量分析技术之一,在细胞分子水平上可通过荧光标记的单克隆抗体对单个细胞或其他生物因子进行多参数、快速、准确的定量分析。目前新药非临床研究中运用流式细胞仪进行实验动物外周血淋巴细胞及其亚群检测是新药安全性评价的重要组成部分,尤其是对于具有潜在免疫毒性的药物。T 淋巴细胞是淋巴细胞的重要类型,分为辅助性 T 淋巴细胞(T helper cells,Th)和细胞毒性 T 淋巴细胞(cytotoxic T lymphocyte,CTL),可发挥细胞免疫及免疫调节等功能。测定 T 淋巴细胞亚群对于评价药物对机体免疫功能的影响有重要意义。T 淋巴细胞亚群检测结果主要与种属、性别、年龄、病原体感染、免疫状态等有关[1-4],此外,用流式方法检测时涉及到多种处理因素,包括使用不同的荧光标记 CD3、CD4和 CD8 检测抗体,检测过程可能使用不同的血液抗凝剂、固定液,有无凝血、溶血情况,这些因素可能会对测定结果有影响。目前这方面的报道较少,并且很少在 GLP 实验室开展[5-7]。
本研究在 GLP 实验室条件下分别应用两组不同的荧光标记检测抗体组合测定食蟹猴外周血 T淋巴细胞亚群;此外,分别采用流式试验中常用的两种抗凝剂肝素钠和乙二胺四乙酸二钾(EDTA-K2)处理全血样本,通过比较不同条件下食蟹猴外周血 T 淋巴细胞亚群的测定结果,分析以上因素对检测结果的影响,为相关检测提供方法参考。
1 材料与方法
1.1 材料
1.1.1 实验动物 3~4 岁食蟹猴 320 只,雌雄各半,普通级,由广西桂东灵长类开发实验有限公司提供。动物生产许可证号为 SCXK(桂)2011-0001 和 SCXK(桂)2016-0001。饲养于国家药物安全评价监测中心的普通级动物房内,单笼饲养,自由饮水,每天定量给饲料和水果(各 150 g),自由摄取。饲养温度和湿度分别控制在 16~26 ℃和 40%~70%,每小时换气次数不少于 8 次,照明时间是每天 12 h,饲养 3 周,适应环境后采血测定。
1.1.2 仪器与试剂 FACSCalibur 流式细胞仪,分析软件 Cell QuestTM,流式仪校准微球(BD CalibriteTM 3-color、APC bead),流式检测抗体异硫氰酸荧光素标记的抗 CD8 抗体 FITC-CD8(批号:7312538)、PE-CD4(批号:9172628)、FITC-CD4(批号:519762)、PE-CD8(批号:7191542)、PerCP-CD3(批号:8124735)和 EDTA-K2抗凝管(货号:365974,批号:8156867)均购自美国 BD公司;H-60R 高速离心机为日本 Kokusan 公司产品;红细胞裂解液主要成分氯化铵(批号:20161208)、碳酸氢钾(批号:20150924)、乙二胺四乙酸二钠(批号:20140328)和多聚甲醛(批号:20150120)购自国药集团;磷酸盐缓冲液(批号:AD22391274、AE29005278)购自美国 Hyclone 公司;多聚甲醛(批号:20150120)使用前经 PBS 稀释为 1% 的应用液;肝素钠抗凝管购自江苏康健医疗用品有限公司(货号:KJ020SH,批号:190101)。
1.2 方法
1.2.1 血样采集
1.2.1.1 用于比较不同荧光标记抗体检测结果的血样采集和抗凝处理 食蟹猴前臂静脉采血,采集0.3~0.5 ml 全血,加入到有肝素钠的抗凝管中混匀,每种检测抗体组合采血动物数 160 只,雌雄各半。
1.2.1.2 用于比较不同抗凝剂处理后检测结果的血样采集和抗凝处理 食蟹猴前臂静脉采血,采集0.3~0.5 ml 全血,采血动物数 22 只,雌雄各半。各取 22 只猴血样分别加入到有肝素钠或 EDTA-K2的抗凝管中混匀。
1.2.2 样本制备和分析
1.2.2.1 比较不同检测抗体组合对 T 淋巴细胞亚群测定结果影响的样本制备和分析 分别取荧光检测抗体组合 PerCP-CD3/FITC-CD8/PE-CD4(检测抗体组合 1)和 PerCP-CD3/FITC-CD4/PE-CD8(检测抗体组合 2)各 5 μl,与 1.2.1.1 中肝素钠抗凝血 50 μl 混合,在室温下避光孵育 20~30 min后,在管中加入红细胞裂解液,将其混匀,裂解时间为 5~8 min, 200 ×g离心 5 min,弃去上清液,加入 PBS 清洗一次,加入 PBS-1% 多聚甲醛重悬细胞,上机测定。上机检测前,先用流式仪的校准微球做质控,质控通过后上样。需要在散点图上设门,圈住淋巴细胞群,用空白或同型对照管、单荧光管来调节电压和荧光补偿,每个样品收集淋巴细胞 5000 个,分析 CD3+CD4+和 CD3+CD8+T 淋巴细胞亚群百分比和平均荧光强度(MFI)。
1.2.2.2 比较不同抗凝剂对 T 淋巴细胞亚群测定结果影响的样本制备和分析 将 22 份肝素钠抗凝血 50 μl 或 22 份 EDTA-K2抗凝血 50 μl分别与两组检测抗体组合进行孵育,样本制备和分析方法同 1.2.2.1。所有血样均在采集后 4 h 内进行制备与测定分析。
1.3 统计学处理
结果以±s的形式表示, 采用TOXSTAT2006 统计软件,对两组数据进行正态性检验,在符合正态性的情况下,进行方差分析(F检验),如果为等方差,进行 Student-t检验;如果为异方差,在 n1=n2 时,进行 Aspin-Welch 检验。当P<0.05 时认为差异有统计学意义。
2 结果
2.1 不同荧光标记检测抗体对淋巴细胞亚群分类结果的影响
雌性食蟹猴 CD3+CD4+淋巴细胞百分比、CD3+CD8+淋巴细胞百分比及 CD4+/CD8+比值在两组检测抗体组合均有显著性差异(表 1,均P<0.01)。用 FITC 标记抗体检测到的 CD4+淋巴细胞(FITC-CD4+)百分比显著低于用 PE 标记抗体检测到的 CD4+淋巴细胞(PE-CD4+)百分比,降低的幅度为 13%,同时,FITC-CD4+淋巴细胞平均荧光强度 MFI 显著低于 PE-CD4+淋巴细胞MFI,仅约为后者的 4%。PE-CD8+淋巴细胞百分比显著高于 FITC-CD8+淋巴细胞百分比,增加的幅度为 18%,同时,FITC-CD8+淋巴细胞平均荧光强度 MFI 显著低于 PE-CD8+淋巴细胞 MFI,仅约为后者的 9%;应用检测抗体组合 2 的CD3+CD4+/CD3+CD8+淋巴细胞比值显著低于应用检测抗体组合 1 的,降低的幅度为 24%。雄性食蟹猴也有相似检测结果(表 1,P<0.05 或P<0.01),细胞百分比变化的幅度低于雌性动物,而MFI 的变化幅度与雌性动物非常接近。分别应用两种检测抗体组合测定的食蟹猴 T 淋巴细胞亚群分布区间结果与统计结果的趋势相符合(表 2 和表 3)。
表1 两组荧光检测抗体组合食蟹猴 T 淋巴细胞亚群测定结果比较(±s)Table 1 Data comparison of T lymphocyte subsets in cynomolgus monkeys determined by two fluorescence detection antibody combinations (±s)

表1 两组荧光检测抗体组合食蟹猴 T 淋巴细胞亚群测定结果比较(±s)Table 1 Data comparison of T lymphocyte subsets in cynomolgus monkeys determined by two fluorescence detection antibody combinations (±s)
注:检测抗体组合 2 与检测抗体组合 1 组比较,*P <0.05,**P <0.01;检测抗体组合 1:PerCP-CD3/FITC-CD8/PE-CD4;检测抗体组合 2:PerCP-CD3/FITC-CD4/PE-CD8;CD3+CD4+ 百分比:CD3+CD4+ 淋巴细胞占 T 淋巴细胞的百分比;CD3+CD8+ 百分比:CD3+CD8+ 淋巴细胞占 T 淋巴细胞的百分比。Notes:Comparing between the data using two fluorescence detection antibody combinations,*P <0.05,**P <0.01;Detection antibody combination 1:PerCP-CD3/FITC-CD8/PE-CD4;Detection antibody combination 2:PerCP-CD3/FITC-CD4/PE-CD8;CD3+CD4+ percent:Percent of CD3+CD4+ lymphocyte in total T lymphocytes;CD3+CD8+ percent:Percent of CD3+CD8+ lymphocyte in total T lymphocytes.
组别例数CD3+CD4+CD3+CD8+CD4+/CD8+平均荧光强度性别Gender Groups Cases百分比(%)CD3+CD4+percent (%)百分比(%)CD3+CD8+percent (%)Mean fluorescence intensity CD4+ 细胞CD4+ cell CD8+ 细胞CD8+ cell雌性Female检测抗体组合 1 Detection antibody combination 1检测抗体组合 2 Detection antibody combination 2 80 54.94 ± 7.78 38.55 ± 7.55 1.52 ± 0.50 1556.77 ± 321.84 196.18 ± 92.14 80 47.94 ± 10.05**45.52 ± 10.19**1.15 ± 0.48**61.45 ± 16.16** 2212.35 ± 399.26**雄性Male检测抗体组合 1 Detection antibody combination 1 80 49.80 ± 8.34 43.20 ± 7.90 1.23 ± 0.45 1555.03 ± 276.15 194.73 ± 81.78检测抗体组合 2 Detection antibody combination 2 80 46.80 ± 9.04* 46.72 ± 9.00** 1.08 ± 0.44* 61.22 ± 12.09** 2246.61 ± 360.02**

表2 检测抗体组合 1 组食蟹猴 T 淋巴细胞亚群测定结果分布区间Table 2 Data distribution interval of T lymphocyte subsets in cynomolgus monkeys determined by detection antibody combination 1

表3 检测抗体组合 2 组食蟹猴 T 淋巴细胞亚群测定结果分布区间Table 3 Data distribution interval of T lymphocyte subsets in cynomolgus monkeys determined by detection antibody combination 2
2.2 不同抗凝剂处理对淋巴细胞亚群百分比的影响
应用抗体组合 1(PerCP-CD3/FITC-CD8/PECD4)检测时,与肝素钠抗凝组相比,EDTA-K2抗凝剂组 CD3+CD4+淋巴细胞百分比显著增加(表 4,P<0.05),增加的幅度为 13%;CD3+CD8+淋巴细胞百分比显著降低(表 4,P<0.01),下降的幅度为 52%;CD3+CD4+/CD3+CD8+淋巴细胞比值显著增加,均值从 1 增加到 3.27(表 4,P<0.01)。应用抗体组合 2(PerCP-CD3/FITC-CD4/PECD8)检测时,发现两种抗凝剂组的 CD3+CD4+和CD3+CD8+淋巴细胞百分比及比值无显著性差异。
表4 两种抗凝剂处理组食蟹猴 T 淋巴细胞亚群百分比和比值结果(±s)Table 4 Percentage and ratio of T lymphocyte subsets in cynomolgus monkeys using two anticoagulants (±s)

表4 两种抗凝剂处理组食蟹猴 T 淋巴细胞亚群百分比和比值结果(±s)Table 4 Percentage and ratio of T lymphocyte subsets in cynomolgus monkeys using two anticoagulants (±s)
注:EDTA-K2 与肝素钠抗凝剂组比较,*P <0.05,**P <0.01;检测抗体组合 1:PerCP-CD3/FITC-CD8/PE-CD4;检测抗体组合 2:PerCP-CD3/FITC-CD4/PE-CD8;CD3+CD4+ 细胞百分比:CD3+CD4+ 淋巴细胞占 T 淋巴细胞的百分比;CD3+CD8+ 细胞百分比:CD3+CD8+ 淋巴细胞占 T 淋巴细胞的百分比。Notes:Comparing between the data obtained using anticoagulant EDTA-K2 or heparin sodium,*P <0.05,**P <0.01;Detection antibody combination 1:PerCP-CD3/FITC-CD8/PE-CD4;Detection antibody combination 2:PerCP-CD3/FITC-CD4/PE-CD8;CD3+CD4+ cell percent:Percent of CD3+CD4+lymphocyte in total T lymphocytes;CD3+CD8+ cell percent:Percent of CD3+CD8+ lymphocyte in total T lymphocytes.
组别Groups抗凝剂Anticoagulants例数Cases CD3+CD4+ 百分比(%)CD3+CD4+ percent (%)CD3+CD8+ 百分比(%)CD3+CD8+ percent (%)CD4+/CD8+检测抗体组合 1 Detection antibody combination 1 EDTA-K2 22 49.47 ± 9.61* 22.87 ± 12.42** 3.27 ± 2.92**肝素钠 Heparin sodium22 57.35 ± 9.52 33.36 ± 8.63 1.92 ± 0.88肝素钠 Heparin sodium22 43.80 ± 8.96 47.48 ± 9.55 1.00 ± 0.44检测抗体组合 2 Detection antibody combination 2 EDTA-K2 22 54.18 ± 9.49 34.98 ± 9.93 1.74 ± 0.74
2.3 不同抗凝剂处理对于淋巴细胞亚群 MFI 的影响
应用抗体组合 1(PerCP-CD3/FITC-CD8/PECD4)检测时,EDTA-K2抗凝剂组 FITC-CD8+MFI显著低于肝素钠抗凝组(表 5,P<0.01,图 1 和图 2),仅为肝素钠抗凝组的 13%。应用抗体组合 2(PerCP-CD3/FITC-CD4/PE-CD8)检测时,发现有相同的变化趋势,即 EDTA-K2抗凝剂组 PE-CD8+MFI 比肝素钠组显著降低(表 5,P<0.01,图 1和图 2),仅为肝素钠抗凝组的 16%;EDTA-K2组比肝素钠组 FITC-CD4+MFI 显著升高(表 5,P<0.05),但升高的幅度不大,仅为 8%;未见其他显著性变化。

图1 肝素钠抗凝检测抗体组合 1(PerCP-CD3/FITC-CD8/PE-CD4)(A)和抗体组合 2(PerCP-CD3/FITC-CD4/PE-CD8)(B)食蟹猴 CD3+CD4+ 和 CD3+CD8+ T 淋巴细胞 MFIFigure 1 MFI of CD3+CD4+ and CD3+CD8+ T lymphocytes in cynomolgus monkeys determined by detection antibody combination 1 (PerCP-CD3/FITC-CD8/PE-CD4) (A) and combination 2 (PerCP-CD3/FITC-CD4/PE-CD8) (B) with heparin sodium as anticoagulant

图2 EDTA-K2 抗凝检测抗体组合1(PerCP-CD3/FITC-CD8/PE-CD4)(A)和抗体组合2(PerCP-CD3/FITC-CD4/PE-CD8)(B)食蟹猴 CD3+CD4+ 和 CD3+CD8+ T 淋巴细胞 MFIFigure 2 MFI of CD3+CD4+ and CD3+CD8+ T lymphocytes in cynomolgus monkeys determined by detection antibody combination 1 (PerCP-CD3/FITC-CD8/PE-CD4) (A) and combination 2 (PerCP-CD3/FITC-CD4/PE-CD8) (B) with EDTA-K2 as anticoagulant
表5 两种抗凝剂处理组食蟹猴 T 淋巴细胞亚群 MFI 结果(±s)Table 5 MFI of T lymphocyte subsets in cynomolgus monkeys using two anticoagulants (±s)
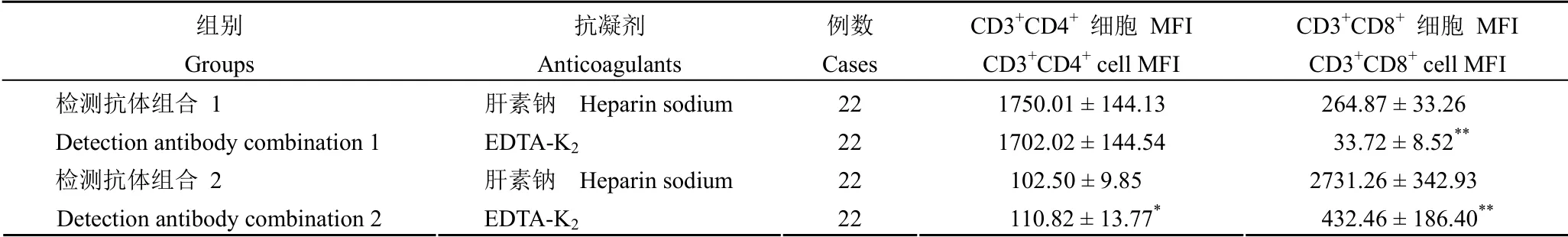
表5 两种抗凝剂处理组食蟹猴 T 淋巴细胞亚群 MFI 结果(±s)Table 5 MFI of T lymphocyte subsets in cynomolgus monkeys using two anticoagulants (±s)
注:EDTA-K2 与肝素钠抗凝剂组比较,*P <0.05,**P <0.01;检测抗体组合 1:PerCP-CD3/FITC-CD8/PE-CD4;检测抗体组合 2:PerCP-CD3/FITC-CD4/PE-CD8;CD3+CD4+ 细胞 MFI:CD3+CD4+ 细胞平均荧光强度;CD3+CD8+ 细胞 MFI:CD3+CD8+ 细胞平均荧光强度。Notes:Comparing between the data obtained using anticoagulant EDTA-K2 or heparin sodium,*P <0.05,**P <0.01;Detection antibody combination 1:PerCP-CD3/FITC-CD8/PE-CD4;Detection antibody combination 2:PerCP-CD3/FITC-CD4/PE-CD8;CD3+CD4+ cell MFI:Mean fluorescence intensity of CD3+CD4+ lymphocyte;CD3+CD8+ cell MFI:Mean fluorescence intensity of CD3+CD8+ lymphocyte.
组别Groups抗凝剂Anticoagulants例数Cases CD3+CD4+ 细胞 MFI CD3+CD4+ cell MFI CD3+CD8+ 细胞 MFI CD3+CD8+ cell MFI检测抗体组合 1 Detection antibody combination 1 EDTA-K2 22 1702.02 ± 144.54 33.72 ± 8.52**肝素钠 Heparin sodium 22 102.50 ± 9.85 2731.26 ± 342.93肝素钠 Heparin sodium 22 1750.01 ± 144.13 264.87 ± 33.26检测抗体组合 2 Detection antibody combination 2 EDTA-K2 22 110.82 ± 13.77* 432.46 ± 186.40**
3 讨论
CD3、CD4 和 CD8 分别是总 T 淋巴细胞、Th 细胞和 CTL 细胞的主要表面标志物,Th 细胞可诱导和增强细胞免疫和体液免疫,CTL 细胞具有抑制体液免疫和杀伤靶细胞的功能,各亚群协同作用,共同维护机体的正常免疫功能。当 T 淋巴细胞亚群数量或比例发生异常,机体免疫可能会出现紊乱[1-3]。在流式细胞术中,标记抗体所用的荧光素一般为 FITC、R-藻红蛋白(R phycoerythrin,PE)、异藻蓝蛋白(allophycocyanin,APC)、叶绿素蛋白(phyllochlorin,PerCP)、Alexa Fluor、藻红蛋白-花菁染料 Cy7 复合荧光(PE-Cy7)、藻红蛋白-花菁染料 Cy5 复合荧光(PE-Cy5)等[4,8]。选用不同荧光标记抗 CD3、CD4 或 CD8 抗原的抗体,通过与相应细胞上的表面标志物结合,可检测 T 淋巴细胞亚群。作为非人灵长类,食蟹猴与人的免疫系统较为接近,是生物技术药物安全性评价的常用动物种属。本研究在 GLP 实验室条件下分别应用两组不同的三色荧光标记检测抗体组合(PerCPCD3/FITC-CD8/PE-CD4)(检测抗体组合 1)和PerCP-CD3/FITC-CD4/PE-CD8(检测抗体组合 2)测定食蟹猴外周血 T 淋巴细胞亚群 CD3+CD8+细胞和 CD3+CD4+细胞,筛选更优的荧光标记检测抗体,提高研究结果可靠性。
研究发现,在雌、雄食蟹猴,无论 CD4+或CD8+T 淋巴细胞,用 FITC 荧光标记的抗体进行检测时,相应细胞百分比均显著低于用 PE 荧光标记抗体检测的结果,雌性动物差异更为明显。同时发现,用 FITC 标记抗体检测的 CD4+或 CD8+淋巴细胞的 MFI 显著低于用 PE 标记抗体检测的相应细胞 MFI,前者仅为后者的 4% 或 9%。已有研究显示,FITC 与 PE 的荧光强度、稳定性以及荧光淬灭衰减速率等特性存在差异。FITC 具有优良的荧光量子产率和良好的水溶性,是生物学中应用非常广泛的一种荧光素,其最大吸收光波长为 490~495 nm,最大发射光波长为 520~530 nm,在蓝光激发下呈绿色荧光,但由于绿光与蓝光的斯托克位移小,存在一定的背景光干扰。另外 FITC 较 PE 容易淬灭,葡萄糖在葡萄糖氧化酶的作用下会产生葡萄糖酸,葡萄糖酸可以淬灭FITC[9]。PE 是一种从海藻中提取出来的水溶性捕光色素蛋白,吸收光波长为 490~560 nm,发射光波长为 595 nm,激发后呈明亮的红色荧光,发射光受激发光影响小,荧光几乎不受生物质本底荧光影响。PE 含有更多的色基基团,具有保守、相对稳定的结构,不易淬灭,具有良好的生物相容性、较高的 pH 稳定性、高摩尔消光系数、高荧光量子产率等性能。1 个分子的 PE 荧光强度在可比波长内至少相当于 30 个 FITC 或 100 个罗丹明分子,检测灵敏度显著高于传统的荧光染料,检测限可达 pmol/L[10-12]。有研究者进行了 PE 和 FITC分别标记抗猪瘟病毒荧光抗体检测灵敏度比较。PE标记的荧光抗体探针检测阳性微球均呈明亮的橘黄色荧光,检测的灵敏度是 FITC 标记抗体探针检测灵敏度的 10 倍[13]。另有研究者发现 PE 标记荧光抗体探针检测禽流感病毒的灵敏度是 FITC 标记抗体探针检测的 5 倍[14]。以上研究结果与本研究结果相一致或接近。由于 PE 和 FITC 处在同一波长上,利用一种光源系统就能观察到两种颜色,而且两者所激发的荧光颜色成鲜明的对比,因此可以用于流式细胞仪的双重或多重免疫染色定量分析[13]。本研究结果中 FITC 标记抗体检测细胞百分比的降低,可能是由于 FITC 荧光强度低、存在背景光干扰和容易淬灭的特性,也可能是 FITC 标记抗体与 CD3+CD4+细胞或 CD3+CD8+细胞的结合均弱于 PE 荧光标记抗体与相应细胞的结合。
目前,在新药非临床安全性评价中用流式方法检测淋巴细胞亚型时,对于抗凝剂的选择没有统一的标准。本研究分别考察了使用抗凝剂肝素钠和EDTA-K2检测食蟹猴外周血 T 淋巴细胞亚群的结果,以优化试验条件,减少抗凝剂因素对试验结果的影响。肝素钠和 EDTA-K2是流式试验中常用的两种外周血抗凝剂。肝素钠的抗凝机制是能够与抗凝血酶(antithrombin,AT)结合,催化灭活凝血因子 IIa、IXa、Xa、Xia 和 XIIa。AT 有一个精氨酸反应中心可以和前述凝血因子的丝氨酸活化中心共价结合,从而使其失去活性,肝素钠与 AT 的结合可加速这种抗凝血作用。EDTA-K2的抗凝机制是能与血液中的 Ca2+螯合,使凝血酶原无法转化成有活性的凝血酶,同时抑制血小板聚集,从而起到抗凝作用[15]。
本研究结果显示,与肝素钠抗凝组相比,EDTA-K2抗凝剂组 CD8+淋巴细胞百分比和 CD8+细胞 MFI 均显著降低,下降的幅度很大。两种抗凝剂分别处理后 CD4+淋巴细胞百分比和 CD4+细胞 MFI 均无非常显著差异。提示肝素钠抗凝剂对于用荧光标记抗体检测食蟹猴外周血样本中T 淋巴细胞亚群没有明显影响,而 EDTA-K2抗凝剂对于 FITC 或 PE 荧光标记的抗 CD8 抗体检测食蟹猴外周血 CD8+T 淋巴细胞有非常明显的干扰作用,出现该结果的原因可能是由于 T 淋巴细胞激活需要将钙离子摄取到细胞内[16-18],而EDTA-K2抗凝的原理是螯合血液中钙离子,这种竞争作用会抑制 T 淋巴细胞的活性,但是否会抑制细胞表面 CD8 抗原的表达及是否与上述结果直接相关需要进一步研究。也有可能是 EDTA-K2影响抗 CD8 抗体与食蟹猴外周血 CD8+T 淋巴细胞的结合。本研究提示对于流式分析中外周血淋巴细胞表面标记,肝素钠抗凝剂优于 EDTA-K2抗凝剂。有研究者比较肝素钠、EDTA-K2和枸橼酸钠三种抗凝剂对于 6 份猪外周血 CD3+T 淋巴细胞、CD3+CD4+T 细胞、CD3+CD8+T 细胞测定结果的影响,发现在第 1、2、4 天检测时,三种抗凝剂组前述细胞数量无显著差异,结合更长时间的检测结果综合分析,肝素钠抗凝管测定结果优于EDTA-K2和枸橼酸钠抗凝[5]。另有研究选用 10 个健康人外周血,比较肝素钠和 EDTA-K2抗凝后不同时间、温度下的 CD3+、CD4+和 CD8+T 细胞、CD19+B 淋巴细胞百分比及绝对计数,结果发现EDTA-K2和肝素抗凝的标本在 4 ℃ 及室温保存至48 h 时,各类淋巴细胞百分比均无统计学差异[6]。这与本研究结果不同,可能是抗凝剂对人体和食蟹猴外周血淋巴细胞的影响存在种属差异,另外人外周血试验样本数也较少。
综上所述,本研究针对常用的两组三色荧光检测抗体和两种抗凝剂进行了食蟹猴外周血 T 淋巴细胞亚群测定结果比较分析,提示 FITC 荧光标记抗 CD4 抗体和抗 CD8 抗体检测相应细胞百分比和荧光强度均小于 PE 荧光标记的抗体,在应用这两种荧光标记抗体进行 T 淋巴细胞亚群检测时应注意对试验结果的影响和合理分析。使用 EDTA-K2抗凝对食蟹猴外周血 CD8+淋巴细胞测定结果有明显影响,在进行食蟹猴 T 淋巴细胞亚群测定时宜使用肝素钠抗凝剂。本次研究只针对常用的两组三色荧光检测抗体进行了比对,今后可进一步对其他检测抗体组合做相关研究。目前多色流式分析仪如 FACSCanto、FACSAria 和 LSRFortessa 等已经得到较多应用,确定不同荧光标记抗体对同时检测多种细胞是否有影响对于进行可靠的流式分析有重要意义,需要进行更多的关注和研究。

