SMARCC1的表达与脑胶质瘤临床指标和预后的相关性及其对肿瘤细胞增殖和凋亡的影响
沈晓莹,刘晶晶,陈曲波,亓垚,陈明敏,杨国翠,金杰,孟影,何红梅,袁鸽,郜恒骏
作者单位:201203 上海生物芯片有限公司/生物芯片上海国家工程研究中心(沈晓莹、刘晶晶、亓垚、陈明敏、杨国翠、金杰、孟影、何红梅、袁鸽、郜恒骏);510120 广州,广东省中医院生物资源中心(陈曲波)
脑胶质瘤是最常见和最致命的颅内肿瘤,具有侵袭性强、恶性高、进展快等特点,通常表现为对正常脑组织的破坏以及对整个大脑的广泛侵袭,常规的治疗方法不能对其产生较好的疗效[1-2]。世界卫生组织(WHO)根据其组织病理学将胶质瘤分为四级(I~IV)。即使是得到最佳治疗,胶质母细胞瘤(IV 级)的中位生存期仅为 12~15 个月[3-4]。因此,寻找新的靶点和深入了解分子生物学机制对于开发更有效的脑胶质瘤治疗策略是非常必要的。
SMARCC1(SWI/SNF related,matrix associated,actin dependent regulator of chromatin subfamily c member 1),也称为 BAF155,连同 SMARCA4、SMARCA2 和 SMARCB1 等均属于 SWI/SNF 蛋白质家族。SMARCC1 是一种螺旋酶和 ATP 酶,可以通过改变基因周围的染色质结构来调节该基因的转录。SMARCC1 是 ATP 依赖的 SWI/SNF染色质重塑复合物的一部分,它含有一个亮氨酸拉链基序,可以与许多典型的转录因子结合[5-6]。前期的文献报道显示,SMARCC1的表达与前列腺癌、结肠癌、胰腺癌、肾癌、肝癌、乳腺癌等多种癌症有关,但是研究结论却并不一致[7-17]。例如,Heebøll等[7]证实 SMARCC1 的蛋白表达与前列腺癌的Gleason 评分、临床 T 分期和复发时间等均显著正相关,有明显染色的患者更容易复发和转移,这证实了 SMARCC1 的促癌功能。但是,Hansen 等[8]却发现 SMARCC1 对前列腺癌有抑制作用,免疫组化阳性的临床局限性前列腺癌患者的无病生存期显著长于阴性患者。类似的,SMARCC1 在结肠癌的研究也显示了相互矛盾的结论[9-11]。而关于SMARCC1 在脑胶质瘤的研究鲜有报道。
本文采用免疫组化实验研究了 SMARCC1 蛋白表达与脑胶质瘤样本的临床指标及预后的相关性;随后利用 siRNA 技术降低了 SMARCC1 基因表达,以检测目标基因对于肿瘤细胞增殖和凋亡的影响;最后,采用 qPCR 技术检测了增殖和凋亡相关基因 ki67 和Bcl2 在 SMARCC1 下调前后的细胞中的表达变化。
1 材料与方法
1.1 材料
1.1.1 组织芯片 脑胶质瘤组织芯片(HBraG180Su01)来源于上海芯超生物科技有限公司,包含 180 例脑胶质瘤石蜡组织。病人的手术时间为 2008年2月到 2011年10月,随访到 2017年7月,随访时间 69~113 个月;失访1 例。大部分病人提供性别、年龄、病理分级、复发状况等临床信息(表 1)。
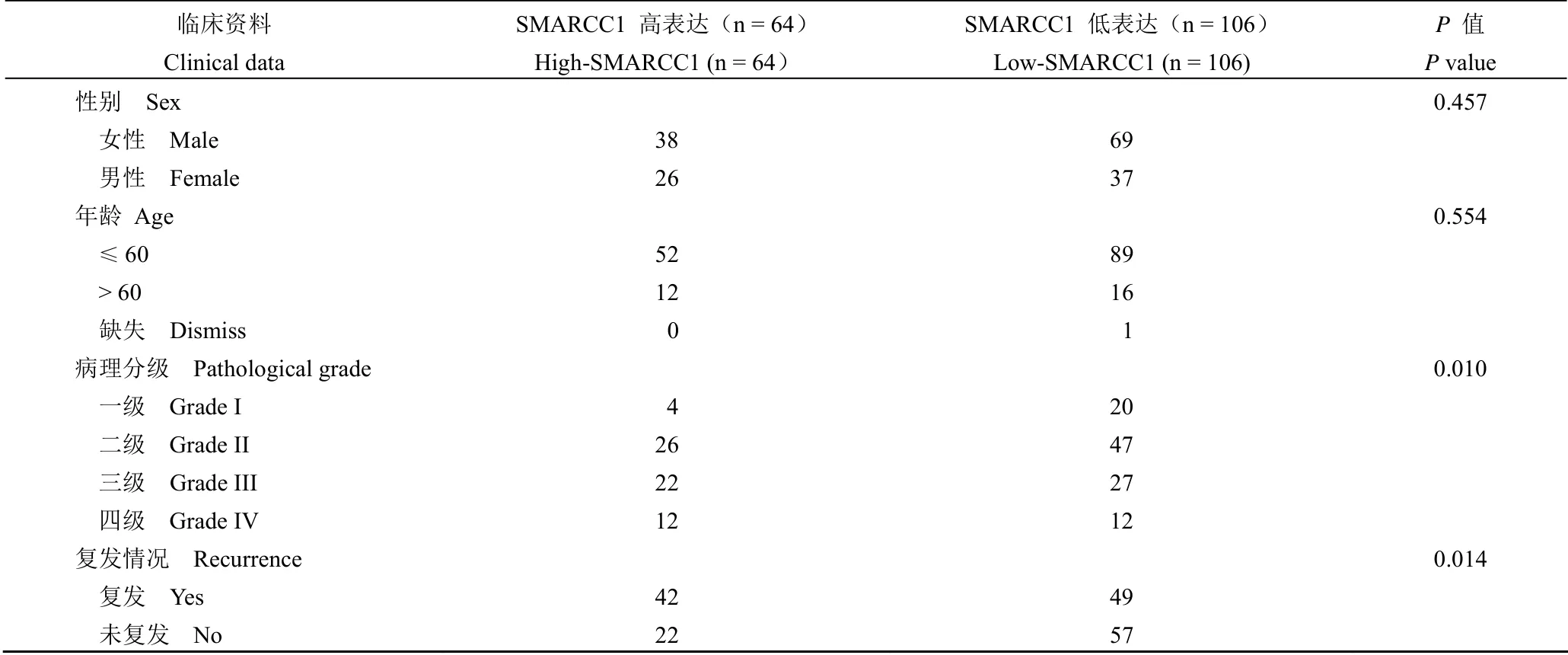
表1 SMARCC1 表达和脑胶质瘤样本的临床资料相关性分析Table 1 Correlation analysis between SMARCC1 expression and clinical data of glioma samples
1.1.2 实验试剂 一抗 SMARCC1(AB22355)购自英国 Abcam 公司;HRP 标记的二抗(DM827)和二氨基联苯胺(DAB)购自 Dako 公司;脑胶质瘤细胞株 U251MG 和 U87MG 购自中国科学院上海生命科学研究院;10% 胎牛血清(10099141C)和 DMEM 培养液(12430054)购自美国 Gibco 公司;转染试剂 Lipofectamine 2000(11668019)和逆转录酶 SuperScript IV Reverse Transcriptase(18090010)均购自美国 Thermo Fisher 公司;针对 SMARCC1 的小干扰 RNA(small interfering RNAs)siRNA-SMARCC1(简称 si-SMARCC1)和对照 siRNA-NC(简称 NC)(A10001)由基因制药公司合成;检测细胞增殖的 CCK8 试剂盒(A311-01)购自 Vazyme 公司;凋亡染色液 Hochest和 PI(C1052)采购于 Beyotime Biotechnology 公司;Trizol 试剂(T9424-200 ml)购自美国 Sigma公司;qPCR 反应试剂 SYBR®预混料 Ex-Taq™ II(Tli RNaseH Plus)(RR820Q)购自 Takara 公司;各基因的 qPCR 引物由上海生工合成。
1.1.3 实验仪器 CO2培养箱(HCP-80)购自海尔公司;酶标仪(ARM-100)购自 All For Life Science 公司;ACUMEN 扫描仪(ACUMEN eX3)购自 TTP-LabTech 公司;LightCycler480 荧光定量PCR 仪购自罗氏公司。
1.2 方法
1.2.1 免疫组织化学实验 组织芯片先经过脱蜡和抗原修复,再加入稀释好的一抗 SMARCC1(1:10 000)在 4 ℃ 下孵育过夜,然后使用 HRP标记的二抗孵育,用 PBST 缓冲液冲洗,用二氨基联苯胺(DAB)显色。结果判读:每个组织点的不同区域随机选择三个视野,每个视野判读 100 个细胞,记录这些细胞的平均染色强度和染色百分率。染色强度计分为:无染色(0 分)、弱染色(1 分)、中等染色(2 分)和强染色(3 分)。染色百分率计分为:0%(0 分)、1%~20%(1 分)、21%~40%(2 分)、41%~60%(3 分)、61%~80%(4 分)、81%~100%(5 分)。总评分=染色强度计分 × 染色百分率计分。得到的总评分的区间为0~15 分。将脑胶质瘤样本按照总评分分成两组:IHC 总评分 ≥ 12 分为 SMARCC1 高表达组,IHC 总评分 <12 分为 SMARCC1 低表达组。
1.2.2 细胞培养和细胞转染实验 经过细胞核型鉴定的脑胶质瘤细胞株 U251MG 和 U87MG 接种于含有 10% 胎牛血清的 DMEM 培养液中,在37 ℃ 的 5% CO2的培养箱中培养。将细胞培养至对数生长期,重新调节细胞密度至 200 000/ml;每孔加入 0.5 ml 细胞悬浮液,37 ℃ 培养;细胞贴壁后,去除原培养基;按照说明书加入转染试剂Lipofectamine 2000 和 siRNA 的混合物,37 ℃ 转染 6 h 后更换为包含 90% DMEM 培养基和 10%胎牛血清的完全培养基。转染时,2 个细胞株都分成对照组和实验组,分别转染 siRNA-NC(简称NC)和 siRNA-SMARCC1(简称 si-SMARCC1)。
1.2.3 细胞增殖实验 将转染 24 h 的细胞接种在 96 孔板中,每孔 100 μl 细胞悬浮液;继续培养 24 h 后,每孔加入 10 μl CCK8 在 37 ℃ 孵育2 h,使用酶标仪在 450 nm 测定吸光度。按照下面公式计算细胞增殖率:细胞增殖率=(实验组OD值–空白组OD值)/(对照组OD值–空白组OD值)× 100%。
1.2.4 细胞凋亡实验 将转染 24 h 的细胞接种在 96 孔板中,每孔 100 μl 细胞悬浮液;继续培养 24 h 后加入 100 μl 的染色液 Hochest/PI,37 ℃避光染色 20 min。用 ACUMEN 仪器扫描细胞染色结果并输出实验数据。
1.2.5 RNA 抽提和荧光定量 PCR 实验 脑胶质瘤细胞在转染 siRNA 48 h 后被消化和收集。使用 Trizol 试剂提取总 RNA,使用 SuperScript®IV逆转录酶合成 cDNA。采用荧光定量 PCR(qPCR)实验检测各组细胞的 SMARCC1、ki67 和 Bcl2 的mRNA 表达,Actin 作为参考基因。每个样品的反应总体积为 50 μl,其中包括 2 μl 0.4 μmol/L 引物混合物、25 μl SYBR 绿色母料混合物、4 μl DNA 模板和 16 μl 无 RNase/Dnase 无菌水。qPCR 程序设置:初始变性在 95 ℃ 下进行 30 s;在 95 ℃ 下进行 5 s,60 ℃ 下进行 30 s,40 个循环,在 60 ℃延伸阶段收集荧光数据;在 95 ℃ 下进行 5 s,60 ℃ 下进行 1 min,95 ℃ 结束,在 60~90 ℃ 阶段收集荧光数据。各基因的 qPCR 引物序列见表 2。
1.3 统计学处理
排除在实验中脱落的组织病例,实际获得170 例病人的免疫组织化学实验数据。将数据纳入SPSS 22.0 软件进行统计学分析,P<0.05 为有统计学意义。采用 Spearman 相关分析法计算SMARCC1 蛋白表达与临床指标的相关性。生存期单因素分析采用 Kaplan-Meier 法和 log-rank 检验,将单因素分析中具有统计学意义的变量纳入COX 多元回归生存分析。细胞增殖实验、细胞凋亡实验和 qPCR 实验数据等均采用 GraphPad 软件进行统计学分析,P<0.05 为有统计学意义。
2 结果
2.1 SMARCC1 蛋白表达与脑胶质瘤的病理分级、复发及预后等临床指标相关性
免疫组化实验结果显示,SMARCC1 主要定位在脑胶质瘤组织的细胞核,且所有组织样本均显示了细胞核的阳性表达(图 1)。相关染色计算成总评分后纳入 SPSS 22.0 软件进行统计学分析,P<0.05 为有统计学意义。
Spearman's rho 分析显示,SMARCC1 核染色分组分别和脑胶质瘤患者的病理分级、复发等临床指标显著正相关(r=0.197,P=0.010)(r=0.188,P=0.014),而和性别、年龄等临床指标没有相关性(P>0.05)(表 1)。生存期单因素分析显示,SMARCC1 高表达的脑胶质瘤病人拥有显著更短的总生存期(OS)(54.7% 比 74.3%,P=0.012)和无病生存期(DFS)(34.4% 比 54.3%,P=0.010)(图 2)。生存期多因素分析显示,SMARCC1 核染色分组并不是预后的独立预测因素(P>0.05),而年龄、病理分级等分别是脑胶质瘤病人的总生存期和无病生存期的独立预测因素(P<0.01)(表 3,表 4)。

图2 采用 Kaplan-Meier 法和 log-rank 法分析 SMARCC1 表达和脑胶质瘤病人的总生存期(OS)及无病生存期(DFS)的相关性Figure 2 Kaplan-Meier method and log-rank were used to analyze the correlation between SMARCC1 expression and overall survival (OS) as well as disease-free survival (DFS) of glioma patients
2.2 降低 SMARCC1 表达与脑胶质瘤细胞的增殖、凋亡的相关性
转染 48 h 后,我们使用 qPCR 技术检测SMARCC1 在细胞株的表达变化。检测结果显示,和对照组相比较,SMARCC1 的基因表达水平在转染 si-SMARCC1 的两株细胞 U251MG 和 U87MG中分别下调了 68.1% 和 69.2%(P<0.001,P<0.001)(图 3A)。

图3 qPCR 实验结果显示,转染 si-SMARCC1 显著降低了 SMARCC1(A)、ki67(B)和 Bcl2(C)在脑胶质瘤细胞的表达(*P <0.05,**P <0.01,***P <0.001)Figure 3 The qPCR results indicated that the expression of SMARCC1 (A),ki67 (B) and Bcl2 (C) were all down-regulated significantly in glioma cells after si-SMARCC1 transfection (*P <0.05,**P <0.01,***P <0.001)
随后的细胞学实验结果表明:与对照组细胞相比较,si-SMARCC1 转染 48 h 后的脑胶质瘤细胞株 U251MG 和 U87MG 的细胞增殖比率分别降低 14.4% 和 18.5%(P<0.01,P<0.001),而细胞凋亡比率分别提高了 42.6% 和 20.8%(P<0.0001,P<0.01)(图 4)。

图4 细胞功能学实验表明,转染 si-SMARCC1 显著降低了脑胶质瘤细胞 U251MG(A)和 U87MG(B)的增殖比率而提高了凋亡比率(**P <0.01,***P <0.001,****P <0.0001)Figure 4 Results of cell functional test indicated that the proliferation of glioma cell lines U251MG (A) and U87MG (B) were decreased significantly while the apoptosis was increased after si-SMARCC1 transfection (**P <0.01,***P <0.001,****P <0.0001)
2.3 降低 SMARCC1 表达对 ki67、Bcl2 表达的影响
为了研究 SMARCC1 表达与细胞增殖和凋亡等信号通路的相关性,利用 qPCR 方法检测了SMARCC1 沉默 48 h 后的脑胶质瘤细胞中的增殖凋亡相关基因的表达变化。实验结果显示:和对照组相比,转染 si-SMARCC1 的脑胶质瘤细胞株不但抑制了 SMARCC1 的表达,同时也显著降低了促增殖基因 ki67 和抗凋亡基因 Bcl2 的基因表达水平。其中,在 U251MG 细胞中,ki67、Bcl2 的mRNA 的表达水平分别降低了 60% 和 30%(P<0.001,P<0.01);在 U87MG 细胞中,ki67、Bcl2的 mRNA 的表达水平分别降低了 41% 和 43%(P<0.01,P<0.05)(图 3B、3C)。
3 讨论
关于脑胶质瘤组织芯片的免疫组化实验显示,SMARCC1 蛋白主要定位在细胞核中。统计学分析显示,SMARCC1 核染色分组和脑胶质瘤的病理分级、复发等显著正相关,且 SMARCC1 高表达的病人拥有显著更差的总生存期和无病生存期,这提示了 SMARCC1 对于脑胶质瘤的促癌作用。
前期关于 SMARCC1 和各种癌症的相关性研究虽然较多,但是结论却不一致,甚至关于同一种癌症的研究结果也互相矛盾。例如,Andersen 等[9]通过免疫组化对约 1000 例 I~III 期大肠腺癌的分析表明,CBFB 和 SMARCC1 蛋白含量高的肿瘤患者的总生存率明显高于低水平患者,提示SMARCC1 对于结肠癌具有抑癌作用。而 Ke 等[10]对于大肠癌的细胞学实验却发现:SMARCC1 可促进大肠癌细胞的生长和转移,是抑癌基因miR-202-5p 的直接靶点,且可以逆转 miR-202-5p对大肠癌细胞生长和转移的抑制作用。值得一提的是,近几年关于 SMARCC1 和肝癌、乳腺癌的研究均提示了该基因的促癌属性。例如,Zhou 等[14]一次性研究了 15 个 SWI/SNF 亚基在肝癌样本的表达,发现包括 SMARCC1 在内的 14 个亚基在癌组织中显著高表达,11 个亚基与病人的总生存率显著相关。之后,他们确定了一个 4 基因的预后预测模型,包括 ACTL6A、ARID1A、SMARCC1和 SMARCD1,其过表达能有效预测更差的总生存期,提示 SMARCC1 对于肝癌预后的重要影响。
为了研究 SMARCC1 对脑胶质瘤细胞的生物学功能,我们培养了两个脑胶质瘤细胞株 U251MG和 U87MG,采用 siRNA 技术降低了 SMARCC1基因在细胞中的表达水平。随后的细胞学功能实验显示,与转染 siRNA-NC 的对照组相比较,SMARCC1 基因的表达下调显著抑制了脑胶质瘤细胞增殖而促进了细胞凋亡。同时,qPCR 实验也证实,肿瘤促增殖基因 ki67 和抗凋亡基因 Bcl2的 mRNA 表达水平也都出现了显著下降,这与细胞功能实验结果相一致。由此我们推测,SMARCC1可能通过调节肿瘤增殖和凋亡相关基因而促进了脑胶质瘤的恶化,使其更容易复发和死亡;而病理分级差的病人表达了相对较高的目标基因,也加速了疾病的进展过程。
关于肝癌的研究文献也证实了 SMARCC1 对于肿瘤细胞的促癌作用——SMARCC1 在肝癌细胞的表达下调能抑制细胞迁移和细胞增殖,并促进细胞凋亡,其机制可能与下调 MMP-2、MMP-9、Bcl2 表达而上调 caspase3 表达有关[15-16]。同样,下调 SMARCC1 表达也能降低乳腺癌细胞株MCF-7 的细胞增殖并提高了细胞凋亡比率,其机制可能与端粒酶活性被抑制有关[17]。这些文献进一步证实了我们对于 SMARCC1 的促癌机制的推测,并使我们更加有理由相信目标基因的促癌机制可能涉及到更多更广的基因通路,敲除或降低SMARCC1 在脑胶质瘤的表达可能对于病人的复发及预后有良好的影响。
总之,我们的实验研究发现 SMARCC1 的表达和脑胶质瘤病人的病理分级、复发及预后等临床指标显著相关,降低 SMARCC1 基因的表达水平能显著抑制肿瘤细胞增殖并促进细胞凋亡,同时显著减少了 ki67 和 Bcl2 等基因的表达水平。我们推测,SMARCC1 可能通过影响细胞增殖和凋亡相关信号通路来促进癌症进展,是脑胶质瘤预后的重要标记物。
志谢感谢实验室工作人员对于本研究实验过程的支持和协助;感谢综合管理部对于本研究所用试剂耗材的采购和管理;最后,感谢国家重点研发计划对本文的经费支持。

