瑞德西韦及其合成中间体结构和性质的计算分析
陈蒙仪,孙祥,黄罗仪,王朝杰
1.温州医科大学附属第一医院 药学部,浙江 温州 325015;2.温州医科大学 药学院,浙江 温州 325035
瑞德西韦是一种由美国Gilead生物技术公司所生产的核糖核苷类似物,主要干扰病毒RNA转录过程,具有广谱抗病毒活性[1]。早期临床研究报道了瑞德西韦首次用于治疗苏格兰女性护士埃博拉脑膜炎,并且完成了治疗埃博拉病毒感染的三期临床试验[2]。在前期细胞和动物实验中,瑞德西韦均显示出对严重急性呼吸综合征冠状病毒(severe acute respiratory syndrome coronavirus,SARSCoV)和中东呼吸综合征冠状病毒(middle east respiratory syndrome coronavirus,MERS-CoV)有较好的抗病毒活性。小鼠实验证明瑞德西韦预防和治疗性用药均可改善肺功能,降低肺病毒载量,减轻肺病理学损伤[3-4]。这也是在新型冠状病毒肺炎(corona virus disease 2019,COVID-19)暴发后选择瑞德西韦进行临床试验的原因之一。HOLSHUE 等[5]首次报道了一位美国COVID-19患者在使用瑞德西韦后临床症状迅速减轻的情况,此后关于瑞德西韦治疗COVID-19的研究大量开展。因此,瑞德西韦及其合成中间体的结构和性质是值得探索的,SIEGEL等[6]报道了该药的合成工作,涉及两代合成路线,见图1。

图1 瑞德西韦两代合成路线
从反应合成路线可知,瑞德西韦(6a)是由鸟嘌呤类似物和戊糖组成核苷,再通过磷酸修饰得到的。瑞德西韦是治疗COVID-19的潜在候选药物,然而,关于瑞德西韦的结构性质及其合成中间体的反应活性位点等方面的理论研究甚少。本研究将通过量子化学方法和药代动力学计算,对瑞德西韦及其合成中间体13种化合物的分子结构、反应活性位点、红外光谱等进行分析,并利用ACD/Percept平台预测这13种化合物的药代动力学参数并对其进行成药性评价。
1 计算方法
采用密度泛函理论方法X3LYP,在6-311+G(2d,p)基组水平上对瑞德西韦及其合成中间体的几何结构进行优化,然后进行红外光谱计算,得到无虚频的能量极小结构,得到波函数进行电子结构分析。有研究报道X3LYP杂化密度泛函方法的频率一致性较好[7],KOSTJUKOVA等[8]用密度泛函理论计算研究吖啶橙染料在水溶液中的振动吸收光谱,分析了使用各种泛函和基组的计算,结果表明X3LYP方法的理论值与实验值最吻合。密度泛函计算利用Gaussian 16[9]程序实现,GaussView 6.0用于结构可视化,通过Multiwfn3.6[10]程序,对分子表面静电势、原子电荷、前线分子轨道进行分析,预测活性反应位点,并基于概念密度泛函活性指数(化学势、化学硬度、亲电指数、亲核力差值指数以及亲电力差值指数)重点对化合物5和6a进行分析。
2 结果和讨论
2.1 几何结构分析 所有化合物均在X3LYP水平上用6-311+G(2d,p)进行了结构优化,相应的理论计算几何结构均为稳定结构。据报道[6],在瑞德西韦以及其合成中间体中,瑞德西韦(6a)和中间体(12b)均得到了单晶结构,因此将理论计算参数和晶体数据进行比较。6a和12b的优化几何构型和原子编号如图2所示,表1列出了它们的部分结构参数(键长和键角)和XRD单晶衍射得到的结构参数,对实验数据和计算数据进行线性回归,得到6a和12b的键长和键角计算值与实验值的线性拟合图。以化合物6a的键长拟合为例,得到计算值与实验值的函数关系为:y=1.00639x-0.00773,其中y是6a的键长计算值,x是实验值,R2=0.981,接近于1,表明实验值和计算值吻合得很好;此外,化合物6a的键角拟合函数关系为y=0.99373x+1.02514,R2=0.969;化合物12b的键长拟合函数关系为y=1.04285x-0.06025,R2=0.994,键角拟合函数关系为y=1.01187x-0.67776,R2=0.980,都接近于1,体现理论计算值与实验值吻合得很好,也说明选取的计算方法是可靠的。

表1 瑞德西韦(6a)和中间体(12b)的计算及实验的部分键长(Å)和键角(°)

图2 优化后的瑞德西韦(6a)和中间体(12b)的分子结构及原子编号
2.2 反应活性位点
2.2.1 分子表面静电势(electrostatic surface potential,ESP):ESP是通过识别亲核和亲电攻击的潜在位点来表征分子反应活性位点的一种方法。ESP常被用于研究分子间的相互作用、反应部位以及分子识别,可以解释分子化学反应活性与分子性质(局部电荷、偶极距、电负性等)之间的关系,ESP越负的位置对应的原子越容易发生亲电反应,越正的位置对应的原子越容易发生亲核反应[11]。优化13种分子结构后分析其表面静电势,ESP图上颜色深浅反映静电势的强弱,静电势为负的区域用蓝色表示,易受到亲电试剂的进攻;静电势为正的区域用红色表示,易受到亲核试剂的进攻。分子表面不同区域有若干极大值点和极小值点,其中,橙色小球对应静电势极大值点,青色小球对应静电势极小值点,见图3。我们发现静电势在全局的最大值点大都位于吡咯并三嗪环上的氨基氢或支链胺基氢附近(除化合物1),表明此区域亲核性较高,容易发生亲核反应。静电势在全局的最小值点大都位于羟基氧或苄氧基的氧原子附近,这是因为O的电负性比较强,周围电子云密度较大,具有亲电活性,易发生亲电反应。因此推断戊糖环上的苄氧基或羟基氧易受到亲电试剂的攻击,而鸟嘌呤类似物环上的氨基氢或支链胺基氢易受到亲核试剂的攻击。这与SIEGEL等[6]研究结果相一致。
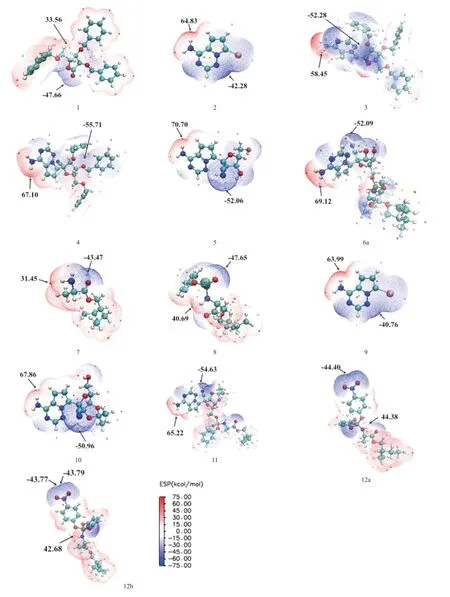
图3 13种化合物在X3LYP/6-311+G(2d,p)水平下的静电势等值面图
2.2.2 原子电荷:原子偶极矩校正的Hirshfeld电荷可表征分子内不同原子所带电荷大小,是探究分子亲核或亲电特性强弱及确定化学活性位点的一种有效方法,其中带负电荷越多的原子相应的亲电活性可能也越强[12]。计算得到瑞德西韦及其具相同母核五种中间体的Hirshfeld电荷,对于化合物3,其中羟基氧O5(-0.72 a.u.)带有最多的负电荷,戊糖环氧O4(-0.41 a.u.)次之,表明羟基氧O5具有较好的亲电活性,羟基氢H45(0.49 a.u.)和氨基氢H72(0.45 a.u.)、H73(0.47 a.u.)都具有较高正电荷,表明这几个位置亲核活性较高,易发生亲核反应。同理对于化合物4,带负电荷顺序是戊糖环氧O4(-0.44 a.u.)>三个苄氧基O5(-0.39 a.u.)、O6(-0.34 a.u.)、O8(-0.34 a.u.),氨基氢H72(0.46 a.u.)、H73(0.47 a.u.)具有较高正电荷;化合物5,负电荷是三个羟基氧O5(-0.70 a.u.)、O6(-0.74 a.u.)、O8(-0.71 a.u.)多于戊糖环氧O4(-0.50 a.u.),羟基氢H25(0.45 a.u.)、H26(0.48 a.u.)、H29(0.44 a.u.)和氨基氢H33(0.48 a.u.)、H34(0.49 a.u.)都具有较高正电荷;化合物6a,带负电荷顺序是羟基氧O35(-0.71 a.u.)、O36(-0.76 a.u.)>磷氧基O18(-0.69 a.u.)>羰基氧O25(-0.62 a.u.)>戊糖环氧O11(-0.44 a.u.)>苄氧基O19(-0.38 a.u.),羟基氢H71(0.47 a.u.)、H72(0.47 a.u.),氨基氢H69(0.48 a.u.)、H70(0.48 a.u.)和支链胺上氢H51(0.44 a.u.)都具有较高正电荷;化合物10与11有类似的分布情况。可以看出瑞德西韦及其中间体结构上羟基氧附近是具有最多的负电荷分布,最易发生亲电反应,氨基氢和羟基氢附近亲核活性较高,易发生亲核反应。这与分子表面静电势得到的结果相一致。有研究表明,N-羟乙酰神经氨酸分子的羟基氧原子具有多的负电荷,有较强的亲电活 性[13];高子飞等[14]的研究结果表明绿原酸分子中的羟基氢原子所带正电荷较大;贾壮等[15]用量子化学方法指导普萘洛尔类似物的合成研究中,通过原子电荷分布和静电势图确定反应位点,这些都与本研究的结论和依据相似。
2.2.3 前线轨道分析:根据前线分子轨道理论可知,前线分子轨道在分子反应过程中具有重要作 用[16]。前线轨道包括最高占据轨道(highest occupied molecular orbital,HOMO)和最低未占轨道(lowest unoccupied molecular orbital,LUMO),HOMO电子优先提供,而LUMO也先接受电子。HOMO和LUMO之间的能隙是分子化学稳定性的指标,也是决定分子电荷流动特性的重要参数,能隙(Δε(LUMO-HOMO))越小,表示分子中电子越容易发生跃迁,反应活性就越强,能隙越大,电子被激发的难度也越大,分子的稳定性也会较好。严茜茜等[17]研究表明通过HOMO与LUMO的能极差能反应化合物活性大小。前线轨道分布图上的蓝色区域代表轨道波函数负相位,绿色区域代表轨道波函数正相位。从前线轨道分布图可看出,只要含有吡咯并三嗪环结构的化合物,HOMO和LUMO轨道都集中分布在吡咯并三嗪环上,说明瑞德西韦及其具相同母核中间体的吡咯并三嗪环上的原子是主要的亲电或亲核反应位点,即鸟嘌呤类似物结构是瑞德西韦的母核结构,是发挥抑制作用的活性中心。这与金兴辉 等[18]用量子化学研究1,2,3-三氨基胍二硝基胍盐中,因大部分HOMO和LUMO分布在二硝基胍阴离子上,说明二硝基胍阴离子是该化合物的反应活性位点的依据相似。所有化合物的HOMO和LUMO轨道能量均为负值,说明这些化合物的电子结构比较稳定,且化合物5的Δε(LUMO-HOMO)相对比6a的小,说明化合物5具有较高的活性。
2.3 红外吸收光谱 红外光谱是分子中基团由于发生伸缩振动、变形振动等产生的,其可用于定性分析分子结构。13种化合物在800~1 800 cm-1处都有不同强度的吸收,见图5。在1 100 cm-1附近有CO-C的伸缩振动峰,归属于化合物的苄氧基和戊糖环结构;在1 500 cm-1附近都有强吸收峰,归属于吡咯并三嗪环及苯环的C=N和C=C的伸缩振动;在1 600 cm-1附近有N-H弯曲振动引起的较强吸收峰,对应吡咯并三嗪环的氨基。其他特征吸收峰如在1 200 cm-1附近的峰,归属于6a、8、11、12a、12b的P=O伸缩振动;在1 750 cm-1附近有C=O伸缩振动引起的强吸收峰,对应1、6a、7、8、11、12a、12b的酯基C=O结构;化合物4、5、6a、10、11都在2 300 cm-1附近有吸收峰,是由氰基C≡N的伸缩振动引起的;在3 500 cm-1和3 800 cm-1附近的O-H吸收峰,归属于化合物3、5、6a、10中羟基的O-H伸缩振动。对比化合物1、3、4、5的谱图,可以看出三个苄氧基的C-O-C的吸收峰,变成三个羟基O-H的吸收峰;对比化合物5、10、11的谱图,可以看出从化合物5有3处O-H吸收峰,到化合物10只有1处O-H吸收峰,到化合物11无O-H吸收峰。根据对计算所得的谱图信息进行分析归属,与理论的频率范围基本吻合。并且我们也可以看出化合物的羟基氧、苄氧基、羟基氢、胺基氢均是活性反应位点,与前面分子静电势和原子电荷得到的结论一致。文献[6]中没有提供各合成中间体或产物的红外光谱数据。

图5 13种化合物在X3LYP/6-311+G(2d,p)水平下的红外谱图
2.4 综合比较中间体(5)和瑞德西韦(6a)的药理活性作用 YAN等[19]研究表示母体核苷5是瑞德西韦到达肺部的主要代谢物,由于其合成的简单性和在兽医环境中的体内功效,认为5在COVID-19治疗中优于瑞德西韦(6a)。我们通过密度泛函理论方法,分析中间体(5)和瑞德西韦(6a)的药理活性与分子结构之间的关系,为后续药效关系的深入研究提供理论基础。
从表2中可知,化合物5的O4、O5、O6、O8、C11、C13、N14等原子具有较大的负电荷,说明这些原子易与受体蛋白的正电荷区域结合而发挥作用,对比瑞德西韦(6a)中相应结构的原子电荷,发现化合物5原子上所带的电荷稍多,更易与受体蛋白的正电荷区域作用。因此,从电荷分析可以预测,化合物5与受体蛋白的作用强于瑞德西韦(6a),即化合物5可能具有较强的药理活性。

表2 化合物5和6a的部分原子电荷
根据上述图4 的前线轨道分布图,化合物5和6a的HOMO和LUMO轨道基本相近,均集中分布在吡咯并三嗪环上。由它们的能级差可知,化合物5的 Δε(LUMO-HOMO)略小于6a,表明其稳定性较弱,活性较6a强。SIEGEL等[6]研究的瑞德西韦的合成方法中说到,经过对化合物5及其结构相似的化合物进行细胞实验,发现化合物5比其他化合物对病毒活性作用较强,说明化合物5的活性和选择性在筛选的化合物中都呈现一定优势。

图4 化合物5和6a在X3LYP/6-311+G(2d,p)水平下的HOMO和LUMO轨道分布图及能差
概念密度泛函活性指数(如化学势μ、化学硬度η、亲电指数ω、亲核力差值指数Δεn、亲电力差值指数Δεe等)常被应用于化合物活性研究。化学势μ越小,化学硬度η越大,分子越稳定,反之分子越不稳定,活性越大。亲电指数ω表示分子对亲电试剂的结合程度,而亲核力差值指数Δεn和亲电力差值指数Δεe则表示分子的亲核和亲电活性大小[20-21]。根据化合物5 和6a的概念密度泛函活性指数,化合物6a的化学势μ(-4.019 eV)比5 的化学势μ(-4.012 eV)低,6a的化学硬度η(4.624 eV)比5的化学硬度η(4.621 eV)大,即6a的稳定性比5好,则化合物5的活性较大;化合物6a的亲电指数ω(1.746 eV)比5的亲电指数ω(1.742 eV)大,即6a对亲电试剂结合程度比5大;化合物5的亲核力差值指数Δεn(0.040 eV)比6a的亲核力差值指数Δεn(0.040 eV)大,亲电力差值指数Δεe(8.065 eV)比6a的亲电力差值指数Δεe(8.077 eV)小,即化合物5亲核的活泼性能较大,亲电的活泼性能比6a小。
综上所述,化合物5的活性比瑞德西韦(6a)强,我们推测化合物5 的治疗作用可能优于瑞德西韦(6a),需待进一步开展更多的体外和动物实验去验证。
2.5 药代动力学分析 ACD/Percepta是基于QSAR模型精确计算化合物的吸收(absorption,A)、分布(distribution,D)、代谢(metabolism,M)、排泄(excretion,E)、毒性(toxicity,Tox)以及理化(PhysChem)等方面性质的新一代预测化合物药代动力学参数的软件。ADME/Tox特性在药物发现领域中发挥着重要作用,计算ADME/Tox特性评估的目的是正确预测候选药物的体内药代动力学特性。有研究表明,60%的药物因不良ADME/Tox性质而退出临床试验[22]。因此在新药研发早期开展候选药物的成药性研究有利于缩短药物的研发周期,降低研发成本,同时提高新药开发的成功率。在这项研究中,主要关注的是评价理化性质,如氢键供体数(hydrogen bond donor,HBD)、氢键受体数(hydrogen bond acceptor,HBA)、拓扑极性表面积(topological polar surface area,TPSA)、亲脂性(lipophilicity,LogP)、水溶性(water solubility,LogS)、药代动力学,如胃肠吸收、BBB通透剂、P-gp底物和药物相似性。除此之外,还考虑了一些重要的毒性参数,如急性口服毒性、致癌性、基因毒性[23]。
药物通过细胞膜的渗透性直接受到药物分子量和拓扑极性表面积(topological polar surface area,TPSA)的影响。分子量较高、TPSA较高的药物不利于吸收。LogP代表亲脂性,是指药物在有机相和水相中分配系数的对数,此性质影响药物的吸收,LogP值较高,药物越易吸收。LogS与溶解度相关,可接受的溶解度范围为不溶<-10<难溶<-8<微溶<-6<可溶<-2<易溶<0。HBD和HBA影响药物穿过细胞膜的能力。可旋转键的数量代表口服生物利用度,应该保持在10以下[24-25]。
Lipinski类药五规则(rule-of-five,Ro5)是广泛用于评估化合物类药性是否良好的经验规则,类药性的筛选有利于获得药动学药效学性质平衡的候选药物[24]。符合Lipinski规则的化合物可能有更好的药代动力学性质,在生物体内代谢过程中有更高的生物利用度,因而也更有可能成为口服药物。13种化合物的理化性质预测结果见表3。化合物2、5、7、8、9、10、12a、12b均符合Lipinski五规则,类药性较好。
13 种化合物的药代动力学参数见表4。其中Caco-2细胞源于人体结肠癌细胞,结构和功能与肠上皮近似,细胞内有药物代谢酶。Caco-2细胞模型是一种研究药物转运机制和预测药物肠吸收的体外筛选工具[26],从药物吸收的预测结果来看,除化合物5,其余吸收性均较好。血浆蛋白结合率(plasma protein binding,PPB)即当药物进入人体后与血浆内白蛋白结合的比例。药物在血浆中常以结合型和游离型两种形式存在,只有游离型药物才具有药物活性,所以PPB对药物的治疗效果有着重要影 响[27]。从药物分布的预测结果来看,化合物1、3、4与药物血浆蛋白结合能力较强;化合物2、9、12a、12b与药物血浆蛋白结合能力中等。药物代谢又称为药物的生物转化,是机体对外源物质的处理方式。肝脏作为人体最重要的代谢器官,主要以细胞色素P450(CYP450酶)介导参与口服药物的首过效应,其中CYP1A2、CYP2C9、CYP2C19、CYP2D6和CYP3A4参与了90%外源物的代谢活动[28]。表4中结果表明13种化合物对五种CYP450亚型的抑制作用都较低或没有抑制作用,因此对体内代谢产生的影响较小。糖蛋白(P-gp)是一种外排转运蛋白,细胞膜中的P-gp使药物能够在细胞内移动,对P-gp的抑制可能会干扰药物的转运[29]。从表中看出,没有化合物是磷-糖蛋白底物的抑制剂。污染物致突变性检测(Ames试验)与癌症有关,阳性的Ames试验表明有可能导致突变,表中数据表明,13种化合物的毒性均不明确。
综合表3和表4的参数,表明化合物2、9、12a、12b的药代动力学评价较佳,然而前面重点讨论的化合物5和6a的理化性质和药代动力学的参数都不理想,我们推测瑞德西韦(6a)可能对COVID-19疗效甚微或基本无效。SHRESTHA等[30]通过随机对照试验得出瑞德西韦10 d疗程的不良反应多于5 d疗程,且无显著疗效;世界卫生组织“团结实验”初步结果显示,瑞德西韦对降低重症患者病死率或者减少住院时间影响很小或没有影响[31]。虽然早期临床前数据表明瑞德西韦可能对COVID-19具有潜在的活性,但对COVID-19到底有没有疗效还需要等待进一步的研究结果。
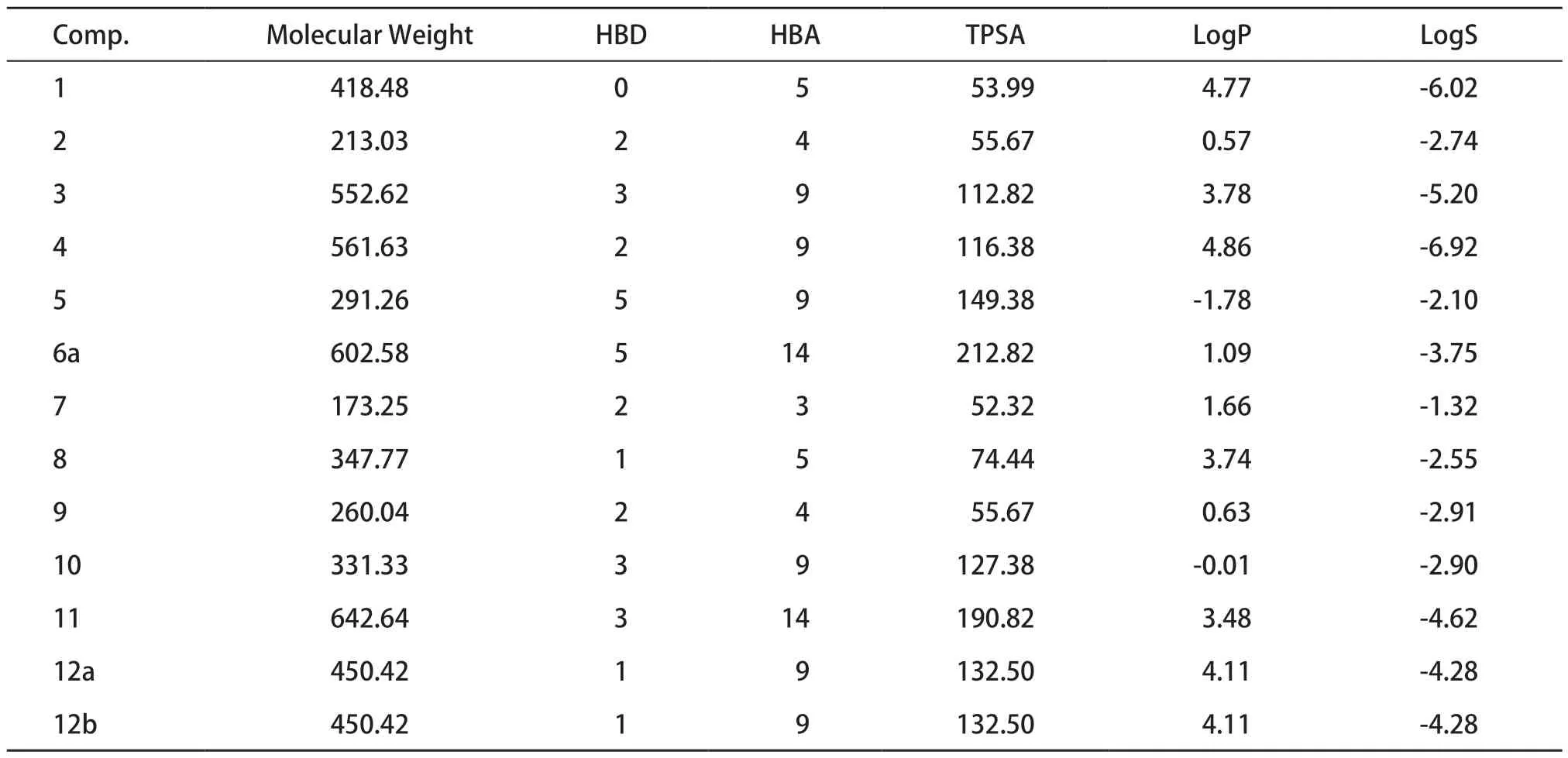
表3 瑞德西韦及其中间体13种化合物的理化性质
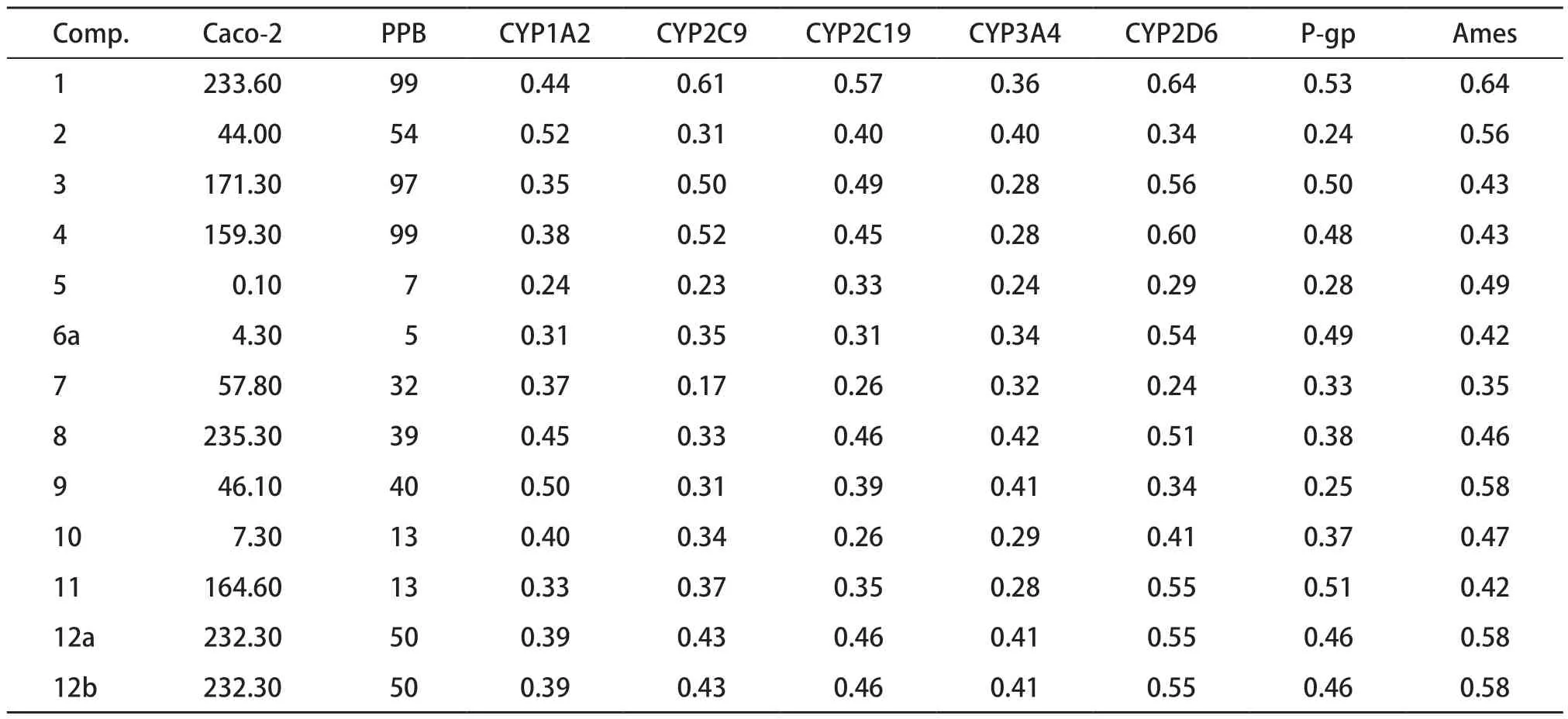
表4 瑞德西韦及其中间体13种化合物的药代动力学参数
3 结论
本研究利用密度泛函理论对瑞德西韦及其合成中间体的分子结构、反应活性位点、红外光谱以及概念密度泛函活性指数进行分析,并利用ACD/Percepta分析模型预测化合物的ADME/Tox。几何结构分析表明计算方法是可靠的。分子表面静电势、原子电荷、前线轨道理论结果表明,戊糖环上的苄氧基或羟基氧易受到亲电试剂的攻击,鸟嘌呤类似物环上的氨基氢或支链胺基氢易受到亲核试剂的攻击,且鸟嘌呤类似物结构是瑞德西韦的母核结构,瑞德西韦及其具相同母核结构的化合物中,化合物5的活性较强。通过综合对比化合物5和瑞德西韦(6a)的药理活性,也表明了化合物5的活性优于瑞德西韦(6a)。最后通过ACD/Percepta分析预测13种化合物的理化性质和药代动力学评价,推测瑞德西韦可能对COVID-19疗效甚微或基本无效,以待进一步的大规模临床试验去评估其疗效和安全性。本研究结果为揭示瑞德西韦及其合成中间体结构与性质的关系提供了理论基础,也对深入探索瑞德西韦及其合成中间体生理活性,拓宽其在药物研发中的应用提供了参考依据。

