水分子在高岭石(001)面吸附的密度泛函计算
陈浙锐,邱鸿鑫,王光辉
(中国矿业大学化工学院,徐州 221116)
0 引 言
在水体系中,黏土矿物易吸附水分子发生水化作用[1-2]。由于黏土矿物多为层状晶体结构[3],分散性良好,在水中容易解离成微细颗粒,使得比表面积明显增大,具有很强的吸附能力[4-6]。
高岭石是Si-O层和Al-O层相互叠加形成,属于典型的1∶1层状硅铝酸盐[7-8],可以通过离子交换吸附水体中的重金属离子[9-11],在水处理中有着广泛的应用。多数阳离子在水溶液中以水合阳离子的形式存在,水分子在高岭石表面的水化作用有利于离子交换的进行。同时水分子可以作为客体分子进入高岭石层间,通过插层作用为高岭石吸附水体中的污染物提供载体[12-13]。当水分子进入高岭石层状结构时,会对高岭石增加层间距,影响吸附过程[14]。因此,研究高岭石-水体系的相互作用有着重要的意义。
分子模拟为研究吸附机理提供了新的方法。Liu等[15]用第一性原理分析了2∶1型黏土矿物离子交换情况,结果表明硅氧四面体内易发生Al3+取代,而铝氧四面体内容易发生Mg2+取代。Zhang等[16]研究了Ni+在黏土矿物端面和空穴内的吸附情况,结果表明空穴对Ni+吸附影响最大。杜佳等[17]利用密度泛函理论计算了H3O+在伊利石表明的吸附情况,结果表明H3O+能够增加界面水分子活性,使得金属阳离子更加容易发生配位作用。Wang等[18]用GGA-PBE泛函分析了Pb(OH)+在高岭石(001)面的吸附行为。
目前,国内外的研究大多集中在吸附前后黏土矿物构型的变化和吸附能计算上,对这种相互作用内在机理和直观展示的研究较少。以高岭石的(001)面为研究对象,通过静电势分析研究高岭石对水分子的吸附机理,并利用Multiwfn和VMD分析[19-20]高岭石和水分子相互作用区域,结合AIM拓扑分析确定两者的作用类型,以此来解释高岭石和水分子的相互作用机理。
1 计算方法
计算使用Material studio 8.0的CASTEP模块,用平面波赝势方法计算。广义梯度近似(GGA)在描述氢键、范德华力等弱相互作用有着良好的效果,因此使用GGA-PBE优化高岭石模型和(001)面。平面波截断能设为400 eV[21]。用BFGS算法对模型进行优化,SCF收敛标准为2×10-6eV/atom[22],原子间作用力为0.05 eV/A,体系总能量变化为2×10-5eV/atom[23]。
高岭石化学式为Al4Si4O10(OH)8,由SiO4四面体和AlO2(OH)4八面体连接而成,层间以氢键连接[24-25]。高岭石解离面为(001)面[26-27],因此选取(001)面计算。优化后晶胞参数为a=1.0449 nm、b=1.8122 nm、c=3.5848 nm;α=91.369°、β=87.719°、γ=89.794°。为减少周期性结构的影响,在表面添加3 nm的真空层。
高岭石的(001)面为Al-OH面,具有较强的活性,对高岭石的变面性质有着重要影响。从图1可以看出,高岭石的-OH包括平行(001)面的羟基(约占三分之一)和垂直于(001)面的羟基(约占三分之二)。

图1 高岭石(001)面
Fig.1 Kaolinite (001) surface
图2 含有不同水分子数量的水分子团
Fig.2 Water clusters containing different amounts of water molecules
图2为含有不同水分子数量的分子团聚结构。分别计算高岭石(001)面与分别含有1、2、4个水分子的分子团的结合能。体系平均结合能按式(1)计算。
ΔE=(Etotal-Ek-nEH)/n
(1)
其中,Etotal为稳定体系的总能量,Ek为高岭石能量,EH为H2O的能量,n为水分子数。
用Multiwfn和VMD分析高岭石(001)面静电势分布情况,判断吸附稳定构型的相互作用类型。结合AIM理论,计算出电子密度ρ和电子密度拉普拉斯量▽2ρ来定量高岭石与水分子之间的作用强度。
2 结果分析
2.1 高岭石表面静电势分析
分子表面静电势(ESP)是引起静电作用的主要原因,通过计算静电势分布可以有效预测分子间的相互作用和高岭石-水分子体系的结构。高岭石表面静电势分布如图3所示。

图3 高岭石表面静电势分析Fig.3 Analysis of surface electrostatic potential of kaolinite
用Multiwfn计算得到高岭石表面正静电势区域面积占比为47.77%,负静电势面积占比为52.23%,负静电势区域略大于正静电势区域。氧原子存在孤电子对,又有极强的负电性,因此周围具有较高的负电势(<-95.73 kJ/mol),与之相连的氢原子和铝原子则出现较高的正电势(>+57.38 kJ/mol)。表1为高岭石静电势绝对值最大点坐标。
高岭石表面静电势数值均较大,容易与水分子等极性分子产生静电吸引。高岭石正负静电势的最大值点都出现Al-OH表面(分别为+477.58 kJ/mol和-624.95 kJ/mol),表明与其他原子层相比,Al-OH表面具有更容易与水分子产生静电吸附作用。

表1 高岭石静电势绝对值最大值点位置Table 1 Extreme points of ESP of kaolinite
2.2 稳定构型和平均结合能
图4为高岭石(001)面分别吸附1、2、4个水分子后的稳定构型。虚线表示氢键,数字为氢键序号。
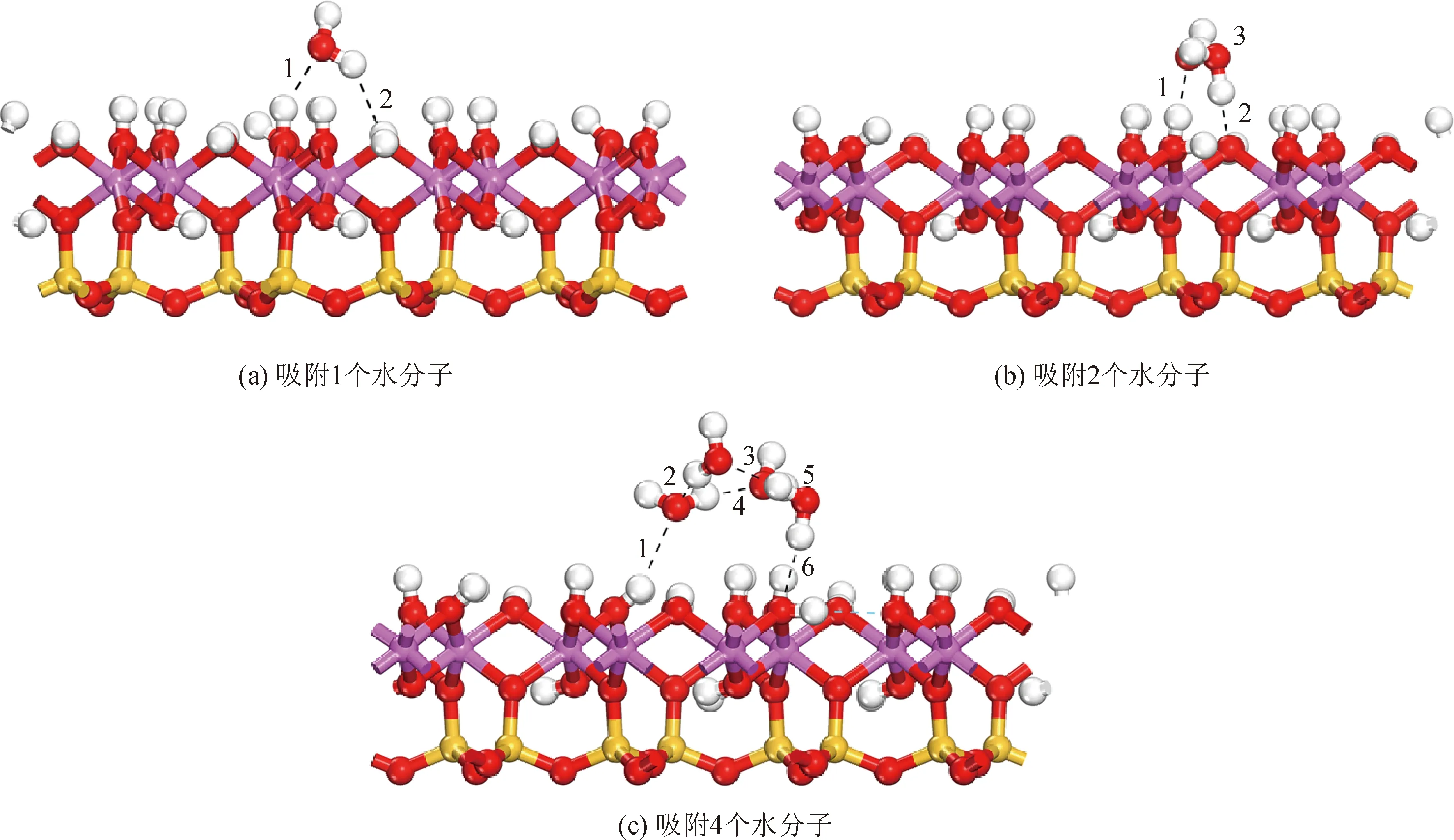
图4 高岭石(001)面吸附后水分子的稳定构型
Fig.4 Stable configurations of water molecules adsorbed on kaolinite (001) surface
随着水分子的增加,逐渐形成水分子的二聚体、四聚体,并通过氢键与高岭石Al-OH层连接,形成环状结构。吸附稳定后,Al-OH面会与水分子形成氢键。水分子二聚体-高岭石的稳定结构可以共有3条氢键(其中2个水分子之间有1条氢键),且水分子中的氧原子所在平面与Al-O层基本平行。水分子四聚体-高岭石的稳定结构有6条氢键(其中4个水分子之间有4条氢键),形成类似水分子层的结构水分子。
吸附稳定后的氢键键长及结合能如表2所示。
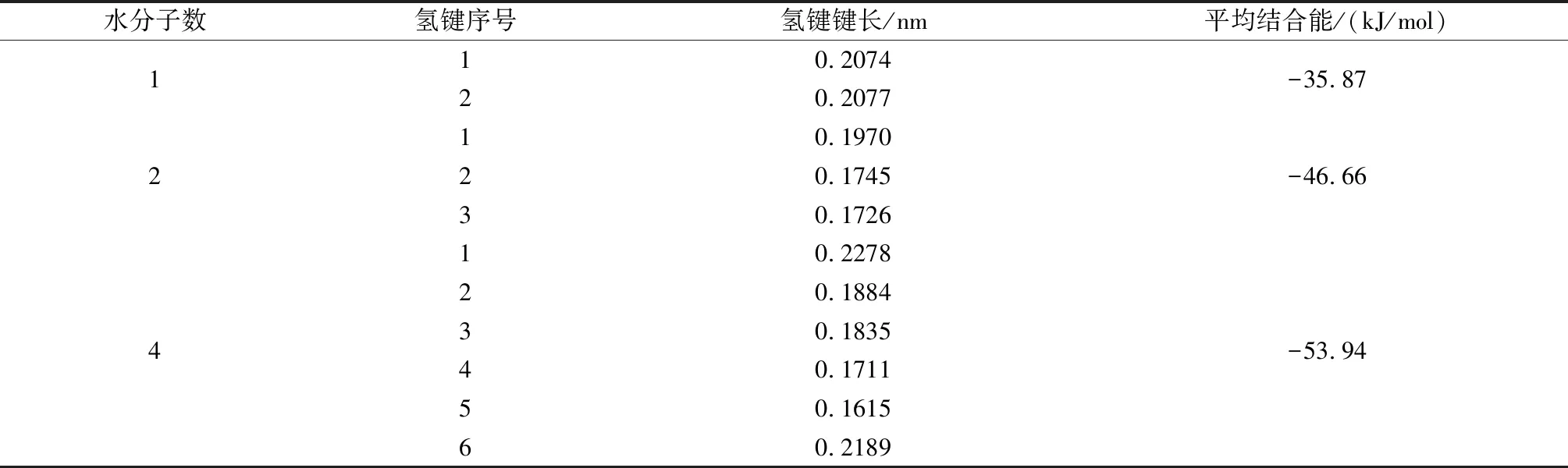
表2 稳定结构的氢键键长和平均结合能Table 2 Hydrogen bond length and average binding energy of stable configurations
从结合能来看,高岭石对水分子的吸附为物理吸附。水分子和Al-OH面形成的平均氢键键长大于水分子间的氢键键长,说明水分子之间的氢键键能更大。随着水分子数量的增加,体系的平均结合能的绝对值逐步从35.87 kJ/mol增加到53.94 kJ/mol,总氢键作用能增加,说明水分子的增加有利于高岭石-水复合体系的稳定。
2.3 稳定构型的静电势
图5和图6分别为高岭石-水稳定体系的表面静电势图和静电势分布区域图。根据静电势的分布图和最大值点来看,水分子的加入使得静电势的绝对值略有提高,但对绝对值最大点的位置影响不大。从表3可以看出随着水分子数的增加,正静电势区域占比从47.79%增加到了49.32%。静电势绝对值较大(>188.18 kJ/mol)的面积由7.99%增加到8.49%。
水分子拥有较强的极性,当水分子吸附在高岭石(001)面时,为体系加入了自由态的O-H基团,提高了体系整体的静电势水平。高岭石与水分子的作用以静电吸引为主,因此复合体系表面的吸附活性位点增加,有利于后续吸附更多水分子。

图5 高岭石-水稳定结构静电势
Fig.5 Electrostatic potential of kaolinite-water stabilized structures
表3 高岭石-水稳定结构静电势最大值点
Table 3 Extreme potential points of electrostatic potential of kaolinite-water stabilized structures
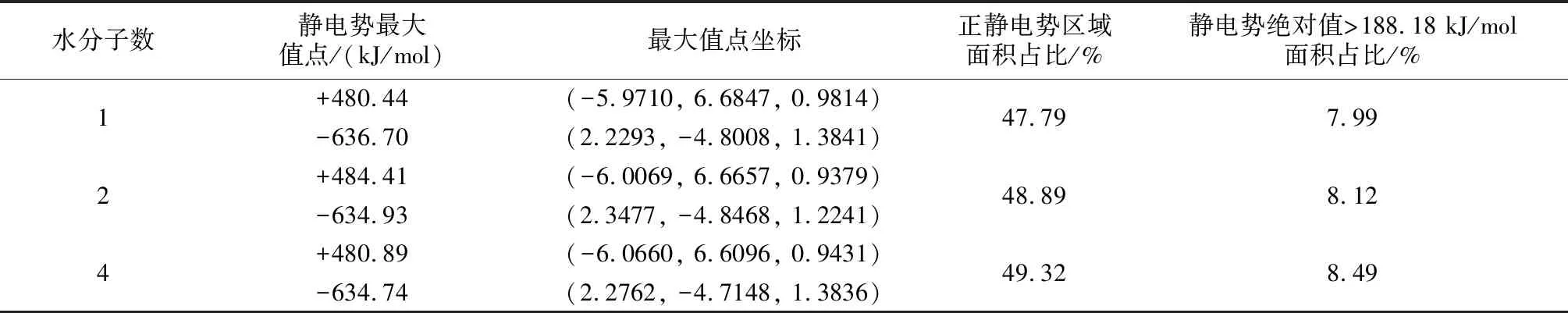
水分子数静电势最大值点/(kJ/mol)最大值点坐标正静电势区域面积占比/%静电势绝对值>188.18 kJ/mol面积占比/%1+480.44 -636.70 (-5.9710, 6.6847, 0.9814)(2.2293, -4.8008, 1.3841)47.797.992+484.41-634.93(-6.0069, 6.6657, 0.9379)(2.3477, -4.8468, 1.2241)48.898.124+480.89-634.74(-6.0660, 6.6096, 0.9431)(2.2762, -4.7148, 1.3836)49.328.49
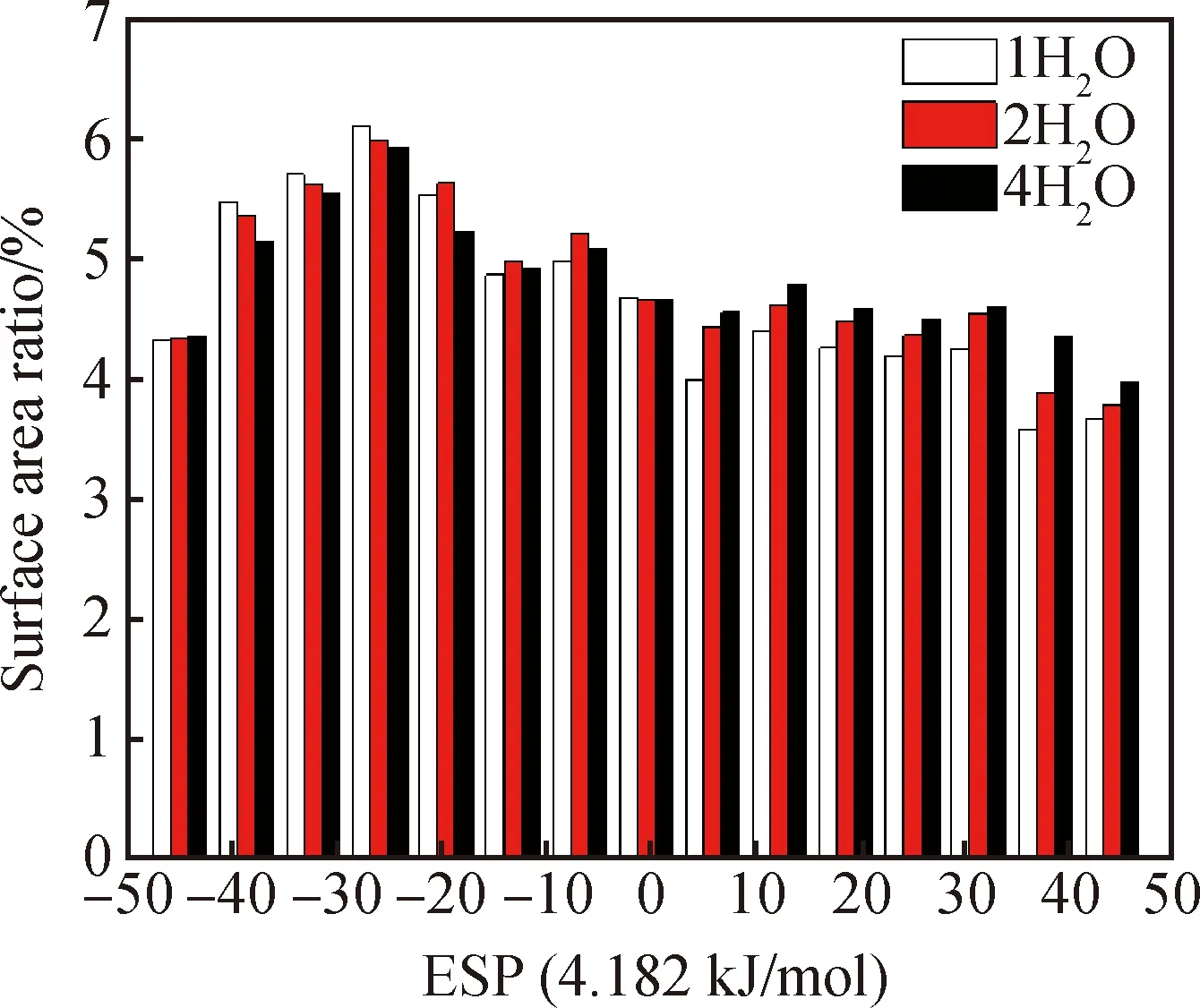
图6 高岭石-水稳定结构静电势分布区域Fig.6 Electrostatic potential distribution of kaolinite-water stabilized structures
2.4 弱相互作用分析
约化密度梯度函数(Reduced density gradient,RDG)通过定义一个实空间函数,用数值区分体系不同特征区域,可以用于研究氢键、范德华作用、位阻效应等弱相互作用[28-29]。RDG填色图和散点图如图7所示。
若体系内存在弱相互作用,RDG散点图靠近sign(λ2)ρ=0附近,就会存在一些几乎垂直于横轴的“spike”[28],对应的横轴的点绝对值越大,弱相互作用越强。
通过RDG分析,水分子和高岭石的Al-OH面存在强吸引区域(区域A),表明高岭石和水分子以氢键连接。另外,高岭石内部还存在强互斥作用(区域B),主要分布在Si-O-Si-O四元环内的两个硅原子之间。
AIM理论用电子密度ρ和电子密度的拉普拉斯量▽2ρ来衡量原子间的成键和弱相互作用[30]。根据AIM理论,存在键临界点(3,-1),可以认为两原子间有较强的作用(主要表现为化学键和氢键)。(3,-1)中的3表示Hessian矩阵的秩,而-1表示本征值的符号函数之和。氢键临界点的特征值如表4所示。

表4 氢键临界点的特征值Table 4 Eigenvalues of hydrogen bond critical points
氢键临界点的电子密度ρ为0.002~0.035,电子密度的拉普拉斯量▽2ρ为0.024~0.139[31]。▽2ρ值一般与氢键强度为正相关,当▽2ρ>0.1时,可以认为形成了强氢键。根据表4的数据,水分子之间的氢键的▽2ρ值为0.09477~0.15308,属于强氢键;而水分子和高岭石之间的氢键为中等强度的氢键。
单个水分子与高岭石(001)面形成的氢键▽2ρ值分别为0.08477和0.06131,当水分子数为4个时,▽2ρ值减小到0.03425和0.05376。这是由于随着水分子数量的增加,水分子之间的相互作用增强,使得水分子和高岭石之间的氢键键长增加,造成氢键键能降低,▽2ρ值减小。
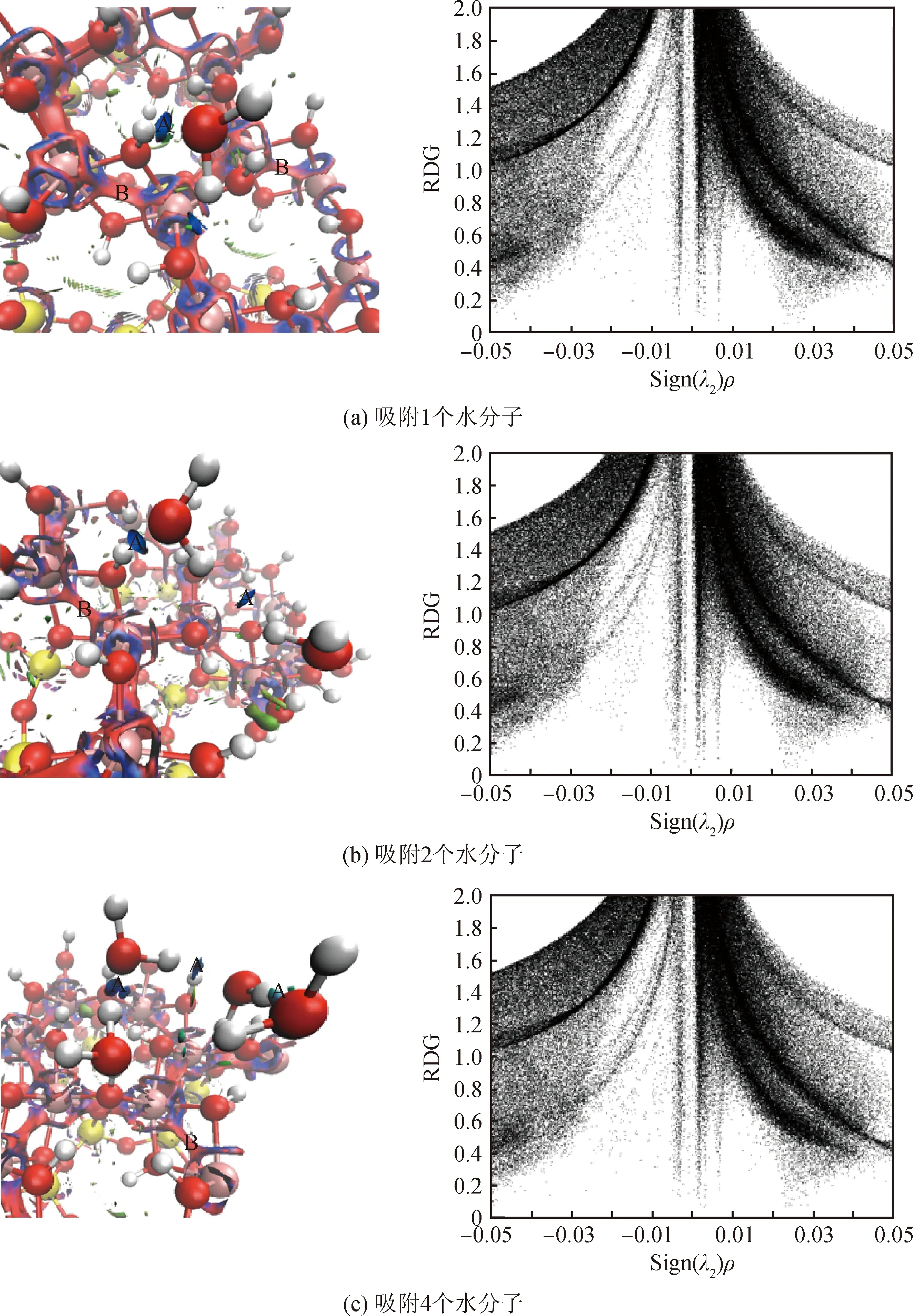
图7 RDG填色图和散点图
Fig.7 RDG colouring map fill-in and scatter plot
随着水分子数量的增加,水分子之间的氢键键能逐渐变为体系总氢键键能的主体,因此可以认为水中高岭石表面的水化膜结构主要是水分子之间的氢键起主导作用。
3 结 论
(1)水分子和高岭石(001)面之间主要为氢键作用,同时各水分子之间也以氢键连接。高岭石-水复合体系的稳定性随着水分子数量的增加而提高。
(2)高岭石表面负静电势区域为52.23%,略大于正静电势区域,静电势绝对值最大值点在Al-OH层。水分子数量由1个增加到4个时,静电势绝对值大于188.18 kJ/mol所占面积由7.99%增加到8.49%,体系整体的静电势水平提高,为后续水分子的吸附提供了更多的活性位点。
(3)高岭石-水分子的氢键强度弱于水分子-水分子间的氢键,而且随着水分子数量的增加,高岭石-水的氢键强度会减弱。

