瑞德西韦在体外抑制猪流行性腹泻病毒复制的研究
王一铭,刘建波,冯 力
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,黑龙江 哈尔滨 150069)
猪流行性腹泻是由猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)引起的一种接触性肠道传染病[1],该病多发于仔猪,造成急性腹泻、呕吐、脱水甚至死亡,死亡率可达100%。PEDV 于20世纪70 年代在英国流行[2],2010 年中国出现PEDV 的变异株,并大规模暴发,给养猪业造成严重的经济损失[3]。目前对该病的防制措施主要是通过给母猪接种疫苗,使其产生母源抗体进而达到免疫仔猪的目的。近几年的临床实践表明,疫苗的保护效率达不到100%,仍有部分免疫过的猪场暴发疫情,所以急需找到一种能够有效阻止PEDV 感染的方法[4]。
PEDV 属于套式病毒目,冠状病毒科,α 冠状病毒属,是一种有囊膜的单股正链RNA 病毒,复制时依赖RNA 聚合酶(RNA-dependent RNA polymerase,RdRp)[5]。RdRp 是大多数RNA 病毒中最保守的酶,在病毒的复制周期中起着至关重要的催化作用,因此RdRp 也被认为是很好的抗病毒靶点[6]。瑞德西韦(Remdesivir)是一种核苷类似物,也是一种广谱的抗病毒药物[7],它在病毒的基因组复制时能抑制RdRp,干扰病毒的复制[8]。2020 年出现的严重急性呼吸综合征冠状病毒2 型(SARS-CoV-2)也是一种RNA 病毒,Alexander 的研究中评估了多种药物的抗SARS-CoV-2 特性,其中瑞德西韦是唯一一种在临床前和临床中均显示较好疗效的抗病毒药物,它缩短了患者的康复时间,并能降低死亡率[9]。多篇文献报道,瑞德西韦可以用于治疗中东呼吸综合征冠状病毒(MERS-CoV)、严重急性呼吸综合征病毒(SARSCoV)、SARS-CoV-2等的感染,且效果较好[10-11]。PEDV与MERS-CoV、SARS-CoV、SARS-CoV-2 同属于冠状病毒,本研究通过间接免疫荧光实验(IFA)、荧光定量PCR、蛋白免疫印迹实验(western blot)以及病毒滴度(TCID50)测定的方法,检测瑞德西韦在体外对PEDV 复制的影响,为临床治疗感染PEDV 的仔猪提供技术手段。
1 材料与方法
1.1 主要实验材料Vero E6 细胞系、PEDV LNCT2株由本实验室保存;鼠PEDV S 蛋白单克隆抗体(MAb)1B9[12]、鼠PEDV N 蛋白MAb 2G3、PEDV N 阳性质粒标准品p3×flag-PEDV N 由本实验室构建并保存;DMEM 培养液和0.25%胰酶购自Gibco 公司;瑞德西韦购自Targetmol公司;DMSO购自Amresco公司;Cell Counting Kit-8(CCK-8)购自北仁化学科技(北京)公司;RNA 提取试剂盒购自QIAGEN 公司;反转录试剂PrimeScriptTMIV 1st strand cDNA Synthesis Mix、荧光定量 试 剂盒TB Green®Premix ExTaqTMII(Tli RNaseH Plus)购自宝生物工程(大连)有限公司;AF488 标记的山羊抗鼠IgG 抗体、IRDye 680CW 标记的山羊抗鼠IgG、IRDye 800CW标记的山羊抗兔IgG抗体购自Invitrogen公司;兔抗GAPDH抗体购自Sigma公司。
1.2 瑞德西韦的细胞毒性测定称取131 mg 瑞德西韦,溶于800 μL DMSO 中,定容至1 mL,配制成217 mmol/L 的溶液。向长满单层Vero E6 细胞的96 孔板中分别加入不同浓度(1 μmol/L、10 μmol/L、20 μmol/L、50 μmol/L、100 μmol/L、200 μmol/L)的瑞德西韦溶液,每孔10 μL,37 ℃培养48 h,以不作任何处理的细胞为空白对照,DMSO 接种组为阴性对照,向每孔加入10 μL CCK-8 溶液,37 ℃培养4 h,利用酶标仪测定OD450nm值。通过公式:细胞存活率=[(实验孔OD450nm值-空白孔OD450nm值)/(对照孔OD450nm值-空白孔OD450nm值)]*100%,计算出瑞德西韦对Vero E6 细胞的毒性。
1.3 不同浓度瑞德西韦对PEDV 复制影响的检测分别将不同浓度(1 μmol/L、2 μmol/L、4 μmol/L、8 μmol/L、16 μmol/L、32 μmol/L)的瑞德西韦与MOI 0.1 的PEDV 混匀后,加入12 孔板中的Vero E6 细胞中,以健康细胞作为空白对照,只接种PEDV 细胞作为阳性对照。37 ℃培养24 h后弃去细胞培养液,4%多聚甲醛固定30 min,0.2%Triton-100 透膜20 min,5%脱 脂 乳 封 闭1 h。以MAb 1B9(1∶3 000)为 一 抗,AF488 标记的山羊抗鼠IgG(1∶500)为二抗,37 ℃避光孵育1 h,DAPI 染色20 min,经IFA 检测瑞德西韦的抗病毒效果。37 ℃培养24 h 后收获细胞,提取RNA,反转录为cDNA 后作为模板,以PEDV N 质粒为标准品,经荧光定量PCR 检测PEDV N 基因的转录水平(上游引物:TTGGCATTTCTACTACCTC/下游引物:AGACGCCTTTCTGACACC)。37 ℃培养24 h 后收获细胞,经SDS-PAGE 电泳后转印至NC 膜,用5%脱脂乳封闭2 h。分别以MAb 2G3(1∶3 000)和兔抗GAPDH 抗体(1∶5 000)为一抗,IRDye 680CW 标记的山羊抗鼠IgG(1∶10 000)和IRDye 800CW 标记的山羊抗 兔IgG(1∶10 000)为 二 抗,经western blot 检 测PEDV N 蛋白的表达量。收集细胞上清,测定上清中的TCID50,检测瑞德西韦对PEDV 复制的影响。
1.4 瑞德西韦半数有效浓度(EC50)的测定分别将不同浓度(1 μmol/L、4 μmol/L、6 μmol/L、8 μmol/L、10 μmol/L、 12 μmol/L、 14 μmol/L、 16 μmol/L、18 μmol/L、20 μmol/L)的 瑞 德 西 韦 与MOI 0.1 的PEDV 混匀后,接种至12 孔板中长满单层的Vero E6细胞中。以健康细胞作为空白对照,只接种PEDV 细胞作为阳性对照,每个浓度设置8 个平行孔,37 ℃培养48 h 后,向每孔加入10 μL CCK-8 溶液,37 ℃培养4 h,利用酶标仪测定OD450nm值。通过公式:抑制率=[(实验孔OD450nm值-阳性对照孔OD450nm值)/(阴性对照孔OD450nm值-阳性对照组OD450nm值)]*100%,计算出瑞德西韦的抑制率,利用GraphPad Prism 9 统计学软件绘图并计算出瑞德西韦的EC50。
1.5 瑞德西韦在EC50 下对PEDV 复制影响的检测根据1.4 中测定的瑞德西韦的EC50,将11.97 μmol/L的瑞德西韦与MOI 0.1 的PEDV 混匀后,接种至12 孔板中长满单层的Vero E6 细胞中,37 ℃培养。以健康细胞作为空白对照,只接种PEDV 细胞作为阳性对照,分别在4 h、12 h、20 h、24 h 固定细胞,采用1.3 中的方法进行IFA 检测。收获细胞样品,采用1.3中的方法,经荧光定量PCR、western blot 检测瑞德西韦在EC50下对PEDV 复制的影响。
1.6 瑞德西韦最佳给药方式的测定根据1.3 中测定的完全抑制PEDV 复制的瑞德西韦的浓度,将16 μmol/L 的瑞德西韦与MOI 0.1 的PEDV,以不同的给药方式,接种至12 孔板中长满单层Vero E6 细胞中。A 组:先将瑞德西韦加入细胞预处理,1 h 后接种PEDV,反应2 h 后洗去病毒-药物混合物,加入瑞德西韦;B 组:先将瑞德西韦加入细胞预处理,1 h后接种PEDV,反应2 h 后洗去病毒-药物混合物,加入不含瑞德西韦的DMEM;C 组:不预处理,将瑞德西韦与PEDV 混匀后加入细胞,反应2 h 后洗去病毒-药物混合物,加入瑞德西韦;D 组:不预处理,将瑞德西韦与PEDV 混匀后加入细胞,反应2 h 后洗去病毒-药物混合物,加入不含瑞德西韦的DMEM;E 组:不预处理,将PEDV 接种细胞,反应2 h 后洗去后加入瑞德西韦。以健康细胞作为空白对照,只接种PEDV 细胞作为阳性对照,37 ℃培养24 h 后后采用1.3 中的方法,经IFA、western blot 测定瑞德西韦的最佳给药方式。
1.7 数据统计利用GraphPad Prism 9软件统计实验数据、分析差异性并绘图,数据用平均标准差(s)表示,*通过t检验确定统计学显著性(*:P<0.05表示差异显著;**:P<0.01、***:P<0.001表示差异极显著)。
2 结 果
2.1 瑞德西韦细胞毒性测定的结果向Vero E6 细胞中分别加入不同浓度的瑞德西韦溶液,并加入CCK-8 溶液,利用酶标仪测定OD450nm值,计算细胞存活率。结果显示,细胞的存活率随瑞德西韦浓度的升高而降低,低浓度的瑞德西韦几乎不影响细胞生长,高浓度的瑞德西韦对细胞有毒性,导致细胞存活率降低。加入的瑞德西韦浓度为1 μmol/L、10 μmol/L、20 μmol/L 时,细胞存活率在100%以上(图1),表明这些浓度的瑞德西韦无细胞毒性;当瑞德西韦浓度为50 μmol/L 时,细胞存活率降至88%,表明该浓度的瑞德西韦对细胞生长有影响,所以应选择不超过50 μmol/L 的瑞德西韦进行后续试验。
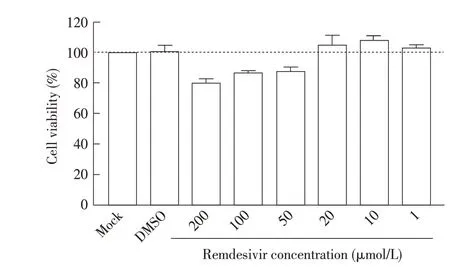
图1 瑞德西韦的细胞毒性Fig.1 The cytotoxic of Remdesivir
2.2 不同浓度瑞德西韦对PEDV 复制影响的检测结果 将PEDV 与不同浓度的瑞德西韦混匀后加入Vero E6 细胞中,24 h 后检测瑞德西韦的抗病毒效果。IFA结果显示,随着药物浓度的增加,绿色荧光逐渐减弱(图2A);当瑞德西韦浓度为16 μmol/L 时,只能看到极少的绿色荧光;当瑞德西韦浓度为32 μmol/L时,完全看不到绿色荧光。荧光定量PCR 结果显示,随着瑞德西韦浓度的升高,PEDV N 基因的转录水平降低(图2B),当瑞德西韦浓度为8 μmol/L及以上时,N 基因的转录水平与阳性对照组相比显著降低(P<0.01)。Western blot及灰度值分析结果显示,随着瑞德西韦浓度的升高,PEDV N 蛋白表达量降低(图2C、图2D),当瑞德西韦浓度为16 μmol/L、32 μmol/L时,与阳性对照组相比差异极显著(P<0.001)。TCID50结果显示,取瑞德西韦浓度为16 μmol/L、32 μmol/L时的上清接种健康细胞,细胞未发生病变,检测不到TCID50(图2E)。上述实验结果表明,瑞德西韦对PEDV 在Vero E6 细胞中的复制有抑制作用,瑞德西韦浓度越高,抑制作用越好。当瑞德西韦的浓度为8 μmol/L时,能够显著抑制PEDV 的复制;浓度为16 μmol/L的瑞德西韦,能够完全抑制PEDV 的复制。
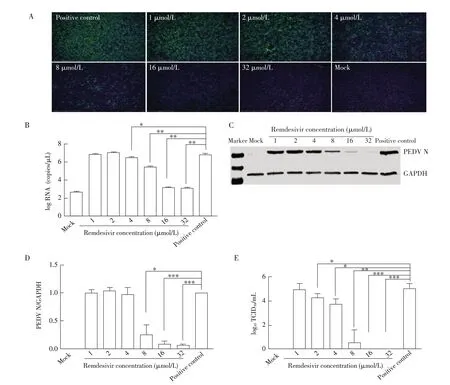
图2 不同浓度瑞德西韦对PEDV复制影响的IFA(A)、荧光定量PCR(B)、western blot(C)、灰度值分析(D)及TCID50(E)检测结果Fig.2 IFA(A),fluorescence quantitative PCR(B),western blot(C),gray value analysis(D)and TCID50(E)results of the effects of different concentrations of Remdesivir on PEDV replication
2.3 瑞德西韦EC50测定的结果将PEDV 与不同浓度的瑞德西韦混匀后加入Vero E6 细胞中,48 h 测定瑞德西韦的EC50,结果显示,瑞德西韦的EC50为11.97 μmol/L(图3)。
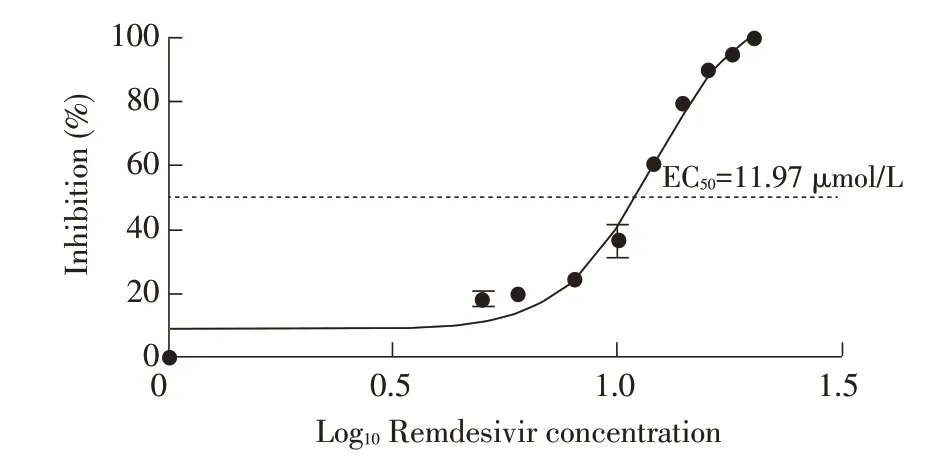
图3 瑞德西韦EC50的测定结果Fig.3 The EC50 of Remdesivir
2.4 瑞德西韦在EC50下对PEDV 复制影响的检测结果将PEDV 与瑞德西韦混匀后加入Vero E6 细胞中,在不同时间点固定后检测瑞德西韦在EC50下对PEDV复制的影响。IFA结果显示,阳性对照组在12 h时能看见较为明显的绿色荧光,20 h、24 h 时荧光强度极强;而加入瑞德西韦的实验组在12 h、20 h、24 h 均仅能看到较少的绿色荧光(图4A)。荧光定量PCR 结果显示,实验组在12 h、20 h、24 h 时N 基因的转录水平均处于较低水平,与阳性对照组相比差异极显著(P<0.001,图4B)。Western blot 结果及灰度值分析显示,在12 h、20 h、24 h 时,实验组N 蛋白的表达量均处于较低水平,与阳性对照组相比差异显著(P<0.01,图4C、图4D)。以上结果表明,瑞德西韦能够抑制PEDV 的复制,且整个实验过程中均有显著的抑制效果。
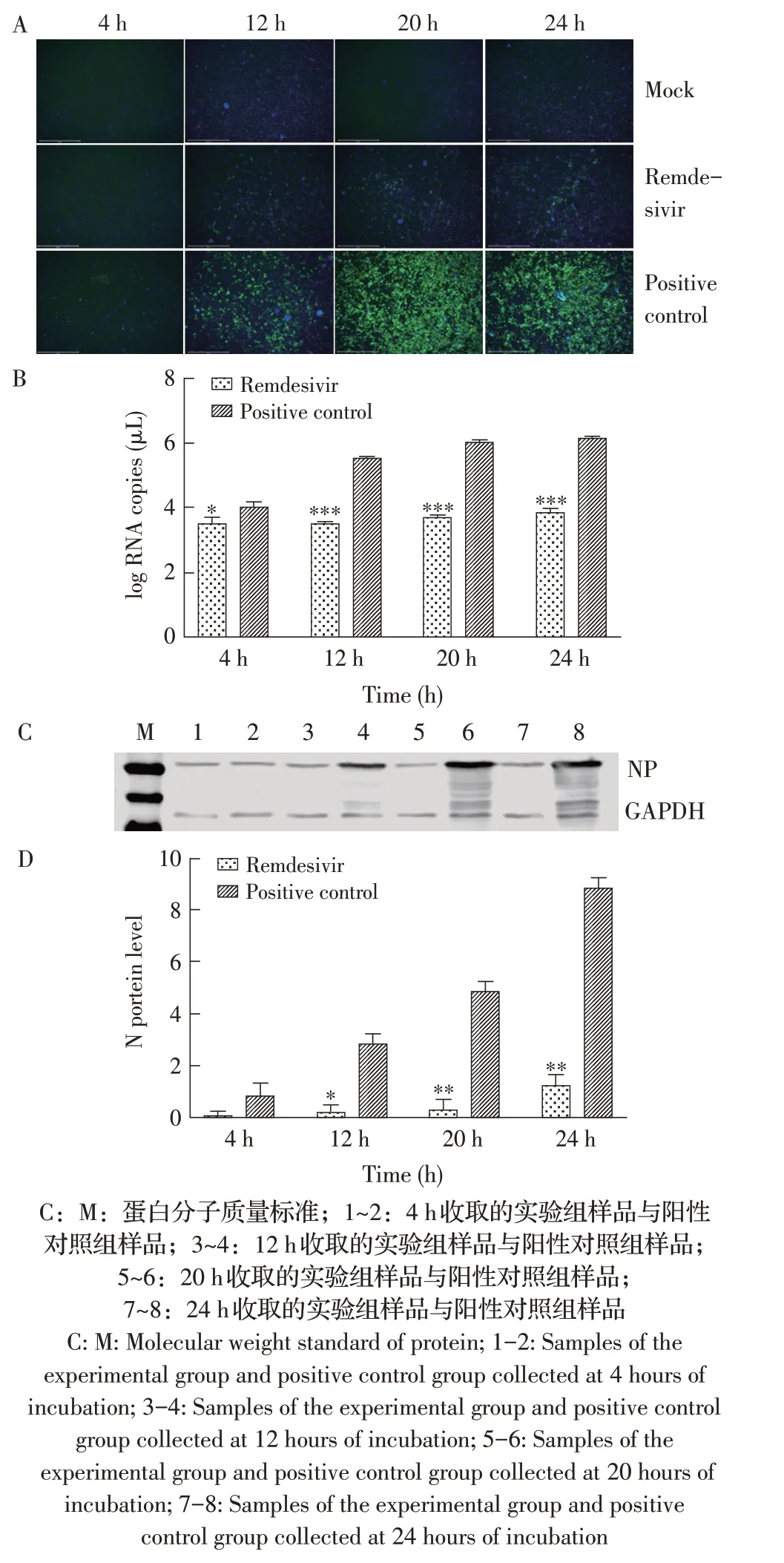
图4 瑞德西韦在EC50下对PEDV复制影响的IFA(A)、荧光定量PCR(B)、western blot(C)及灰度值分析(D)检测结果Fig.4 IFA(A),fluorescence quantitative PCR(B),western blot(C)and gray value analysis(D)results of the effects of Remdesivir on PEDV replication at the dose of an EC50
2.5 瑞德西韦最佳给药方式的测定结果将瑞德西韦与PEDV以不同的给药方式接种Vero E6细胞,检测瑞德西韦的最佳给药方式。IFA结果显示,A组、C组、E组仅出现微弱的绿色荧光,B组、D组出现很强的绿色荧光(图5A)。Western blot 结果与灰度值分析结果显示,A 组、C 组、E 组PEDV N 蛋白的表达量与阳性对照组相比明显降低,差异极显著(P<0.001)。而B 组、D组N蛋白的表达量仍处于较高水平,与阳性对照组相比未见明显差异(图5B、图5C)。TCID50结果显示,A组、C 组、E 组的上清接种细胞后不能使细胞产生病变(图5D)。以上结果表明,A 组(接种PEDV 前给药,且持续到实验结束)、C 组(接种PEDV 同时给药,且持续到实验结束)、E 组(接种PEDV 后给药,且持续到实验结束)的给药方式均能够有效抑制PEDV 复制,而B 组(在接种PEDV 前及接种时给药,之后洗去)、D 组(仅在接种PEDV 时给药,之后洗去)的给药方式对PEDV 的复制几乎无影响。以上结果显示,A、C、E 组的给药方式对PEDV 的抑制效果较好。表明瑞德西韦作为接种病毒前的预防性给药,未能见显著的抗病毒效果;而作为治疗性给药,对病毒的复制有明显的抑制作用。
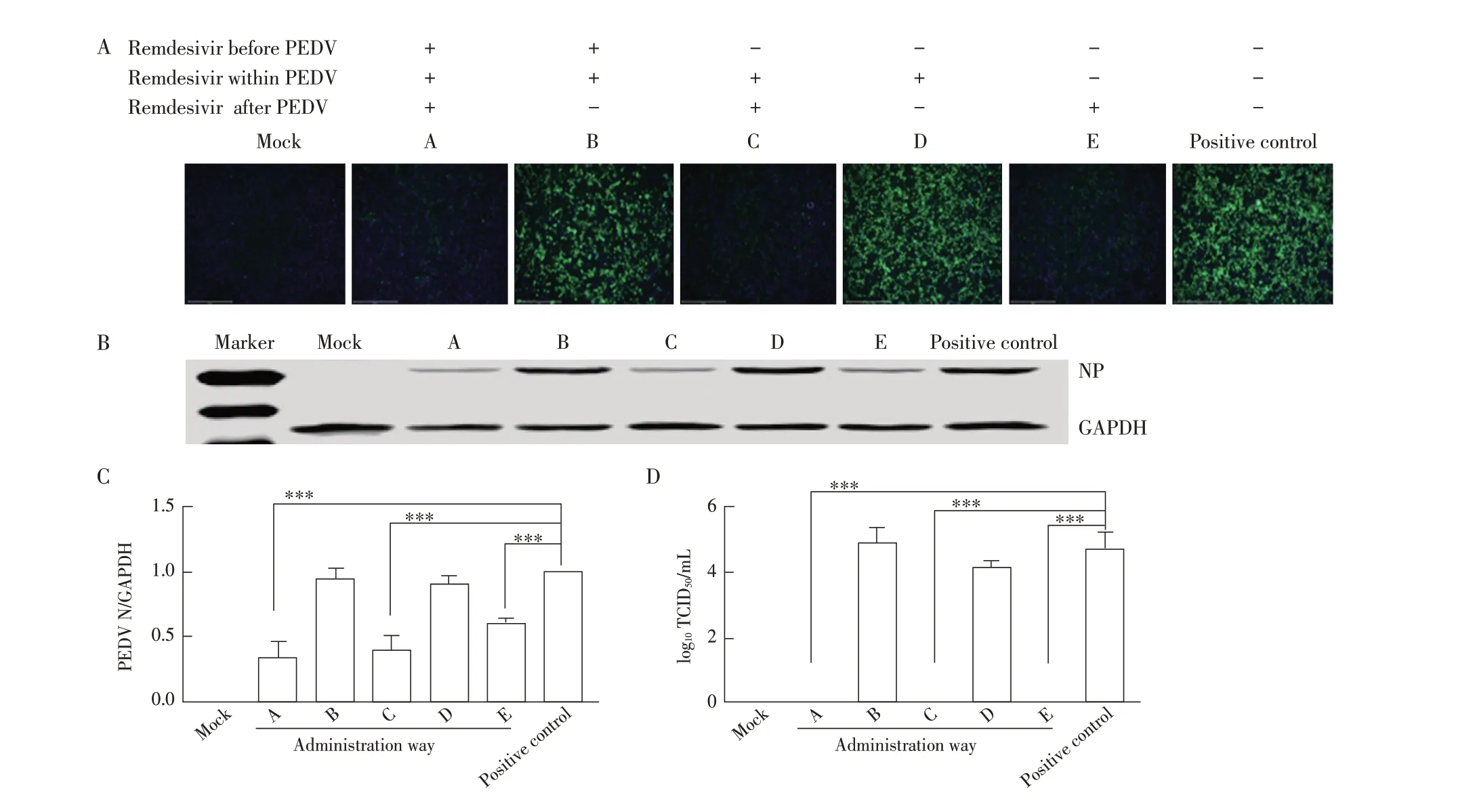
图5 瑞德西韦最佳给药方式的IFA(A)、western blot(B)、灰度值分析(C)及TCID50(D)检测结果Fig.5 IFA(A),western blot(B),gray value analysis(C)and TCID50(D)results of the best administration way of Remdesivir
3 讨 论
PEDV 是引起仔猪腹泻、消瘦、脱水、死亡的重要病原之一,严重影响我国养猪业的发展。目前,已经开发出针对PEDV 的弱毒疫苗、灭活疫苗,但由于PEDV S 基因变异株的流行及其他猪腹泻病毒的混合感染,导致现有疫苗保护效率降低,疫情防控也日益复杂。尽管目前已经有研究报道,PEDV 中和性抗体能够有效阻断PEDV 感染细胞,但相关抗病毒产品仍在研发阶段[13],能够治疗PEDV 感染的化学性药物也尚未开发。因此,研发新型的PEDV 疫苗刻不容缓,同时寻找其他治疗PEDV 感染的有效方法也十分必要。
本研究选取了在新冠疫情中被多次报道可以用于治疗SARS-CoV-2,且有较好效果的核苷类药物—瑞德西韦,来探究其能否影响与SARS-CoV-2 同属于冠状病毒的PEDV 的复制。在PEDV 的易感细胞Vero E6 中进行的细胞毒试验结果显示,低浓度的瑞德西韦几乎无细胞毒性,不会影响细胞的生长,说明瑞德西韦可以用于抑制PEDV 复制影响的研究。将不同浓度的瑞德西韦与PEDV 混匀后接种细胞,结果显示瑞德西韦对PEDV 的复制有抑制作用,导致PEDV N 基因的转录及蛋白表达量均降低,能阻止完整病毒粒子的包装,使细胞不再产生新的活病毒。且抑制作用随着瑞德西韦浓度的增高而增强。当瑞德西韦的浓度为16 μmol/L 时,可以完全抑制PEDV的复制,此时上清中无成熟的病毒粒子,不具备再次感染细胞的能力,说明瑞德西韦能够有效地抑制PEDV 的复制。通过GraphPad Prism 9 统计学软件绘图,计算出瑞德西韦的EC50为11.97 μmol/L。选取11.97 μmol/L的瑞德西韦检测其对PEDV复制的抑制效果,结果显示PEDV 从12 h 开始大量复制,在12 h、20 h、24 h 分别收样检测,结果表明,瑞德西韦在各个时间点均能抑制PEDV 的感染,说明瑞德西韦能够持续抑制PEDV 的感染。选取16 μmol/L 的瑞德西韦检测其抑制PEDV 的最佳给药方式,结果显示在接种PEDV 前及接种时给药,之后洗去、仅在接种PEDV 时给药,之后洗去的两种给药方式均不能抑制PEDV 的感染。A 组(接种PEDV 前给药,且持续到实验结束)、C 组(接种PEDV 同时给药,且持续到实验结束)、E 组(接种PEDV 后给药,且持续到实验结束)的给药方式能有效抑制PEDV 复制。结果表明,瑞德西韦作为接种病毒前的预防性给药,未能见显著的抗病毒效果;而作为接种病毒后的治疗性给药,则对病毒复制有明显的抑制效果。考虑到应用于动物临床试验的指导价值,从节约成本的角度出发,最佳的给药方式为E 组(接种PEDV 后给药,且持续到实验结束)。
综上所述,本研究证明了瑞德西韦能在体外抑制PEDV 的复制,具有治疗PEDV 感染的潜力,为临床治疗PEDV 感染提供参考,后续将进行动物实验进一步深入探究。

