表现为实性肿块伴多发钙化的纤维性纵隔炎1例
沈少博,赵雪妙,毛卫波,李炳荣
丽水市中心医院,浙江 丽水 323000,1.放射科;2.病理科
纤维性纵隔炎为临床罕见疾病,多数纤维性纵隔炎病灶呈无包膜、弥漫性分布的软组织密度影,可累及纵隔、肺门处的大血管及气管引起严重的并发症[1]。笔者报道1例表现为实性肿块伴多发钙化的纤维性纵隔炎病例。患者通过体检胸部CT检查偶然发现左前下纵隔形态规则的类圆形肿块,病灶内见弥漫性小斑片状、条状钙化,与周围组织结构分界清晰;增强扫描显示肿块整体无明显强化。患者行手术切除肿物,病理报告为纤维性纵隔炎。
1 病例资料
患者,男,49岁,因“常规CT平扫体检发现左前下纵隔肿块”入院。既往无手术及外伤史,平素体健,嗜烟(每天10支×8年)。于2020年1月14日行CT增强扫描,影像诊断为左前下纵隔慢性炎症性包块或畸胎瘤,遂转入心胸外科于2 d后行“胸腔镜下纵隔肿瘤切除术”,10 d后出院。实验室检查:血常规、粪便常规、乙肝三系均无明显异常。影像表现:CT平扫示左前下纵隔一类圆形肿块,轮廓光整、边界清晰,大小约2.8 cm×3.4 cm×3.7 cm;病灶整体密度偏高并可见散在斑片状、短条状钙化,见图1、图2。CT增强扫描无明显强化,见图3、图4。CT增强扫描肿块周围脂肪间隙清晰,心包及纵隔胸膜无增厚表现,见图5、图6。影像诊断为“左前下纵隔慢性炎症性包块或畸胎瘤”。术中所见及病理:术中见前纵隔实性肿块,质地硬,具有完整包膜,大小约2.5 cm×3.5 cm×3.5 cm,病灶与心包、胸膜无粘连;病理诊断为“纤维性纵隔炎,病灶内多发砂粒体样及块状钙化”,见图7;免疫组化标记:EMA(-)、Vimentin(+)、CD99淋巴细胞(弱+)、S-100(-)、GFAP(-)、TdT(-)、desmin(-)、CD34示血管(+),浆细胞κ(+)、λ(+),IgG4少量散在细胞(+)。
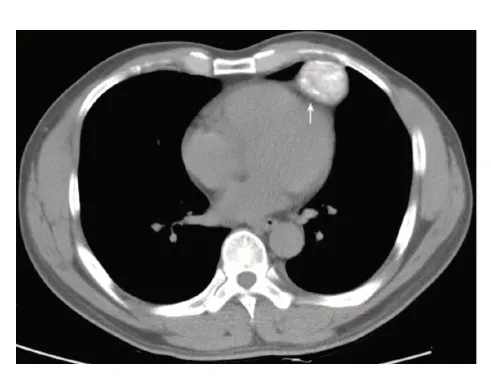
图1 CT平扫横轴面纵隔窗,左前纵隔见高密度团块灶,其内夹杂多发钙化(白↑)
图2 CT平扫横轴面骨窗可见病灶相邻肋骨未见明显受压及骨质改变

图3 CT增强扫描动脉期横轴面示病灶未见强化

图4 CT增强扫描静脉期横轴面示静脉期病灶仍无强化

图5 CT增强扫描静脉期冠状面示病灶周围脂肪间隙清晰
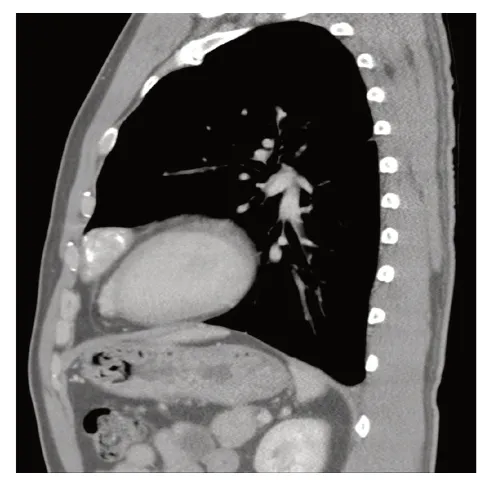
图6 CT增强扫描静脉期矢状面图像示心包及纵隔未见增厚
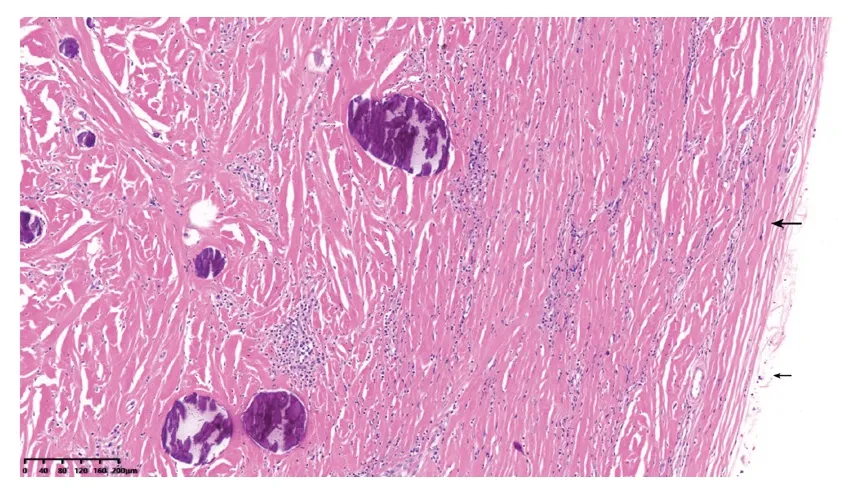
图7 病理切片示病灶由粗大杂乱的纤维构成,病灶边缘可见多层薄环状纤维假包膜结构(黑粗长↑)及少许周边脂肪组织(黑细短↑)(HE,×100)
2 讨论
纤维性纵隔炎为临床罕见疾病,既往曾有多种命名,如“纤维性纵隔炎”“纤维素性纵隔炎”“纤维化纵隔炎”“硬化性纵隔炎”“纵隔纤维化”“慢性纵隔炎”等;结核、真菌感染、纵隔手术可能是本病的病因,同时也有特发性纤维纵隔炎的报道;本病虽为良性病变,但可引起较为严重的并发症甚至导致患者死亡[2-3]。在以往报道中绝大多数纤维性纵隔炎病灶呈无包膜、弥漫性分布的软组织密度影,纵隔和肺门处的大血管及气管较易受累变窄使得患者常具有呼吸困难、肺动脉高压等相应临床体征[4-5]。
本病例的影像、病理及临床表现均与以往绝大多数纤维性纵隔炎的报道有一定不同。首先,本例影像表现为轮廓光整的局限性病灶,病理上具有完整包膜。其次,本例中病灶整体密度偏高,其所测得的最低密度区为93 Hu仍明显高于一般软组织密度,这可能与病灶中伴有多发砂砾体样及块状钙化有关;同时本例在增强扫描中无明显强化。最后,本例患者为体检偶然发现纵隔病灶,临床上并无不适。笔者认为本例属于少见病的不典型表现,而局限性生长的纤维性纵隔炎也应与其他纵隔常见肿瘤或肿瘤样病变鉴别,如畸胎瘤、巨淋巴结增生症等。整体高密度且无强化的影像表现提示本例病灶可能为良性、非肿瘤性病变。
目前纤维性纵隔炎的主要治疗方法为手术切除或支架置入、予以抗结核药或皮质类固醇激素及对症支持治疗[6]。CT可较好地评估病灶范围及纵隔组织脏器受累情况以指导临床后续治疗。对于无临床症状、影像上无周围组织压迫的局限性纤维性纵隔炎患者或许可进行保守随访,避免手术的创伤及风险。

