低压均质对鱼肌原纤维蛋白功能特性的影响
聂小华,刘海珍,唐麒雯,吴聪聪,孙培龙
(浙江工业大学 食品科学与工程学院,浙江 杭州 310014)
我国淡水鱼资源丰富,其中大宗低值淡水鱼(青、草、鲢、鳙和鲤等)的产量占淡水鱼总量的60%以上,其加工方式主要为冷冻、腌制[1]、熏制以及鱼糜加工[2-3],但与大豆、牛乳等相比,鱼类蛋白资源尚未得到充分利用。肌原纤维蛋白是鱼肉中的重要蛋白,约占总蛋白的60%,其主要成分为肌球蛋白和肌动蛋白,均可在低盐环境中发生分子间的自组装,形成不溶性微丝[4],从而很大程度上限制了鱼类肌原纤维蛋白的功能性质。到目前为止,对肌原纤维蛋白的修饰主要集中于糖基化、超声波、静高压和酚类等[5-8]方法。近年来,人们开始探究均质对鸡肉、贝类来源肌原纤维蛋白的结构修饰,改善其功能性质[9-10],以期扩展其在食品工业中的应用领域。
均质处理是食品工业中普遍应用的一种加工方式,处理过程中存在压力、空化、剪切和湍流等机械作用力。当压力达到一定程度时,产生的强烈机械作用力可将蛋白质聚集体颗粒微细化,甚至发生聚集体解聚,影响蛋白质的空间结构,改变其功能性质[11]。基于不同种源的肌原纤维蛋白存在着结构和稳定性的差异,笔者以大宗淡水鱼——花鲢肌原纤维蛋白为研究对象,采用低压均质(10~40 MPa)处理肌原纤维蛋白,评价其在低盐环境中的溶解状态及其界面性质、流变学性质,为改善鱼类肌原纤维蛋白功能性质提供参考。
1 材料与方法
1.1 材料与试剂
鲜活花鲢,购于杭州市朝晖六区农贸市场;5,5-二硫代-2-硝基苯甲酸(DTNB)、8-苯胺基-1-萘磺酸钠(ANS)、牛血清白蛋白(BSA)、考马斯亮蓝R-250、蛋白质分子量标准(宽)、考马斯亮蓝G-250、过硫酸铵、TEMED、丙烯酰胺和双丙烯酰胺均购自北京鼎国昌盛生物技术有限公司;EDTA,都莱生物有限公司;十二烷基硫酸钠(SDS),西陇化工股份有限公司。
1.2 主要仪器设备
纳米粒度及Zeta电位分析仪,美国布鲁克海文仪器公司;GJJ-0.06/60高压均质机,温州桑田流体设备有限公司;Mini-PROTEAN Tetra电泳仪,美国Bio-Rad公司;T18高速分散机,德国IKA集团;MCR52流变仪,安东帕上海商贸有限公司;UV-759紫外可见分光光度计,上海奥谱勒仪器有限公司。
1.3 实验方法
1.3.1 肌原纤维蛋白的制备
取鱼肉搅碎,置于5倍体积的冰水中匀浆处理(8 000 r/min,1 min),离心(10 000g,20 min),收集沉淀,如上反复处理2次;沉淀置于6倍体积的0.6 mol/L NaCl中匀浆,放置1 h,离心(10 000g,20 min)。取上清液加入10倍体积的水,沉淀,离心(10 000g,20 min),所得到的沉淀即为肌原纤维蛋白。上述操作均在4 °C下进行。蛋白质含量测定采用双缩脲法。
1.3.2 肌原纤维蛋白的低压均质处理
将肌原纤维蛋白分散于0.15 mol/L NaCl冰水中,调整其质量浓度为5 mg/mL,采用均质机在10,20,30,40 MPa下连续进行4 次循环,每次循环后快速冷却到4 ℃。所有样品置于4 ℃下以备分析。
1.3.3 粒径和Zeta电位的测定
采用Zeta电位及粒度分析仪测定。调整样品蛋白质量浓度为1 mg/mL,检测角度为90°,测试时间 2 min,测定温度25 ℃。
1.3.4 溶解度的测定
将样品离心(10 000g,20 min),收集上清液。采用双缩脲法测定样品离心前后的蛋白质质量浓度,溶解度(%)为样品离心前后蛋白质质量浓度的比值。
1.3.5 乳化活性和乳化稳定性的测定
采用李长乐方法[12]测定乳化活性(EAI)和乳化稳定性(ESI)。9 mL样液和3 mL大豆油混合,于11 000 r/min下匀浆1 min制备成乳浊液,立即取出50 μL加到质量分数为0.1%的SDS溶液中,混匀,500 nm下测定吸光度A0。乳浊液静置 10 min 后,如上测定得到A10。EAI和ESI的计算式分别为
式中:DF为稀释倍数;F为乳体积分数(0.25);C为蛋白质量浓度,g/mL;Δt为放置时间,10 min。
1.3.6 起泡能力和起泡稳定性的测定
采用常海霞[13]方法测定起泡能力(FC)和起泡稳定性(FS)。5 mL样液和10 mL蒸馏水混合后,记为V,于11 000 r/min下匀浆1 min,记录匀浆后体积V0。室温下放置30 min,记录泡沫体积V30。FC和FS的计算式分别为
1.3.7 表观黏度的测定
使用MCR 52旋转流变仪获得样品的流动曲线。转子型号PP75,测量间距1 mm,测试过程中保持温度25 ℃,剪切黏度范围0~100 s-1。
1.3.8 动态流变学性质的测定
使用MCR 52旋转流变仪测定乳状液的动态流变性。测定条件:转子型号PP75,频率0.1 Hz,应变1%,平行板间距1 mm;温度控制采用程序升温,升温范围20~90 ℃,升温速率1 ℃/min。加样后为防止样品水分蒸发,用液体石蜡或硅油密封。
1.3.9 数据处理
实验各组数据均以平均值±标准差表示,利用SPSS 22.0进行分析处理,绘图采用Origin 9.0软件。
2 结果与讨论
2.1 粒径的变化
低压均质对低盐环境中花鲢肌原纤维蛋白平均粒径的影响如图1所示。随着处理压力的增加,肌原纤维蛋白的粒径分布变得更加均匀,粒径逐步变小,其平均粒径发生下降;当处理压力为40 MPa时,平均粒径由原来的1 653 nm降至485 nm,降低了70.66%。均质处理过程产生的压力、空化、剪切和湍流等机械作用力可破坏大颗粒物料的结构,形成更小的颗粒,导致蛋白聚集体粒径减小,相似的结果已被广泛报道[10,14]。聚集体粒径的减少,也意味着其表面积增加,进而促进蛋白质和溶剂之间的相互作用,有助于肌原纤维蛋白在低钠环境中的溶解和功能特性。

图1 低压均质对鱼肌原纤维蛋白粒径的影响Fig.1 Effect of low pressure homogenization on the size of fish myofibrillar protein
2.2 Zeta电位的变化
Zeta电位反映蛋白质表面的净电荷,当净电荷较高时可增加静电斥力,从而改变蛋白聚集状态[14]。低压均质对低盐环境中花鲢肌原纤维蛋白Zeta电位的影响如图2所示。随着均质压力增加,肌原纤维蛋白的电位绝对值显著升高,从原来的6.32 mV增至8.43 mV(40 MPa)。静电引力是形成肌球蛋白棒状尾部和微丝的重要作用力[4],该结果说明:低压均质破坏了肌原纤维蛋白原有的静电引力,促使其负电荷官能团(如—COO-)从掩蔽的内部转移到蛋白质表面,增强蛋白质分子之间的静电斥力,从而使得聚集体发生解离,同时稳定蛋白质分子[15]。
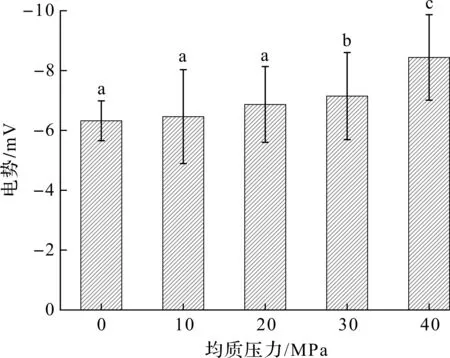
图2 低压均质对鱼肌原纤维蛋白Zeta电位的影响Fig.2 Effect of low pressure homogenization on Zeta potential of fish myofibrillar protein
2.3 溶解度的变化
低压均质对低盐环境中花鲢肌原纤维蛋白溶解度的影响如图3所示。由图3可知:肌原纤维蛋白在低盐环境中呈现出一定的溶解度(44.46%),高于陈星的研究结果[16],这可能与原料、提取方法和分散体系等相关。随着处理压力的增加,肌原纤维蛋白在低盐环境中溶解度逐渐增加,且与处理压力存在正相关;当处理压力为40 MPa时,肌原纤维蛋白溶解度由44.46%增加至59.76%,提高了14%。这意味着低压均质过程中蛋白聚集体发生一定程度的解离,甚至影响到分子的空间结构,从而提高其溶解度,这也与其粒径减小和Zeta电位绝对值增加等相关。但由于均质压力较低,对肌原纤维蛋白的增溶效果远低于已有报道[16]。
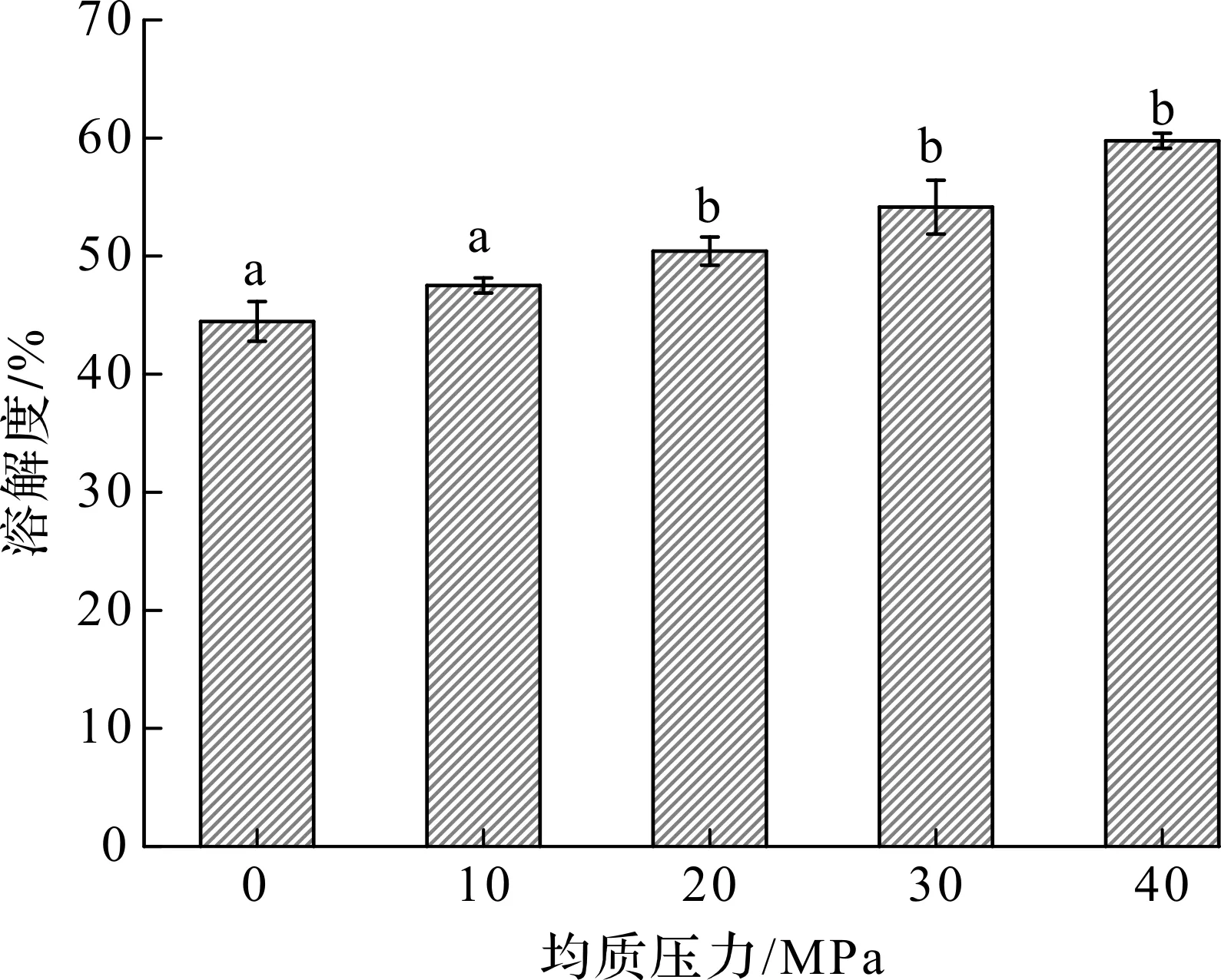
图3 低压均质对鱼肌原纤维蛋白溶解度的影响Fig.3 Effect of low pressure homogenization on solubility of fish myofibrillar protein
2.4 乳化性质的变化
低压均质对低盐环境中花鲢肌原纤维蛋白乳化活性(EAI)和乳化稳定性(ESI)的影响如图4所示。随着均质压力的增加,肌原纤维蛋白的乳化活性和乳化稳定性均呈现不断上升趋势,经40 MPa均质处理后乳化活性由11.79 m2/g提高到21.37 m2/g,乳化稳定性由16.33 min提高到22.20 min。由此推测肌原纤维蛋白溶解度的提高和粒径的减小,促进了其快速迁移到油水界面,从而提高乳化活性。已有文献表明:更小的聚集体和可溶性蛋白质可快速向油-水界面扩散,提高其吸附于界面上的数量[17]。此外,低压均质过程中产生的机械作用力可能促使肌原纤维蛋白发生去折叠和疏水暴露,这有助于蛋白质分子和油或蛋白质和蛋白质之间的相互作用[18]。同时,低压均质处理后肌原纤维蛋白的Zeta电位绝对值得到提高,有利于乳状液的稳定性。

图4 低压均质对鱼肌原纤维蛋白乳化活性和乳化稳定性的影响Fig.4 Effect of low pressure homogenization on emulsifying activity and stability of fish myofibrillar protein
2.5 起泡性质的变化
低压均质对低盐环境中花鲢肌原纤维蛋白的起泡能力(FC)和起泡稳定性(FS)的影响如图5所示。随着均质压力增大,肌原纤维蛋白的起泡能力随之增加,经40 MPa均质处理后起泡能力由28.21%提高到73.33%。通常,蛋白质起泡能力与其在气-水界面的快速大量吸附能力有关。溶解度的增加和聚集体尺寸粒径的降低对泡沫形成有着促进影响。此外,低压均质处理后肌原纤维蛋白起泡性稳定性变化不大。这与Yang等[17]的结果相类似,可能是由于肌原纤维蛋白自身表现出较高的起泡稳定性所致。

图5 低压均质对鱼肌原纤维蛋白起泡性和起泡稳定性的影响Fig.5 Effect of low pressure homogenization on foaming capacity and stability of fish myofibrillar protein
2.6 表观黏度的变化
低压均质对低盐环境中花鲢肌原纤维蛋白表观黏度的影响如图6所示。由图6可知:随着剪切速率的增加,肌原纤维蛋白的表观黏度均发生明显下降,呈现剪切稀化现象,说明其为假塑性流体。经低压均质处理后,肌原纤维蛋白的表观黏度有一定程度的降低,说明其更易发生剪切稀化,且该现象与处理压力存在正相关。这可能与其粒径减小和溶解度增加相关。已有研究表明:蛋白分散体的流动行为受到颗粒特性(如粒径分布、形状和大小)的影响[14]。肌原纤维蛋白是一个以肌球蛋白和肌动蛋白为主组成的混合体系,在低盐环境中自组装成微丝,聚集体粒径较大时,剪切过程中大颗粒相互搅拌在一起,增加了溶液流动的阻力。经低压均质处理后,肌原纤维蛋白分散体系中聚集体平均粒径减小,可降低分散体系流动过程中的阻力。

图6 低压均质对鱼肌原纤维蛋白表观黏度的影响Fig.6 Effect of low pressure homogenization on apparent viscosity of fish myofibrillar protein
2.7 动态流变学性质
低压均质对低盐环境中花鲢肌原纤维蛋白储能模量G′和损耗模量G″的变化如图7所示,以此表征其在加热过程中黏弹性变化。由图7(a)可知:低盐环境中肌原纤维蛋白G′随温度逐步增加,在38 ℃时达到最大值,然后发生一定程度的下降,之后随着温度的升高快速上升,至65 ℃后趋于平缓;而G″从46 ℃开始有明显增加,50 ℃时达到最大值,于60 ℃趋于稳定并有一定程度下降。相似的结果也发生在生理条件下的猪肉肌球蛋白中[19]。经低压均质处理后,肌原纤维蛋白G′和G″均发生明显的下降,且变性峰减弱甚至消失。这可能是均质处理使得部分微丝发生解离,增加了肌原纤维蛋白的溶解度,分子间相互作用变小,增加了蛋白质体系的流动性,从而G′值降低。有研究表明:46~60 ℃黏弹性变化可能与肌球蛋白变性有关,G″在46~50 ℃上升可能是肌球蛋白头部结合所致,到达峰值之后的急剧下降可能是肌球蛋白尾部展开[20]。陈星[16]认为:水溶性肌原纤维蛋白热胶凝能力大幅降低应归因于其肌球蛋白螺旋结构发生解离,且产生了二硫键介导的低聚体。上述结果说明:均质处理阻碍了肌球蛋白(肌原纤维蛋白主要成分)的头部结合和尾部交联[16, 21],其热聚集能力降低。
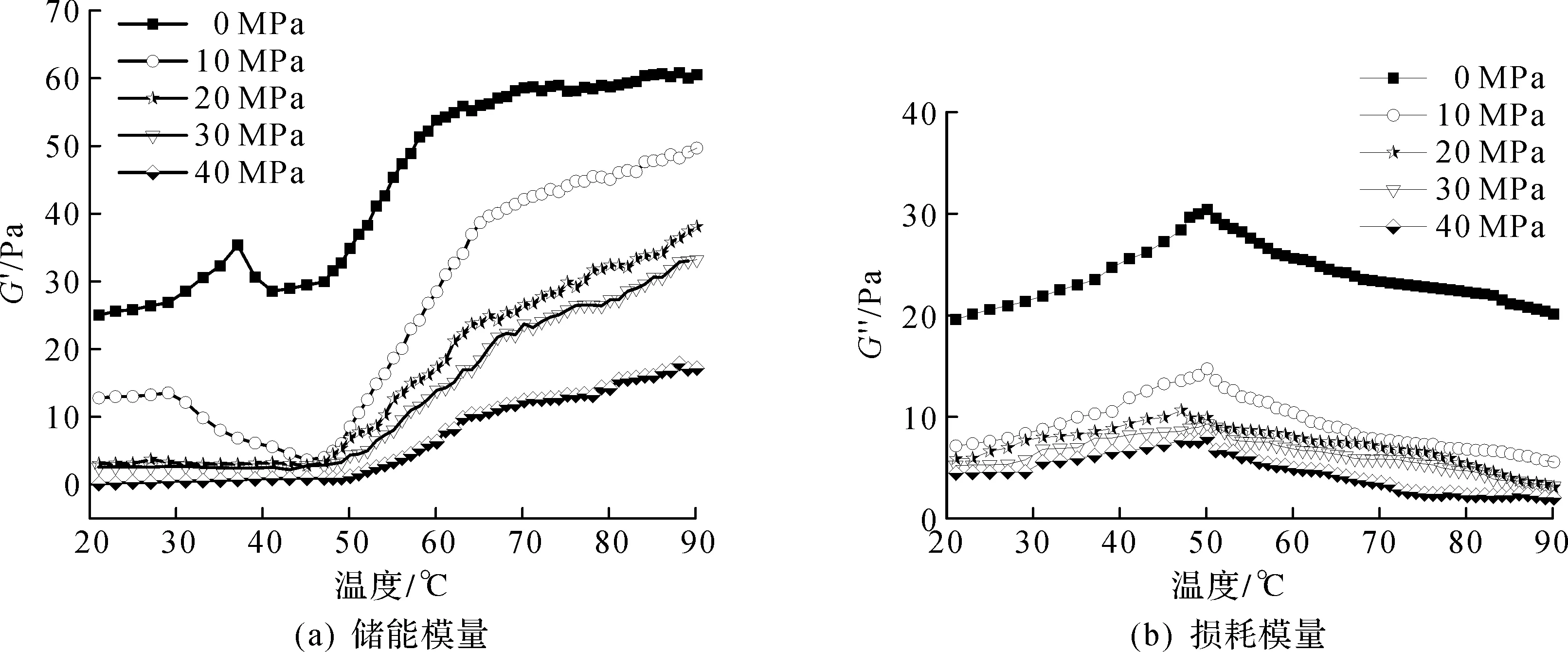
图7 低压均质对鱼肌原纤维蛋白动态流变学性质的影响Fig.7 Effect of low pressure homogenization on dynamic rheology of fish myofibrillar protein
3 结 论
采用均质压力(10~40 MPa)、4 次低压均质处理能够改变肌原纤维蛋白在低盐环境中的功能性质。低压均质可促使肌原纤维蛋白微丝发生解离,粒径降低,同时使得荷电基团暴露在颗粒表面,Zeta电位增加,使其在水中的溶解度增加,如40 MPa下均质处理后其溶解度增加到59.76%,且肌原纤维蛋白的乳化活性和起泡能力分别提高了81.25%和161.14%。但低压均质同时也导致肌原纤维蛋白更易发生剪切变稀现象,加热过程中储能模量和损耗模量发生明显下降,说明均质处理会抑制肌球蛋白的头部结合与尾部交联,降低其热聚集能力,关于均质处理过程中结构的变化机理有待进一步研究。

