高效液相色谱法测定啤酒中嘌呤含量
◎ 郑丽婷,王瑞恒,乐虹雯,陈杏洲
(武汉工程大学 环境生态与生物工程学院,绿色化工过程教育部重点实验室,湖北 武汉 430205)
啤酒是以麦芽和水为主要原料,并添加啤酒花、酵母发酵而成的一种发酵酒,因其口感清爽、香气宜人而受到人们的喜爱[1]。研究发现,市场所售的国内外常见啤酒中嘌呤含量普遍较高[2],该物质在人体中最终代谢为尿酸,尿酸若在体内大量积累,极易引发痛风[3]。随着全球啤酒消费量的增加,饮用高嘌呤啤酒所带来的问题也逐渐突显。
目前,嘌呤类物质检测方法多采用高效液相色谱法[4]、反相离子对色谱法[5]、毛细管电泳法[6],其中高效液相色谱法因操作简单、快速、灵敏、准确而广受青睐。本文旨在建立检测啤酒中嘌呤含量的高效液相色谱法,为啤酒样品中嘌呤的定量检测提供参考,促进啤酒行业健康、快速、稳定的发展。
1 材料与方法
1.1 材料与试剂
腺嘌呤、鸟嘌呤、次黄嘌呤、黄嘌呤标准品,色谱级(纯度≥99.9%),上海源叶生物科技有限公司;磷酸二氢钾、浓硫酸、甲醇,色谱纯,国药集团化学试剂有限公司;实验用超纯水,上海和泰仪器有限公司纯水机制备。
1.2 仪器与设备
Agilent 1260高效液相色谱仪,安捷伦科技有限公司;Ultimate AQ-C18柱(250 mm×4.6 mm,5 μm),月旭科技(上海)股份有限公司;pH计,上海仪电科学仪器有限公司;紫外-可见分光光度计,上海元析仪器有限公司;电子分析天平,常熟市双杰测试仪器厂。
1.3 实验方法
1.3.1 标准溶液配制方法
准确称取腺嘌呤(A)、鸟嘌呤(G)、次黄嘌呤(H)和黄嘌呤(X)4种嘌呤标准品各25 mg,用超纯水溶解并定容至25 mL,加入少量氢氧化钠溶液(10 mol·L-1)助溶,配制成1 g·L-1的标准溶液,并用0.45 μm滤膜过滤,置于4 ℃冰箱冷藏保存,使用时稀释到一定的浓度。使用前看是否存在白色悬浮物,若存在需要重新配制。
1.3.2 标准曲线绘制
分别取体积相同的上述溶液混合,用超纯水稀释至100 mg·L-1、50 mg·L-1、25 mg·L-1、10 mg·L-1、5 mg·L-1、2.5 mg·L-1和 1.0 mg·L-1,用 0.22 μm 滤膜过滤,上机检测,以样品质量浓度为横坐标,峰面积为纵坐标绘制4种嘌呤的标准曲线。
1.3.3 样品前处理
取30 mL啤酒样品于50 mL离心管中,在5 000 r·min-1下离心15 min,将离心后的啤酒倒入敞口三角烧瓶中,经超声除气15 min。
取5 mL的除气啤酒样品于25 mL的试管中,加入3 mol·L-1的硫酸溶液5 mL,加塞后,立即置于100 ℃恒温水浴锅中,在100 ℃下水解10 min,然后迅速冰水浴冷却。用10 mol·L-1的氢氧化钾溶液调整pH到2~8,然后用滤纸过滤,并用蒸馏水洗涤残渣,滤液定容到25 mL,再用0.22 μm滤膜过滤,滤液进入高效液相色谱仪分析。
1.3.4 色谱检测条件
色谱柱:Ultimate AQ-C18柱(250 mm×4.6 mm,5 μm);流动相为 0.02 mol·L-1KH2PO4-H3PO4缓冲溶液(pH=3.6);流速:1.0 mL·min-1;柱温:25 ℃;检测器:紫外检测器;检测波长:254 nm;进样量:10 μL。
1.4 数据处理
采用Agilent 1260高效液相色谱仪自带数据处理系统采集数据,本文所有色谱图和折线图均使用Origin 2019及Excel软件绘制,数据表示形式、精密度、准确度结果均由Excel办公软件处理。
2 结果与分析
2.1 不同液相条件分析
2.1.1 流动相选择
由色谱分离原理可知,流动相的选取直接影响着4种嘌呤的分配比例,进而影响混合物的分离效果。陈月菊[7]在测定食用菌中嘌呤物质的含量时选择甲醇∶水=5∶95作为流动相。程庆红等[8]在测定虾仁和牡蛎中嘌呤类物质的含量时也选择甲醇∶水=5∶95作为流动相,并发现当甲醇浓度高于5%时,次黄嘌呤和黄嘌呤不能完全分开。刘镇等[9]在测定黄酒中嘌呤含量时选择0.007 mol·L-1的磷酸二氢钾(pH=4.0)作为流动相,且分离效果良好。王静萤等[10]利用0.02 mol·L-1的磷酸二氢钾分别测定了啤酒和肉类中嘌呤的含量。
参考以上色谱条件分别选用甲醇∶水=5∶95、0.02 mol·L-1磷酸二氢钾(pH=3.6)、0.02 mol·L-1磷酸二氢钾(pH=3.6)-甲醇(V∶V=98∶2)、0.008 mol·L-1磷酸二氢钾(pH=4.5)作为流动相,流速均为1.0 mL·min-1,柱温为25 ℃,测定嘌呤标准品中4种嘌呤的含量,结果如图1所示。

图1 不同的流动相参数下4种嘌呤的分离效果图
当选择甲醇∶水=5∶95、0.008 mol·L-1的磷酸二氢钾(pH=4.5)作为流动相时,鸟嘌呤和腺嘌呤出峰时间几乎相同;当选择0.02 mol·L-1磷酸二氢钾(pH=3.6)∶甲醇(V∶V=98∶2)溶液作为流动相时,与单纯使用缓冲盐作为流动性时相比,4种嘌呤的保留时间均减小,但鸟嘌呤和腺嘌呤的保留时间相隔太小,分离效果不好,已有研究发现向流动相中加入甲醇对样本中嘌呤的分离影响较小,甚至会使分离效果变差[11-12];当选择0.02 mol·L-1磷酸二氢钾(pH=3.6)作为流动相时,4种嘌呤分离度好,且峰形标准,故选其作为流动相。
2.1.2 流动相pH选择
在使用磷酸二氢钾溶液作为流动相时,不同研究者选用的pH有所差异[13-14]。嘌呤是一种弱碱性物质,且有极性,流动相的pH会影响其极性,从而影响其存在形态。流动相pH影响嘌呤在色谱柱中停留时间和色谱峰形状,对4种嘌呤的分离有很大的影响[15]。因此本实验通过改变磷酸二氢钾缓冲溶液的pH,探究4种嘌呤在pH为3.0、3.2、3.4、3.6、3.8和4.0的0.02 mol·L-1磷酸二氢钾溶液的流动相下的分离情况,结果如图2所示。pH在3.0~4.0时,随着pH增大,4种嘌呤的保留时间增长;pH小于3.6时腺嘌呤与鸟嘌呤的保留时间基本重合,无法分离;当pH增大到3.8时腺嘌呤和次黄嘌呤的保留时间接近;当pH增加到4.0时次黄嘌呤的出峰时间延后,与黄嘌呤接近。当pH=3.6时,4种嘌呤分离情况最佳,故确定流动相pH为3.6。
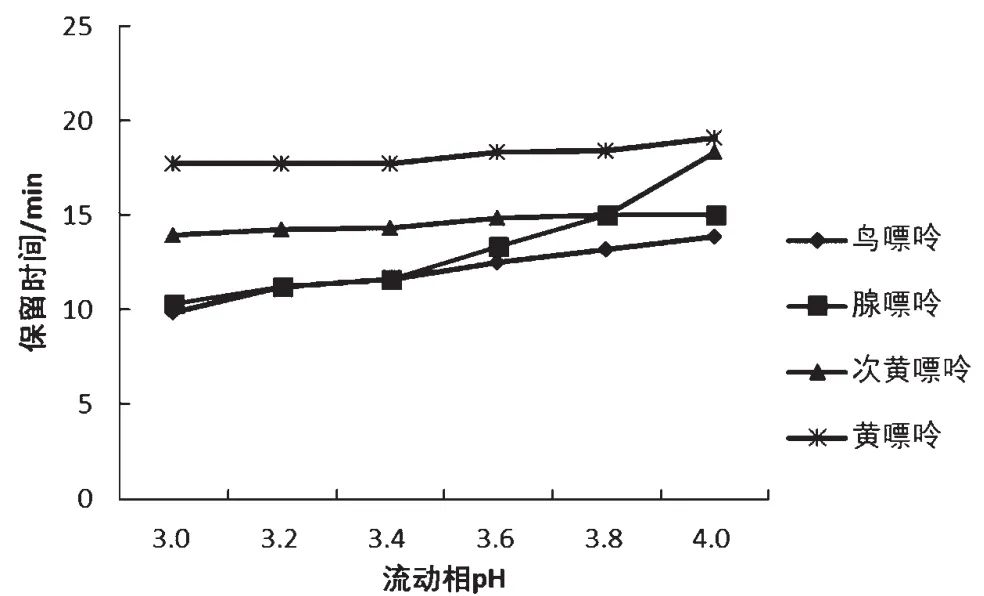
图2 4种嘌呤在不同pH的0.02 mol·L-1磷酸二氢钾条件下的分离效果图
2.1.3 柱温选择
柱温也会影响色谱柱的分离效果。对液相色谱来说,色谱柱处于较高温度的环境下可以加快样本中嘌呤混合物的分离速度,但分辨率和待分离物质的保留时间均会受到影响。本实验研究了柱温为22 ℃、25 ℃、28 ℃和30 ℃时4种嘌呤的分离效果,结果如图3所示。在本实验所研究的温度范围内,温度越低,保留时间越长。当温度大于25 ℃时,腺嘌呤和次黄嘌呤分离度不高,是因为当温度升高时,各组分的分配系数变小,分离度随之减小,越不好分开;当温度小于25 ℃时,鸟嘌呤和腺嘌呤没有完全分离,分离效果差,故选择柱温为25 ℃。

图3 4种嘌呤在不同温度下的分离程度图
2.1.4 波长选择
4种嘌呤具有较强的紫外吸收特性。在200~400 nm波长范围内,对4种嘌呤混合标准品进行扫描,结果如图4所示。扫描结果显示腺嘌呤、鸟嘌呤、黄嘌呤及次黄嘌呤最大吸收波长分别为268 nm、274 nm、277 nm和259 nm。目前测定嘌呤类物质时多选择254 nm波长[16-17],但也有研究者选择了其他波长[18-19],测定结果差异不大,故本研究选择检测波长为254 nm。

图4 嘌呤紫外吸收光谱图
2.2 嘌呤标准曲线及回归方程
对一系列梯度稀释后的嘌呤标准混合溶液进行液相色谱分析,结果如图5所示,以样品浓度为横坐标,峰面积为纵坐标,绘制标准工作曲线,线性方程及相关系数如表1所示。结果显示,采用2.1最终确定的色谱条件,4种嘌呤能够很好的分开,且在1.0~100.0 mg·L-1质量浓度范围内线性关系良好,所有组分相关系数(R)均高于0.999 0。按3倍信噪比计算,检出限为0.010 ~ 0.030 mg·L-1。
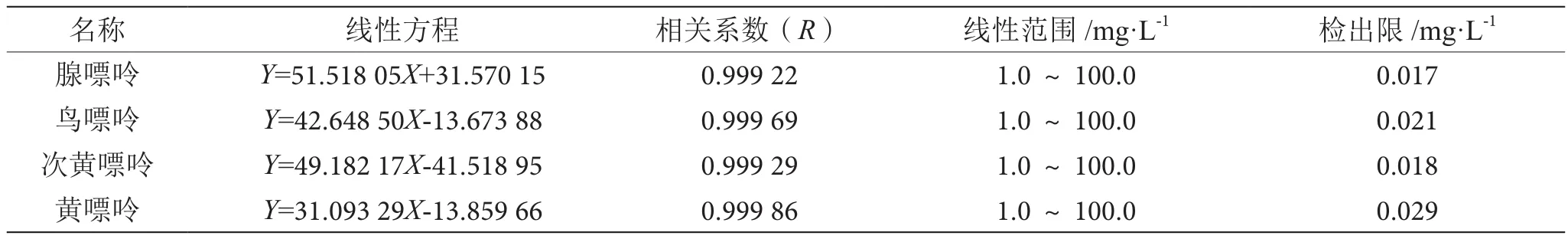
表1 线性试验结果表

图5 4种嘌呤混合标准样品色谱图
2.3 精密度实验
分别取浓度为10 mg·L-1的嘌呤混合标准品于3个进样瓶中,设置进样次数为6次,计算精密度,结果用相对标准偏差(RSD)表示。实验结果如表2所示。结果表明,所测得的4种嘌呤的RSD均小于0.1%,方法准确,实验重现性好,可用于啤酒样品中嘌呤的检测。

表2 HPLC检测精密度实验结果表
2.4 回收率实验
取嘌呤含量已测定的3份啤酒样本,分别补加测定值0.8、1.0、1.2倍的嘌呤标准品,按照本研究优化的色谱参数条件进行测定,每种倍数平行3次,计算平均回收率。回收实验结果如表3所示,4种嘌呤的平均回收率较高,为92%~101%,说明利用该方法测定准确度好。

表3 4种嘌呤的回收率实验结果表(n=3)
2.5 啤酒样品中4种嘌呤含量的测定
根据2.1所确定的色谱条件测定啤酒样品水解后的嘌呤含量,检测结果如图6所示。结果显示所测10余种市售啤酒中嘌呤含量在50~90 mg·L-1范围内。

图6 啤酒样品水解后色谱图
3 结论
本研究建立了检测啤酒中4种嘌呤类物质的高效液相色谱法,优化了流动相pH和色谱柱柱温等参数,实现了4种嘌呤更好的分离,线性关系更加优良,方法的精密度更好。该方法操作简便,准确度和精确度均较高,能为啤酒等食品中嘌呤类物质的定量测定提供参考。

