刺山柑总生物碱对系统性硬皮病小鼠Wnt2、Wnt3a及β-catenin的影响
赵宇涵,康小龙,何承辉
(1.新疆医科大学药学院,新疆 乌鲁木齐 830000;2.新疆维吾尔自治区中医医院,新疆 乌鲁木齐 830002;3.新疆维吾尔自治区药物研究所,新疆 乌鲁木齐 830004)
系统性硬皮病(systemic scleroderma,SSc)是一种慢性自身免疫性疾病,其特征表现为皮肤和内部器官的纤维化以及血管病变[1]。SSc死亡率极高,但尚未完全解释其发病机制[2]。本课题组从刺山柑(CapparisspinosaL.)中提取了有效成分刺山柑总生物碱,在前期研究中,我们采用ELISA实验检测了SSc模型小鼠血清中Wnt相关蛋白Wnt10b的含量,发现刺山柑总生物碱可降低Wnt10b表达[3],采用ELISA实验检测SSc模型小鼠皮肤组织中Wnt1、Wnt2、Wnt3a的蛋白表达,发现刺山柑总生物碱可降低Wnt1、Wnt2、Wnt3a的蛋白表达;采用qRT-PCR法检测了模型小鼠皮肤组织中β-catenin mRNA的表达,免疫组织化学法检测了模型小鼠皮肤组织中β-catenin蛋白的表达,发现刺山柑总生物碱可降低β-catenin mRNA蛋白的表达[4-5]。为了确保实验严谨性,避免假阳性,进一步探讨刺山柑总生物碱对SSc Wnt通路的作用,本研究将采用更加准确的q-RT PCR方法检测其对SSc小鼠Wnt通路中Wnt2 mRNA的表达,采用Western blot方法验证其对SSc小鼠Wnt通路中Wnt3a及β-catenin蛋白表达的影响。
1 材料与仪器
1.1 试验动物90只SPF级BALB/c雌性小鼠,合格证号:SCXK(京)2016-0006,体质量(18-22)g,北京维通利华实验动物技术有限公司。
1.2 试验药物刺山柑购于新疆麦迪森维药饮片厂;盐酸博莱霉素注射剂(批号:17001711,规格:1.5万U),海正辉瑞制药有限公司;青霉胺片(批号:052160901,规格:125 mg/100片),上海上药信谊药厂。
1.3 试验试剂SDS-PAGE凝胶制备试剂盒(批号:20181119)、脱脂奶粉(批号:702F0511)、Lowry法蛋白浓度测定试剂盒、SABC(IgG)-POD试剂盒(批号:20200929)(北京索莱宝科技有限公司);Real Time PCR EasyTM-SYBR GreenⅠ荧光实时定量PCR试剂盒、RT EasyTMⅠ反转录试剂盒(成都福际生物技术有限公司);β-catenin抗体(Cell signaling technology公司,批号:8480s);Wnt3a抗体(Abcam公司,批号:ab219412);β-actin抗体(武汉博士德生物工程有限公司,批号:BM0627);引物合成于上海生工股份有限公司。
1.4 试验仪器低温离心机(型号:LEDEND MICRO21)、核酸蛋白测定仪(型号:NANO DROP 2000)、实时定量PCR仪(型号:Step One PlusTM),美国Thermo Fisher公司;Western blot设备(型号:Mini-protean Tetra System),美国Biorad公司;BMJ-A型包埋机;旋转式生物组织切片仪(型号:RM2016);显微镜(型号:Leica DM300)。
2 方法
2.1 制备原药刺山柑果实加10倍95%的乙醇于80 ℃的水浴锅加热回流提取,30 min/次,提2次,过滤,2次滤液减压浓缩至药材药液质量比为2 ∶1。提取物浓缩干燥后经紫外分光光度法(UV)测得总生物碱水平为32%(W/W),高效液相色谱法(HPLC)测得盐酸水苏碱水平为2.2%(W/W)。
精密称取基质硬脂酸、月桂氮卓酮、白凡士林、单硬脂酸甘油酯作为油相,甘油与刺山柑总生物碱提取物浓缩液作为水相,十二烷基硫酸钠、对羟基苯甲酸乙酯作为乳化剂。制备方法:将上述各相水浴加热至90 ℃溶融,依次将水相和乳化剂加入油相中,边加边搅拌至完全乳化,乳膏颜色均匀、质地细腻为乳化完全,封口备用。
2.2 小鼠SSc模型的建立、分组及给药BALB/c小鼠90只随机分成空白组、SSc模型组、刺山柑总生物碱药物低(225 mg·kg-1)、中(450 mg·kg-1)、高(900 mg·kg-1)剂量给药组及青霉胺(125 mg·kg-1)阳性药组等6组。除空白组外,剩余几组小鼠背部皮下注射博来霉素(BLM)(剂量0.03 g·d-1),28 d建立SSc模型。给药组背部外敷受试药,阳性药组小鼠青霉胺灌胃,空白组与模型组敷无药乳膏基质,以上步骤每天1次×60 d。最后一天给药后将小鼠处死,取其给药处皮肤组织,分成2份,1份冻存于-80 ℃,1份置于10%福尔马林中备用。
2.3 Western blot测定β-catenin蛋白表达取小鼠皮肤,每0.10 g+1 mL RIPA裂解液,匀浆至充分裂解,12 000 r·min-1低温离心5 min取其上清液。取适量上清用Lowry法蛋白浓度测定试剂盒测定蛋白浓度,按照浓度确定上样量,使每孔蛋白上样量一致。样品加入5×上样缓冲液后水浴10 min使之变性,离心2 min点样至各孔于80 V电压下进行聚丙烯酰胺凝胶电泳。取凝胶在200 mA电流下电转至PVDF膜,5%脱脂奶粉封闭1 h,β-catenin一抗孵育2 h,TBST洗脱3次(10 min/次),二抗孵育1 h后再用TBST洗脱3次,加化学发光剂ECL于暗室曝光,得β-catenin蛋白条带。将曝光后的PVDF膜取出,用膜再生液洗去一抗后重新封闭,将一抗换成β-actin内参,重复上述步骤,得内参条带。用ImageJ软件扫描条带,以灰度值做相对蛋白表达量分析。
2.4 RT-PCR测定Wnt2蛋白表达取小鼠皮肤每0.10 g加1 mL裂解液提取总RNA(OD260/OD280≈1.8-2.0),按照DNA/RNA浓度测定仪测定的RNA浓度加入DEPC水使每组的总RNA含量相同。总RNA反转录为cDNA进行RT-PCR,以Rn18s作为内参对照,95 ℃ 10min预变性,95 ℃ 15 s变性,60 ℃ 30 s退火,72 ℃ 10 s延伸,40个循环。相对定量结果分析采用比较荧光强度达阈值时的循环数(Ct)值法(2-△△Ct法),即相对表达量=2-△△Ct,△Ct=Ct目标基因-Ct内参基因,△△Ct=△Ct实验组-△Ct对照组。
引物序列 :
Rn18s:F(5′-CTATTTTGGTTTTCGGAACTGAG-3′)
Rn18s:R(5′-TTGGCAAATGCTTTCGCTCTG-3′)
Wnt2:F(5′-GGATGGCACTGGCTTCACTGTAG-3′)
Wnt2:R(5′-CCTGCCTCTCGGTCCCTGATAC-3′)
2.5 测定Wnt3a蛋白表达
2.5.1免疫组化法 将福尔马林液中固定小鼠皮肤取出进行蜡块包埋、切片置5 mm于防脱载玻片,脱腊至水,按SABC(IgG)-POD试剂盒方法进行操作(一抗:Wnt3a抗体)后于显微镜下摄片。用Image Pro Plus软件进行分析,以IOD/Area值做相对表达量分析。
2.6 统计学方法全部实验数值导入Excel表,统计软件为SPSS 21.0,方差分析比较各组间均数差异,方差齐用LSD法,方差不齐时用Duunett′s T3法比较组间差异。
3 结果
3.1 各组小鼠皮肤中β-catenin 蛋白表达比较Western blot检测小鼠皮肤组织β-catenin蛋白表达结果如Fig1A、B,模型组相对于空白组表达量明显增加(P<0.05),中、高剂量受试药剂量组以及青霉胺组相对于模型组表达量明显降低(P<0.05)。
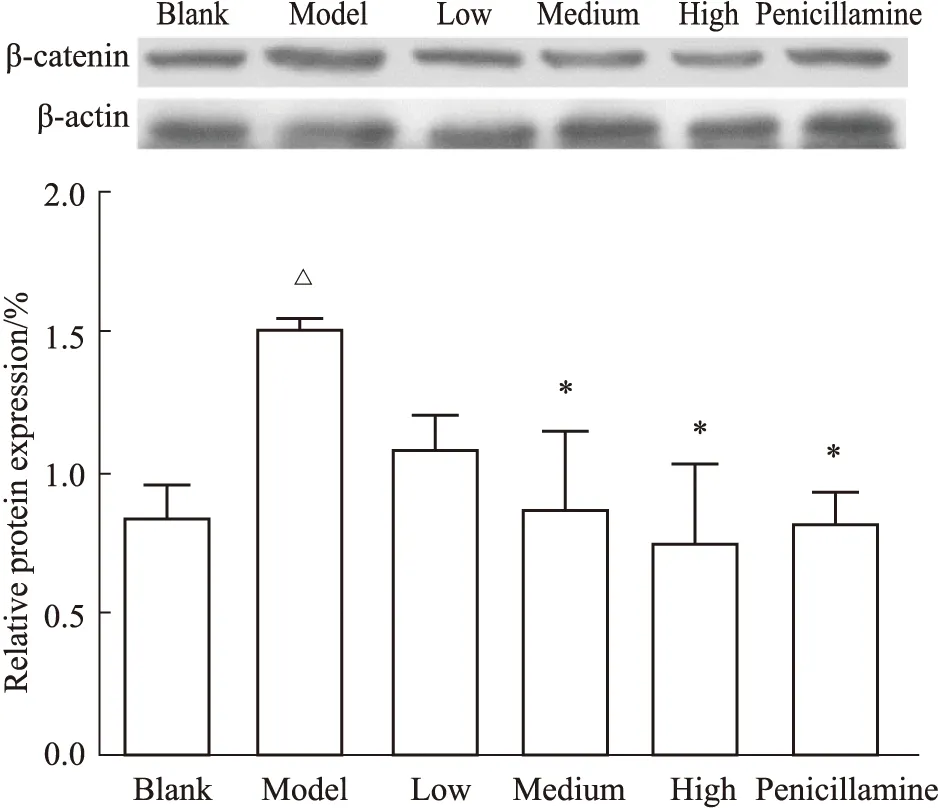
Fig 1 Comparison of relative expression of β-catenin protein in mouse skin by Western blot (n=5)△P<0.05 vs blank group;*P<0.05 vs model group.
3.2 各组小鼠Wnt2 mRNA表达比较qRT-PCR检测结果显示:各组小鼠皮肤组织Wnt2 mRNA的表达量如Fig2,模型组相较于空白组表达量增加(P<0.01),与模型组相比,受试药各组与青霉胺组表达量降低(P<0.01)。
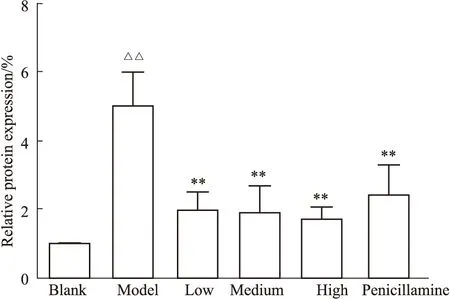
Fig 2 Comparison of Wnt2 mRNA relative expression in mouse skin (n=6)△△P<0.01 vs blank group;**P<0.01 vs model group.
3.3 各组小鼠皮肤中Wnt3a蛋白表达比较
3.3.1免疫组化法检测小鼠皮肤组织Wnt3a蛋白表达 结果如Fig3,模型组相对于空白组表达量明显增加(P<0.01),受试药各剂量组及青霉胺组相对于模型组表达量明显降低(P<0.01)。
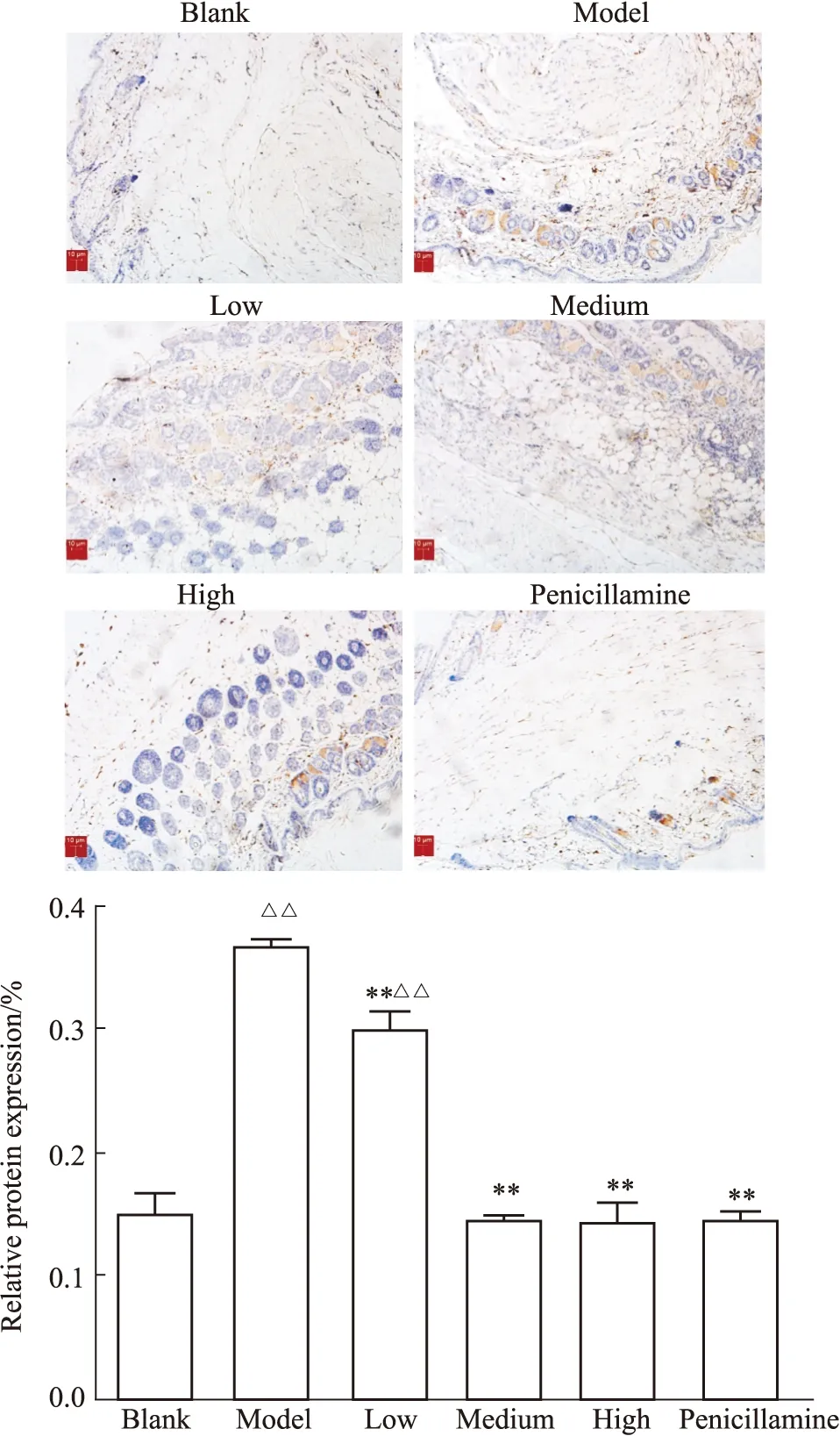
Fig 3 The relative expression of Wnt3a protein in mouse skin detected by immunohistochemistry (n=6)△△P<0.01 vs blank group;**P<0.01 vs model group.
3.3.2Western blot法检测小鼠皮肤组织Wnt3a蛋白表达 结果如Fig4,模型组相对于空白组表达量明显增加(P<0.01),中、高受试药剂量组以及青霉胺组相对于模型组表达量明显降低(P<0.01)。
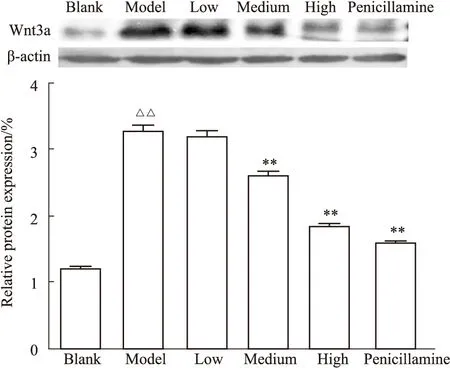
Fig 4 Comparison of relative expression of Wnt3a protein in mouse skin by Western blot (n=5)△△P<0.01 vs the blank group;**P<0.01 vs the model group.
4 讨论
SSc是一种复杂的临床异质性疾病,与多个器官的纤维化有关[6]。肌成纤维细胞是高度收缩的间充质细胞,在SSc和其他纤维化疾病的纤维化发病机制中起着核心作用,研究证实Morphogen信号途径的激活会导致肌成纤维细胞的过度表达[7-8]。Morphogen途径包括Wnt、Notch和Hedgehog信号级联,是胚胎发育和成人组织动态平衡的主要调节器[9]。
经典的Wnt途径是高度保守的细胞间信号传导途径,出现在后生动物中,其信号传导在发育,组织稳态的维持以及受损组织的再生中起着至关重要的作用[10]。在哺乳动物中已经描述了19种Wnt配体和10 种卷曲蛋白(FZD)受体,Wnt途径包括经典的Wnt /β-catenin途径和非经典的平面细胞极性(PCP)和Wnt /钙途径[11]。在细胞外没有Wnt配体的情况下,转录激活因子β-catenin被胞质“破坏复合物”(由支架蛋白腺瘤性息肉病大肠杆菌(APC)和Axin以及蛋白激酶糖原合酶激酶-3(GSK3)和酪蛋白激酶1α(CK1α)组成)降解;在有Wnt配体时,其与共受体Frizzled和LRP5/6以及胞质蛋白Disheveled(Dvl)的结合诱导构象变化,从而传递到Wnt受体的胞内域。形成低聚卷曲蛋白LRP5/6复合物,用于形成活性受体的配合物。破坏复合物中β-catenin的磷酸化和降解最终被阻止,β-catenin积聚在细胞质中,并转移到细胞核。一旦进入细胞核,β-catenin就可以作为靶基因中Wnt反应元件(WRE)上T细胞因子/淋巴增强因子(TCF/LEF)的共激活因子,从而传递Wnt转录程序[12]。
近年来,经典的Wnt信号已被深刻表征为纤维化疾病中持续的成纤维细胞活化的重要介体[13]。如通过抑制Wnt3a/β-catenin信号通路可以抑制肺成纤维细胞Ⅰ、Ⅲ型胶原合成[14],Tyler等[15]通过833名SSc患者的遗传基因和临床数据分析,发现Wnt子网络中的部分基因与肺部疾病以及与SSc发病机制有关的分子过程有关。Laetitia等[16]通过实验表明溶血磷脂酸(LPA1)受体阻滞剂的某些抗SSc纤维化作用可能是通过抑制Wnt信号通路中Wnt2来部分介导的。Wnt /β-catenin信号通路在BLM诱导的SSc小鼠模型中被过度激活,抑制Wnt /β-catenin信号通路的靶基因可以显著改善SSc小鼠模型的皮肤 纤维化[17]。阻断皮肤中的β-catenin信号传导可能逆转SSc皮肤的脂肪减少和纤维化[18]。本研究结果与其一致,SSc模型组Wnt2 mRNA和Wnt3a、β-catenin蛋白表达量均高于空白组。本次研究结果也与本课题组前期研究结果相一致,β-catenin作为Wnt通路的重要信号因子,所以本次实验采用了Western blot的方法检测其蛋白相对表达量,比采用ELISA和免疫组化更能准确的蛋白定量。而免疫组化检测Wnt3a蛋白能更加准确的定位小鼠皮肤组织内抗原的表达位置,结果表明其在胞质内表达。以上测定方法比前期课题组实验结果更加严谨准确,进一步验证SSc小鼠皮肤Wnt通路被过度的激活,刺山柑总生物碱可以抑制其β-catenin、Wnt3a蛋白和Wnt2 mRNA的表达,本实验结果为今后更深一步研究刺山柑总生物碱治疗SSc的作用机制提供了参考。

