白藜芦醇通过调节BDNF/Akt/CREB及TREM1/2表达失衡抑制脂多糖诱导的BV2小胶质细胞炎症反应1
徐静娴,刘 森,高欣冉,高叶俊,夏清荣,葛金芳
(1.安徽医科大学药学院,2.重大自身免疫性疾病安徽省重点实验室,3.炎症免疫性疾病安徽省实验室,安徽 合肥 230032;4.安徽医科大学附属心理医院临床药学部,5.合肥市第四人民医院安徽省精神卫生中心药剂科,合肥 230032)
小胶质细胞是中枢神经系统的固有巨噬细胞,在先天免疫反应及大脑稳态的维持中起着至关重要的作用[1]。在正常生理情况下,小胶质细胞可以吞噬清除细胞碎片和受损的神经元发挥神经保护作用[2]。然而,活化的小胶质细胞则可通过释放肿瘤坏死因子-α (TNF-α)、白细胞介素-1β (IL-1β)等促炎细胞因子和介质,诱发和(或)加速神经炎症和神经毒性反应。研究表明,小胶质细胞过度活化后诱导的神经炎症可导致突触变性、神经细胞死亡和认知功能障碍[3],参与包括抑郁症和阿尔茨海默病在内的众多神经精神疾病的发生发展过程。
白藜芦醇(resveratrol,RES),化学名为3,4′,5-三羟基-二苯乙烯,是一种具有多种生物活性的多酚类化合物,已有多个临床试验观察其对非酒精性脂肪性肝炎(NCT01464801)、糖尿病(NCT02549924,NCT01038089)等代谢性疾病的保护作用及认知和脑血流的影响(NCT01010009)。本课题组长期致力于探索RES的神经保护作用及可能机制,前期研究结果证实RES不仅可以干扰淀粉样蛋白异常沉积[4],还能改善亚临床甲状腺功能减退症[5]或非酒精性脂肪肝大鼠[6]的学习和认知功能障碍,其机制涉及对脑源性神经营养因子(BDNF)丰度调节相关的多种信号分子的调控。然而,RES对小胶质细胞活性和功能的调节尚不清楚。
本研究拟通过建立脂多糖(lipopolysaccharide,LPS)诱导的小胶质细胞损伤模型,在此基础观察白藜芦醇体外用药对炎症反应及相关信号通路分子信号表达的影响,旨在进一步阐明白藜芦醇神经保护作用的机制,为将其进一步开发提供实验依据。
1 材料
1.1 细胞株BV2细胞购自武汉细胞库中国典型培养物保藏中心。
1.2 试剂MEM/EBSS培养基购自美国Hyclone公司;胎牛血清(FBS)购自以色列BI公司;丙酮酸钠和非必需氨基酸购自上海源培生物科技股份有限公司;LPS(L2880)、白藜芦醇、氟西汀购自美国Sigma公司;乳酸脱氢酶(LDH)试剂盒购自江苏碧云天生物科技研究所;Iba-1(DF6442)抗体、Akt(AF6261)抗体、p-Akt(AF0016)抗体及p-CREB(AF389)抗体购自美国affinity公司;TREM1抗体(ab200729)、TREM2抗体(ab201621)和BDNF抗体(ab108319)购自英国abcam公司;Synaptotagmin I抗体(YT4484)购自美国Immunoway公司;CREB(12208-1-AP)抗体购自中国proteintech公司;β-actin抗体(TA-09)、辣根酶标记兔抗和辣根酶标记鼠抗购自北京中杉金桥生物科技有限公司。
1.3 仪器TH4-200倒置光学显微镜(日本OLYMPUS公司);WULTISKANMK3酶标仪(北京安麦格贸易有限公司);5424R离心机(德国艾本德生命科学公司);PCR仪,电泳仪,凝胶成像系统(美国Bio-Rad公司)。
2 方法
2.1 BV2细胞培养将BV2细胞培养在10%的胎牛血清 (FBS),1%非必须氨基酸和丙酮酸钠(1 ∶1)的MEM/EBSS培养基中,置于37 ℃,5% CO2的培养箱中培养。使用0.25%胰蛋白酶和PBS每隔2 d按照1 ∶3的稀释度进行传代培养。
2.2 实验分组① LPS浓度梯度:实验设置对照组,LPS(0.01,0.1,1,10,100 mg·L-1)刺激24 h后通过MTT法检测细胞活性,LDH法检测细胞上清LDH释放量。② LPS时间梯度:实验设置对照组,LPS(1 mg·L-1)刺激6、12、24、48 h,MTT法检测细胞活性。③ 白藜芦醇作用机制实验:设置对照组、模型组(LPS 1 mg·L-1),白藜芦醇(终浓度为10-6、10-7、10-8、10-9、10-10mol·L-1)、氟西汀(终浓度为10-7mol·L-1)和布洛芬组(终浓度为10-7mol·L-1)组,在LPS刺激前12 h加入。继续培养24 h后进行相关指标检测。
2.3 MTT法观察BV2细胞活力将BV2细胞以每孔1×104个接种于96孔板中,CO2培养箱孵育,待细胞贴壁后给药,继续孵育,加入新鲜的配置的MTT (5 g·L-1)20 μL,孵育4 h后终止培养,弃上清液,每孔加入150 μL DMSO,用酶标仪检测在490 nm波长处的吸光(OD)值。
2.4 LDH的测定LDH测定按照生产厂家说明书进行。提前1 h加入LDH释放剂,在培养箱中继续孵育。检测490 nm处的OD值。
2.5 qRT-PCR法测定炎症因子IL-1β、IL-6及TNF-α的mRNA表达收集细胞,用TRIzol裂解细胞提取细胞内总RNA。使用多功能定量仪对总RNA的浓度和纯度进行测定。使用试剂盒法合成cDNA。qRT-PCR反应步骤按照说明书进行,引物序列见Tab 1,采用10 μL反应体系,反应体系包括5 μL的TB Green PCR Master Mix,上下游引物各0.3 μL,3 μL的cDNA,无酶水1.4 μL。反应条件为:95 ℃ 3 min,95 ℃ 15 s,55 ℃ 30 s,总循环数为40个。实验结果用2-ΔΔCt法分析。

Tab 1 Primer sequences
2.6 免疫荧光染色BV2细胞首先用甲醇固定10 min,然后经10%的BSA封闭20 min,用1%的BSA稀释Iba-1一抗(工作浓度1 ∶100),在4 ℃冰箱孵育过夜。次日用PBS洗涤细胞3次,每次5 min,浸洗不摇晃,荧光标记的二抗避光室温孵育1 h。加入含有DAPI的抗荧光衰减封片剂后在荧光显微镜下观察拍照。
2.7 Western blot法测定BDNF等相关蛋白的表达情况在BV2细胞中加入含有1% PMSF和磷酸酶抑制剂的RIPA裂解液提取蛋白。按照BCA法测定蛋白浓度。定量后的蛋白样品经12%的SDS-PAGE凝胶分离蛋白,然后转移到PVDF膜上,经5%的脱脂牛奶室温封闭2 h,加入至相应的一抗中孵育过夜(除TREM1和Synaptotagmin I的一抗工作浓度为1 ∶2 000之外,其他一抗工作浓度均为1 ∶1 000),次日经蛋白相对应的二抗室温孵育1 h,将按比例配置好的超敏ECL显影液滴加到PVDF膜上经化学发光仪进行显影成像。实验结果经Image J图像分析软件进行蛋白条带灰度值分析。

3 结果
3.1 LPS诱导BV2细胞炎症损伤模型的建立
3.1.1LPS对BV2细胞活力的影响 采用MTT方法,结合细胞培养上清中LDH浓度测定,观察不同浓度梯度LPS (0.01、0.1、1、10、100 mg·L-1)、不同作用时间(6、12、24、48 h)对BV2细胞活力的影响。结果如Fig1 A-C所示,随LPS刺激浓度增加、作用时间延长,BV2细胞活力减弱、上清液中LDH释放量增加。综合LPS刺激的时效及量效关系结果,后续实验中选择的BV2细胞损伤模型实验条件为LPS(1 mg·L-1)刺激24 h。
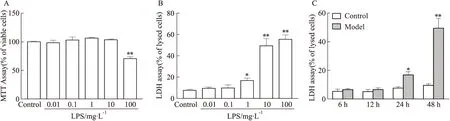
Fig 1 Dose-and time-effect of LPS on viability of BV2 cells*P<0.05,**P<0.01 vs control group.
3.1.2LPS对BV2细胞IL-1β、IL-6及TNF-α mRNA表达的影响 采用qRT-PCR技术检测LPS刺激对BV2细胞中相关炎症因子表达的影响。结果如Fig2所示,与对照组比较,LPS(1 mg·L-1)刺激24 h后BV2细胞中炎症因子IL-1β、IL-6和TNF-α的mRNA表达明显增加(P<0.05)。

Fig 2 Effect of LPS on mRNA expression of IL-1β,IL-6 and TNF-α in BV2 **P<0.01 vs control group.
3.2 白藜芦醇对LPS诱导的BV2细胞培养上清中LDH释放量的影响如Fig3所示,与对照组比较,模型组细胞培养上清中LDH释放量明显增高,白藜芦醇(10-6-10-10mol·L-1)体外用药可以明显抑制LPS诱导的BV2细胞上清液中LDH含量增加(P<0.05)。
3.3 白藜芦醇对LPS诱导的BV2细胞标志物Iba-1表达的影响采用免疫荧光染色观察小胶质细胞活化的特异性标志物Iba-1的表达变化。结果表明,与对照组相比,LPS处理24 h后,细胞胞体变大,突起变多变短,细胞变圆,形似阿米巴状或杆状,形态变化明显且荧光强度略有升高,而白藜芦醇(10-7mol·L-1)及阳性对照药物氟西汀和布洛芬预处理后BV2细胞形态接近正常。见Fig4。
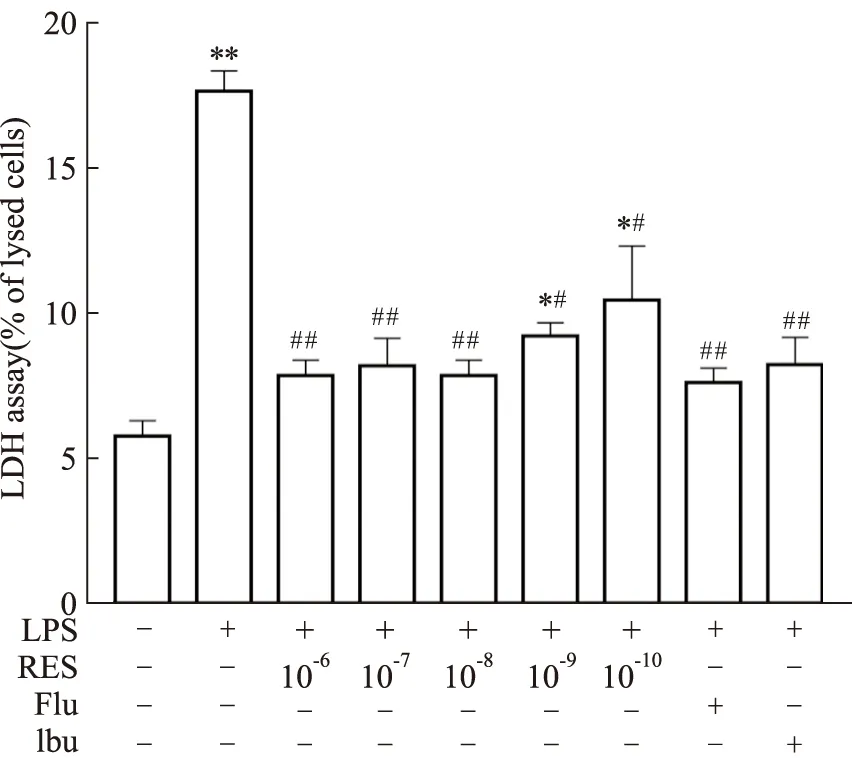
Fig 3 Effect of RES on cell injury induced by LPS in BV2 *P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs model group.
3.4 白藜芦醇对LPS诱导的BV2细胞IL-1β、IL-6和TNF-α表达的影响Fig5为白藜芦醇体外用药对LPS诱导的BV2细胞中炎症因子IL-1β,IL-6,TNF-α的影响。如图所示,与对照组比较,模型组细胞IL-1β、IL-6和TNF-α的表达明显上升,白藜芦醇(10-6-10-10mol·L-1)及阳性对照药物氟西汀和布洛芬预处理均可减少LPS诱导的BV2细胞中IL-1β、IL-6和TNF-α表达的变化(P<0.05或P<0.01)。
3.5 白藜芦醇对LPS诱导的BV2细胞BDNF、p-Akt、p-CREB及Synaptotagmin I蛋白表达的影响Western blot 方法检查白藜芦醇对LPS诱导的BV2细胞BDNF、p-Akt、p-CREB及Synaptotagmin I 蛋白表达的影响。结果如Fig6所示,与对照组相比,LPS刺激的模型组BV2细胞BDNF,p-CREB和Synaptotagmin I蛋白的表达降低,而p-Akt的蛋白表达则明显升高,差异具有统计学意义(P<0.05或P<0.01)。与模型组比较,白藜芦醇及阳性对照药物氟西汀及布洛芬预处理可以逆转上述蛋白表达的改变。
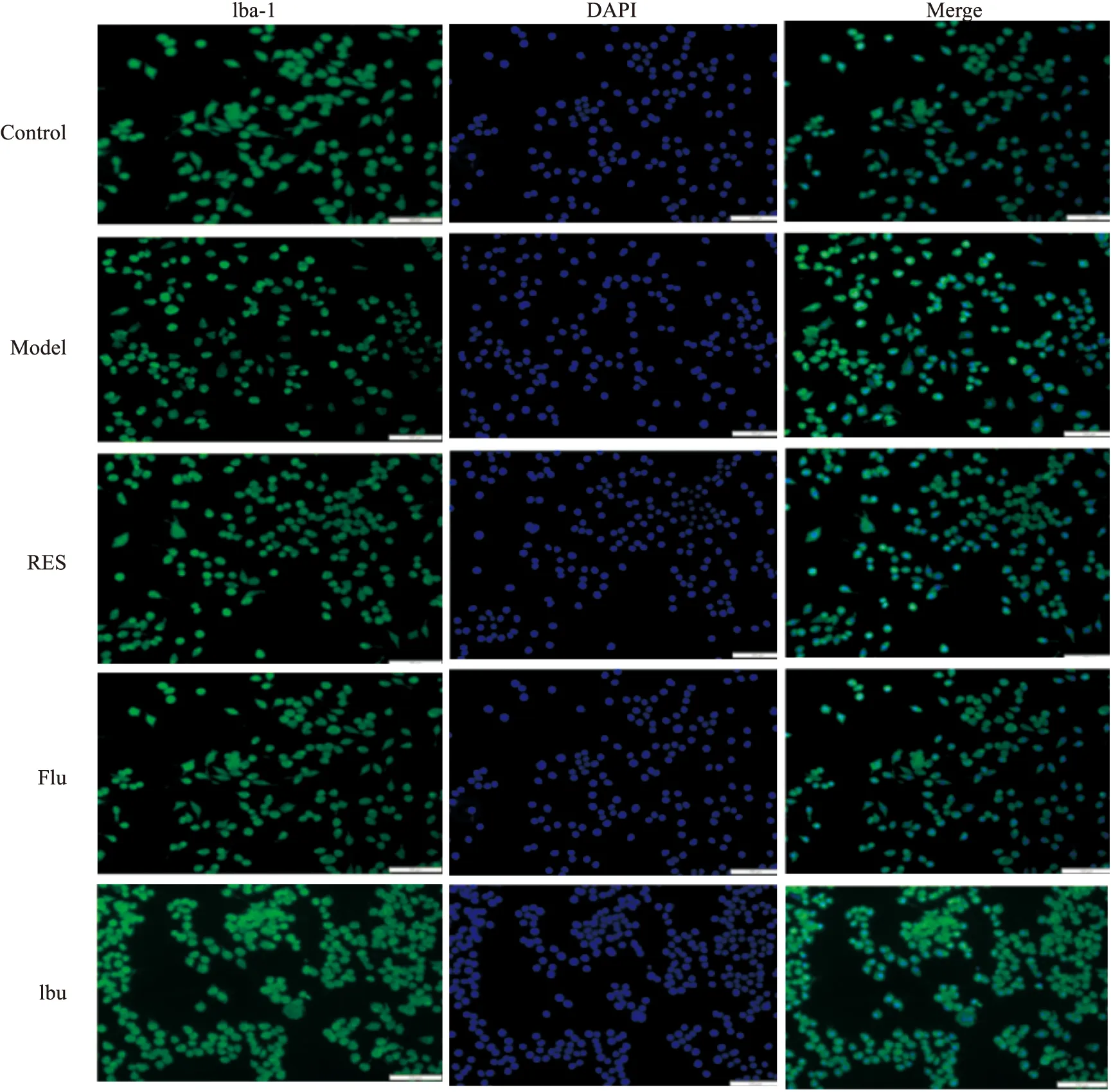
Fig 4 Immunofluorescence staining of Iba-1 in BV2 cells(magnification×200)

Fig 5 Effect of RES on mRNA expression of IL-1β,IL-6 and TNF-α induced by LPS in BV2 *P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs model group.
Pearson检验结果表明,BV2细胞BDNF的表达与p-Akt (r=-0.610,P=0.001)呈负相关,而与CREB (r=0.613,P=0.001)、Synaptotagmin I(r=0.608,P=0.001)的表达呈正相关。
3.6 白藜芦醇对LPS诱导的BV2细胞TREM2和TREM1表达的影响Fig7为各组BV2细胞中TREM1和TREM2表达情况。与对照组相比,模型组TREM1蛋白的表达降低,而TREM2的表达增加,差异具有统计学意义 (P<0.05或P<0.01)。与模型组比较,白藜芦醇及阳性对照药物氟西汀和布洛芬预处理可上调TREM1的表达并降低TREM2的表达。
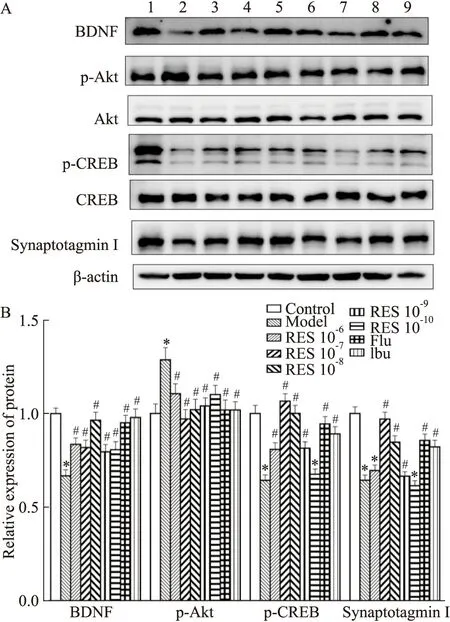
Fig 6 Effect of RES on protein expression of BDNF, p-Akt,p-CREB,and Synaptotagmin I induced by LPS in BV2 A:a typical graph;B:the statistical analysis of Western blot results;1:control group;2:Model group;3-7:RES (10-6~10-10 mol·L-1)group;8:Flu (10-7 mol·L-1)group;9:Ibu group (10-7 mol·L-1).*P<0.05 vs control group;#P<0.05 vs model group.

Fig 7 Effect of RES on protein expression of TREM2 and TREM1 induced by LPS in BV2 A:a typical graph;B:the statistical analysis of Western blot results;1:control group;2:model group;3-7:RES (10-6~10-10 mol·L-1)group;8:Flu (10-7 mol·L-1)group;9:Ibu (10-7 mol·L-1)group.*P<0.05 vs control group;#P<0.05 vs model group.
Pearson检验结果表明,BV2细胞TREM1与TREM2的表达呈负相关 (r=-0.629,P<0.001),并且BDNF的表达与TREM1(r=0.894,P<0.001)的表达呈正相关,而与TREM2(r=-0.593,P=0.001)的表达呈负相关。
4 讨论
小胶质细胞介导的神经系统炎症反应是包括抑郁症和阿尔茨海默病在内的多种神经精神疾病发生发展的重要因素。LPS是革兰阴性细菌细胞壁的主要成分,是小胶质细胞活化的强刺激因子。研究表明,LPS可诱导小胶质细胞激活,导致TNF-α、NO等炎症介质及活性氧自由基释放增多[7-8]。本课题组前期研究证实,LPS腹腔注射可诱导大鼠抑郁相关行为的产生,并导致海马BDNF相关的突触可塑性改变[9]。本研究中采用多种方法观察了LPS对BV2小胶质细胞增殖活性及炎症介质释放的影响,结果表明,LPS(1 mg·L-1)作用24h可诱导BV2细胞活力下降、细胞损伤及炎症介质IL-1β,IL-6,TNF-α的mRNA表达增加。结合特异性的Iba-1免疫荧光染色结果,提示LPS诱导的BV2细胞损伤和炎症模型成功建立。
多酚类化合物白藜芦醇具有广泛的药理学活性,已被证明具有多靶点的神经保护作用。本课题组前期研究结果证实其对多种动物模型学习记忆能力及抑郁相关行为的改善作用[4-6,10]。本研究结果表明,白藜芦醇(10-6-10-10mol·L-1)体外用药可减少BV2细胞培养上清中的LDH释放,并下调IL-1β、IL-6及TNF-α的mRNA表达,提示白藜芦醇可有效缓解LPS诱导的神经炎症反应。5-羟色胺再摄取抑制剂氟西汀是临床常用的抗抑郁药物,主要通过增加突触间隙中的5-羟色胺浓度发挥抗抑郁作用。研究发现,氟西汀治疗抑郁症的机制也涉及对神经炎症的调节[11]。本课题组前期研究中也证实氟西汀对LPS诱导的大鼠抑郁相关行为具有改善作用[9]。基于抑郁症发生机制的炎症反应学说,非甾体抗炎药在抑郁症防治中的作用也引起广泛关注。因此,本研究选择了氟西汀和非甾体抗炎药布洛芬作为阳性对照药物。结果表明,两者均对LPS诱导的BV2小胶质细胞损伤及炎症反应有一定的改善作用。
突触可塑性是大脑结构和功能维持和调节的重要物质基础。研究表明,小胶质细胞可在多环节通过多种途径参与突触可塑性的调节。在大脑发育阶段,神经元相互作用形成大量的无效的突触连接,而这些无效的突触连接不及时清除则会引起神经功能障碍,小胶质则通过修剪无效的突触连接在突触可塑性中起重要作用[12]。在病理状态下,活化的小胶质细胞还可通过吞噬死亡的神经元残骸、修复损伤的突触网络或调节Wnt等信号转导通路的活性影响突触可塑性[13]。并且,有研究指出,小胶质细胞分泌的BDNF是维持学习依赖型突触形成的重要物质基础[14]。BDNF的转录依赖于Ca2+介导的环磷酸腺苷反应元件结合蛋白(CREB)的激活[15],其基因多态性、丰度及功能的改变已被证实参与抑郁症等多种疾病的发生。突触结合蛋白SynaptotagminⅠ参与调控突触的形成及神经递质的传递,在突触可塑性调节中发挥重要作用[16]。本研究中,LPS(1 mg·L-1)作用24 h可诱导BV2细胞BDNF、p-CREB及SynaptotagminⅠ的蛋白表达降低,而p-Akt的蛋白表达则显著升高;白藜芦醇及阳性对照药物氟西汀及布洛芬预处理可以逆转上述蛋白表达的改变。相关性分析结果提示,BDNF的表达与p-CREB及 Synaptotagmin I的表达之间呈正相关关系。虽然磷酸化状态Akt与CREB的关系仍需后续实验确认,这些结果提示,LPS诱导的小胶质细胞炎症反应及其伴发的突触可塑性改变,是白藜芦醇发挥神经保护作用的可能靶点之一,并且BDNF/Akt/CREB信号通路在其中发挥重要作用。
髓样细胞上表达的触发受体(TREMs)不仅能够调节机体的炎症反应[17],其多态性及丰度改变还参与多种神经精神疾病的发生机制[18]。TREMs表达失衡可能是小胶质细胞活性和功能状态发生改变的反应之一。本研究中,LPS(1 mg·L-1)作用24h可诱导BV2细胞TREM1表达下调,TREM2表达增加,且TREM1和TREM2的表达呈负相关,这与本课题组前期研究的整体动物实验结果相一致。白藜芦醇及阳性对照药物氟西汀和布洛芬体外给药均可增加TREM1表达并下调TREM2的表达。Pearson检验结果表明,BDNF、CREB及SynaptotagminⅠ的表达均与TREM1的表达呈正相关,而与TREM2的表达则呈负相关关系。进一步提示,TREM1/2的表达改变可能参与LPS诱导的突触可塑性改变并是白藜芦醇神经保护作用的可能靶点之一。
综上所述,本研究结果表明,白藜芦醇可抑制LPS诱导的BV2小胶质细胞损伤及炎症反应,其机制与调节BDNF/Akt/CREB及TREM1/2的表达失衡有关。

