黄藤素诱导自噬缓解小鼠急性肺损伤的作用研究
皮 娜,王应霞,尹健彬,何 琴,钟 燕,张 旋
(1.昆明医科大学药学院暨云南省天然药物药理重点实验室,云南 昆明 650500;2.昆明医科大学第一附属医院病理科,云南 昆明 650032;3.楚雄州人民医院,云南 楚雄 675000)
急性肺损伤 (acute lung injury,ALI)是临床常见急危重症之一,其发病机制错综复杂,有着较高的病死率。常见原因是由革兰阴性杆菌感染,活化炎症细胞,释放出大量炎症因子,引起急性肺部炎症[1]。ALI会引起肺水肿,使炎症细胞浸润,炎性细胞因子分泌显著增多,肺泡壁增厚等[2]细胞组织病理学改变。ALI是许多疾病共同的病理反应,新型冠状病毒肺炎(COVID-19)的发病机制与ALI的发生发展息息相关[3]。临床上常采用机械通气、激素和抗炎药物治疗,存在着明显缺陷。自噬(autophagy)普遍存在于生物体的发育和老化过程中,多表现为真核细胞清除自身多余或受损的细胞器。生理状态下,细胞可通过自噬实现物质重新利用和自身不断更新,保证新陈代谢等基本生命活动的正常进行,与多器官疾病的发生发展密切相关[4]。自噬在ALI的发生、发展中发挥重要的作用,一方面适度的自噬能抑制炎性因子的释放,另一方面自噬不足或过度自噬能加重细胞损伤[5]。因此对自噬的调节可能成为治疗ALI的新策略。
黄藤素是从防己科植物黄藤(Fibraurearecisapierre)的根部以及茎中经过工艺提取纯化后所得的单一组分生物碱,有着广泛的药理作用,包括抗癌、抗氧化、抗炎、神经保护、抗菌、抗病毒、调节血脂等多种功效,被称为“植物抗生素”[6]。前期研究发现,黄藤素对急性肺损伤炎症具有保护作用[7],然而其抗ALI具体的作用机制及对自噬的影响尚不清楚。目前,越来越多的研究报告了自噬在急性肺损伤的重要性。有报道称ALI与自噬有关,自噬会缓解炎性反应,从而保护脂多糖诱导的肺损伤,并且上调自噬水平会保护急性肺损伤[8]。因此本研究通过LPS诱导ALI小鼠模型,观察黄藤素对肺组织病理形态学HE染色和NF-κB p65免疫组织化学染色的影响,计算肺系数,检测小鼠BALF中总蛋白浓度和炎症细胞因子TNF-α、IL-8和IL-1β含量,检测肺组织NF-κB p65、Beclin1和LC-3蛋白表达,观察黄藤素对急性肺损伤肺泡炎、肺泡毛细血管通透性、相关炎症细胞因子的分泌情况及自噬蛋白的表达情况,评价黄藤素对ALI的保护作用及相关作用机制。
1 材料与方法
1.1 实验动物SPF级昆明小鼠72只(♂,20±2 g),昆明医科大学实验动物学部提供,许可证号:SCSK(滇K2015-0002)。
1.2 试剂黄藤素(盐酸巴马汀)(上海金穗生物公司,批号:Z16J10X79792);地塞米松磷酸钠注射液(西南药业公司,货号:H50021463);脂多糖(索莱宝公司,批号:078M4039V);IL-1β 试剂盒(Invitrogen公司,货号:BMS6002)、TNF-α试剂盒(Invitrogen公司,货号:BMS607/3);IL-8试剂盒(欣博盛公司,货号:EMC104);苏木精-伊红染色液(迈威生物科技公司,批号:190815);GAPDH(Proteintech公司,批号:10494-1-AP);HRP Ig G(H+L)抗体(Proteintech公司,批号:20000243);NF-κB p65抗体(CST公司,批号:9);LC-3、Beclin1抗体(CST公司)。
1.3 仪器Nikon DS-Ri2自动显微镜(日本Nikon公司);Amersham Imager 600超灵敏多功能成像仪(美国GE公司);Scientific Multiskan GO酶标仪(美国Thermo scientific公司);Bio-rad mini Protein 3电泳仪(Bio-rad公司);微量进样器(50ul)(上海安亭微量进样器厂);Count star 自动细胞计数仪(上海睿钰生物科技有限公司)。
1.4 实验方法
1.4.1实验设计 小鼠正常饲养1周,按体重编号随机分组,正常(NS)组、模型(LPS)组、黄藤素低(PaH-L)、中(PaH-M)、高(PaH-H)(5 mg·kg-1、10 mg·kg-1、20 mg·kg-1)剂量组,地塞米松(DXM)组(2.5 mg·kg-1),每组12只。NS组和LPS 组腹腔注射生理盐水,黄藤素给药组腹腔注射不同剂量的黄藤素,DXM组腹腔注射地塞米松磷酸钠注射液,连续预防给药3 d,最后一天给药2 h后,腹腔注射水合氯醛麻醉小鼠,切开颈部皮肤,暴露气管,使用微量进样器对NS组的气管滴注NS,其余各组气管滴注 LPS溶液(5 mg·kg-1),建立小鼠急性肺损伤模型。
1.4.2样品采集与处理 每组小鼠均分为2批,气管滴注LPS 24 h后称质量,深度麻醉小鼠。第1批取肺组织,记录肺质量,分取左肺于10%中性福尔马林溶液中固定,用于病理学染色观察;右肺快速冻存液氮,用于Western blot检测蛋白表达。第2批小鼠进行支气管肺泡灌洗,每次抽洗匀速进行,收集灌洗液,离心,分装上清,ELISA试剂盒检测炎症因子含量,BCA试剂盒检测总蛋白浓度,细胞沉淀重悬,进行总细胞计数和细胞涂片HE染色。
1.4.3计算肺系数 取材前称量小鼠的体质量,深度麻醉小鼠,取出全肺,用潮湿棉花吸去残血,准确称量肺重,根据公式(肺系数/%=肺湿重/体重×100%)计算肺系数。
1.4.4BALF总蛋白浓度 取BALF上清,按BCA试剂盒说明书操作,测定吸光度(OD)值,根据标准曲线对总蛋白浓度进行定量。
1.4.5ELISA法检测BALF中TNF-α、IL-8和IL-1β含量 按试剂盒说明书操作对BALF中TNF-α、IL-8和IL-1β的含量进行检测并定量。
1.4.6BALF总细胞计数及细胞涂片HE染色 BALF沉淀加入等体积PBS重悬,取20 μL计数总细胞数,剩余重悬液取75 μL进行涂片,晾干,苏木精-伊红染色,光学显微镜(200×)观察细胞染色情况,采集图像。
1.4.7HE染色观察肺组织病理变化 取肺组织于10%中性福尔马林溶液固定,脱水、包埋、切片,H&E染色,镜检并采集图像。按照文献Szapiel[9]法对肺泡炎进行评分。
1.4.8肺组织NF-κB p65蛋白免疫组化分析 肺组织切片,经常规脱蜡,PBS冲洗,阻断内源性过氧化氢酶,抗原修复,加一抗NF-κB p65(1 ∶50),4 ℃孵育过夜,PBS洗涤后滴加二抗,DAB染色,苏木精染色,返蓝,脱水透明,封片晾干,最后镜检并采集图像。采用IHC评分方法,通过ImageJ软件在光学显微镜下对组织切片按染色程度和阳性范围进行评分,最终以二者分数相加作为总评分,再进行比较。
1.4.9Western blot检测肺组织NF-κB p65、Beclin1和LC-3蛋白表达 取肺组织加入裂解液和蛋白酶抑制剂制备组织匀浆,提取的肺组织总蛋白用BCA试剂盒进行蛋白定量,经过高温使蛋白变性备用。制胶,上样,进行电泳分离,蛋白转移至PVDF膜,脱脂牛奶封闭,孵育一抗NF-κB p65、Beclin1、LC-3、GAPDH抗体,4 ℃冰箱过夜,洗涤,室温孵育二抗,显影,拍照。使用Image J软件分析,以目的蛋白与GAPDH的比值作为蛋白相对表达量。

2 结果
2.1 肺系数肺系数结果显示,与NS组比较,LPS组小鼠肺系数明显升高(P<0.001),其它药物组也有不同程度的升高(P<0.01);与LPS组比较,各给药组肺系数均有不同程度的降低(P<0.05),PaH-M组肺系数明显降低(P<0.01)。结果显示黄藤素能降低小鼠肺系数,其作用与DXM相当。见Fig1。
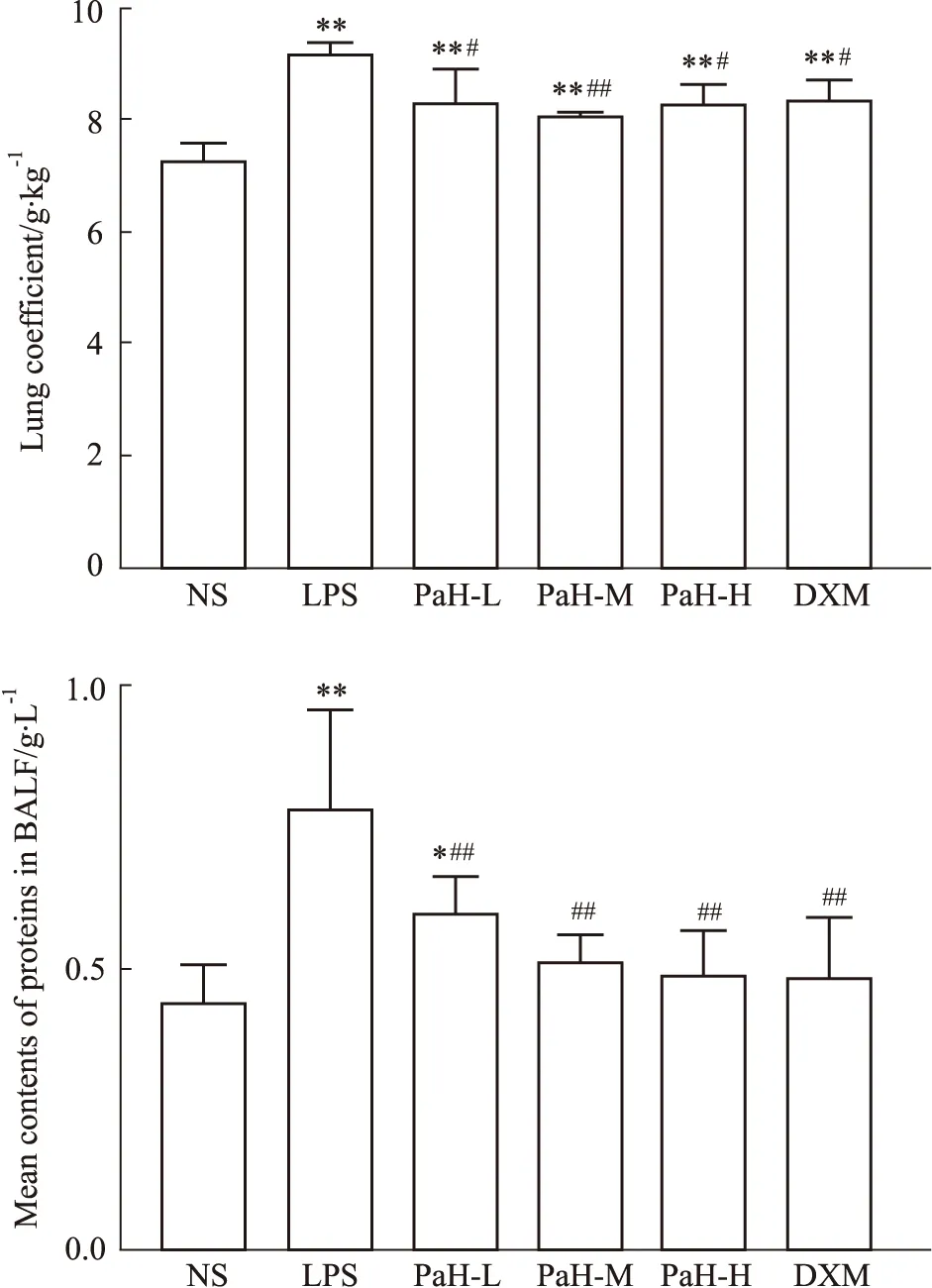
Fig 1 Lung coefficient and contents of proteins in BALF (n=6)NS-normal group,LPS-lipopolysaccharide model group,PaH-L-Low doses of palmatine hydrochloride group,PaH-M-Midle doses of palmatine hydrochloride group,PaH-H-High doses of palmatine hydrochloride group,DXM-Dexamethasone positive drug group.**P<0.01,*P<0.05 vs normal group;##P<0.01,#P<0.05 vs LPS group.
2.2 BALF总蛋白浓度总蛋白浓度结果显示,LPS组总蛋白浓度明显升高,与NS组比较差异存在显著性(P<0.001);与LPS组比较,各给药组的总蛋白浓度均明显降低(P<0.01),其中PaH+H组与DXM组效果相当。结果显示,黄藤素能明显降低LPS诱导急性肺损伤小鼠中BALF总蛋白浓度。
2.3 BALF总细胞数和细胞HE染色总细胞数结果显示,NS组总细胞数较少,与NS组比较,经LPS处理后,LPS组总细胞数明显增加(P<0.001),与LPS组比较,PaH+M组与PaH+H组总细胞数明显减少(P<0.001);与PaH+L组比较,PaH+M组与PaH+H组总细胞数减少(P<0.05)。细胞HE染色显示,细胞总数以LPS组最多,各治疗组细胞数均较LPS组减少。结果显示,黄藤素能降低BALF中总细胞数目的升高,有一定剂量依赖关系,PaH-H组治疗效果和DXM组相当,见Fig2,3。
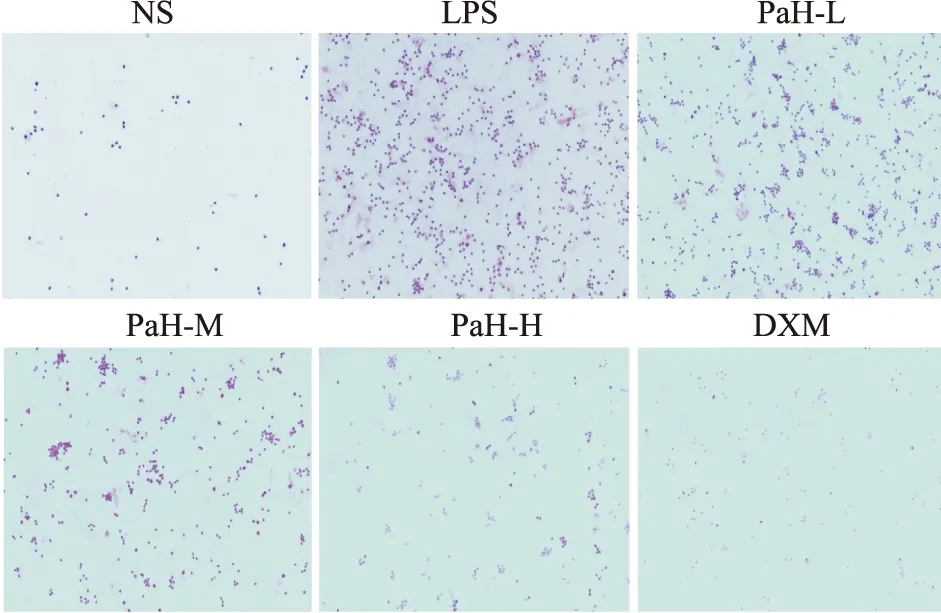
Fig 2 HE staining of cells (200×)(n=6)NS-normal group,LPS-lipopolysaccharide model group,PaH-L-Low doses of palmatine hydrochloride group,PaH-M-Midle doses of palmatine hydrochloride group,PaH-H-High doses of palmatine hydrochloride group,DXM-Dexamethasone positive drug group.
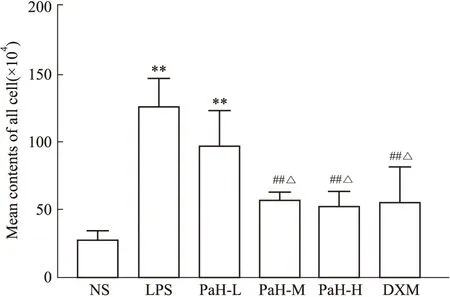
Fig 3 Cell counts in BALF(n=6)NS-normal group,LPS-lipopolysaccharide model group,PaH-L-Low doses of palmatine hydrochloride group,PaH-M-Midle doses of palmatine hydrochloride group,PaH-H-High doses of palmatine hydrochloride group,DXM-Dexamethasone positive drug group.**P<0.01 vs normal group;##P<0.01 vs LPS group;△P<0.05 vs PaH-L group.
2.4 ELISA检测BALF中TNF-α、IL-Iβ与IL-8含量TNF-α、IL-1β与IL-8结果显示,与NS组比较,LPS组TNF-α、IL-8、IL-Iβ明显升高(P<0.001),其它各药物组TNF-α、IL-8和IL-1β也有不同程度的升高(P<0.05),与LPS组比较,PaH+M组、PaH+H组与DXM组均可降低TNF-α、IL-8和IL-1β含量(P<0.05);与PaH+L组比较,PaH+M组与PaH+H组TNF-α、IL-Iβ与IL-8含量降低(P<0.05),PaH+H组治疗效果与DXM组相当。结果显示,LPS可刺激TNF-α、IL-8和IL-1β因子的分泌,黄藤素治疗可减少小鼠BALF中TNF-α、IL-8和IL-1β因子含量,见Fig4。
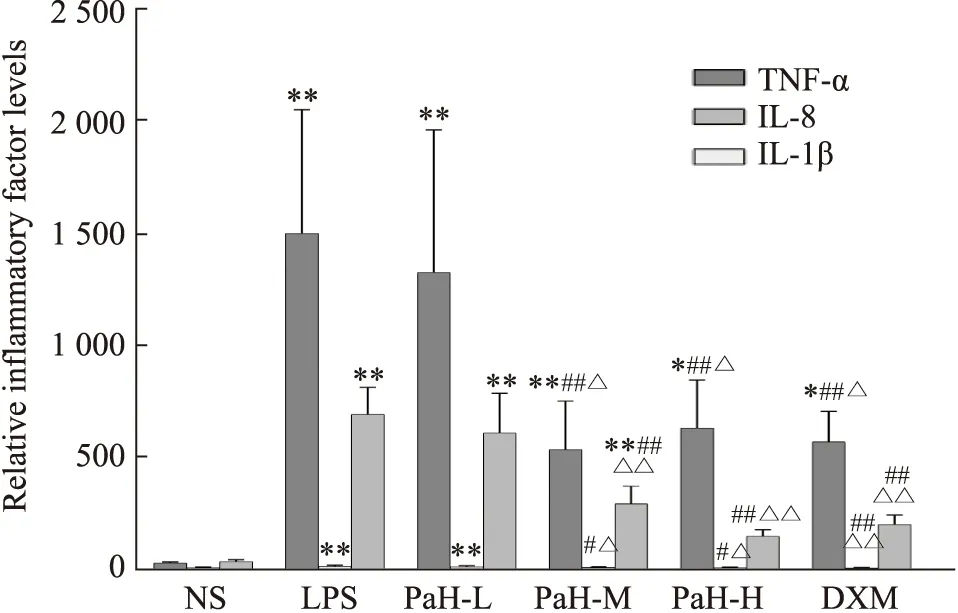
Fig 4 Contents of TNF-α,IL-1β and IL-8 in BALF (n=6)*P<0.05,**P<0.01 vs normal group;#P<0.05,##P<0.01 vs LPS group;△P<0.05,△△P<0.01 vs PaH-L group.NS-normal group,LPS-lipopolysaccharide model group,PaH-L-Low doses of palmatine hydrochloride group,PaH-M-Midle doses of palmatine hydrochloride group,PaH-H-High doses of palmatine hydrochloride group,DXM-Dexamethasone positive drug group.
2.5 肺泡炎评分HE染色结果显示,与NS组比较,LPS组肺泡结构破坏明显,肺泡壁水肿、肺间质明显增厚(P<0.001);与LPS组比较,PaH-L组肺泡炎程度明显减轻(P<0.01),PaH-M和PaH-H组肺泡结构较为完整,肺间质渗出减少,疗效与DXM相当(P<0.001)。结果显示,黄藤素对LPS诱导的炎症程度具有一定的改善作用。见Fig5,6。
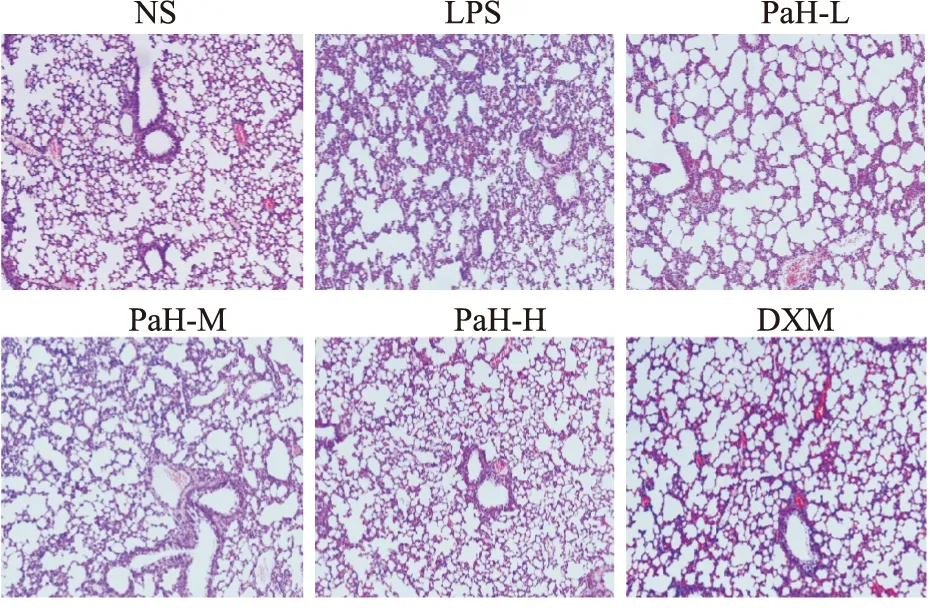
Fig 5 HE staining of lung tissues (200×)(n=6)NS-normal group,LPS-lipopolysaccharide model group,PaH-L-Low doses of palmatine hydrochloride group,PaH-M-Midle doses of palmatine hydrochloride group,PaH-H-High doses of palmatine hydrochloride group,DXM-Dexamethasone positive drug group.
2.6 NF-κB p65免疫组织化学(IHC)染色免疫组织化学染色结果显示,NF-κB p65阳性染色为细胞核呈棕褐色,因而当其被活化时,其阳性表达定位在细胞核。在本研究中,IHC染色显示,NS组肺组织NF-κB p65蛋白棕色着色浅,胞核为蓝色,未见细胞核出现棕褐色。与NS组比较,LPS组有部分胞核被染为棕褐色且染色程度较深,阳性表达明显,且肺泡结构破坏明显,肺泡塌陷,肺泡间隔增厚,炎症细胞浸润,可见肺内出现明显炎症反应,评分差异有显著性(P<0.05)。与LPS组比较,DXM组、PaH-M组和PaH-H组棕色着色较浅,细胞核染色浅且数量明显减少,评分差异有显著性(P<0.05)。结果显示黄藤素能够抑制LPS诱导ALI小鼠肺组织NF-κB p65蛋白活化。见Fig7,8。
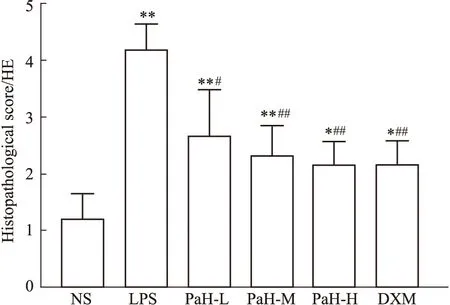
Fig 6 Histopathological score (n=6)NS-normal group,LPS-lipopolysaccharide model group,PaH-L-Low doses of palmatine hydrochloride group,PaH-M-Middle doses of palmatine hydrochloride group,PaH-H-High doses of palmatine hydrochloride group,DXM-Dexamethasone positive drug group.*P<0.05,**P<0.01 vs normal group;#P<0.05,##P<0.01 vs LPS group.
2.7 Western blot检测肺组织NF-κB p65 、Beclin1与LC-3蛋白表达Western blot结果显示,与NS组比较,LPS组NF-κB p65蛋白、Beclin1和 LC-3蛋白表达明显增加(P<0.05);与LPS组比较,PaH-H组和DXM组NF-κB p65蛋白表达明显减少(P<0.01),黄藤素中剂量组Beclin1和 LC-3蛋白表达明显增加(P<0.05);与DXM组比较,黄藤素中剂量组Beclin1和 LC-3蛋白表达增加(P<0.05)。结果显示黄藤素对LPS诱导的小鼠ALI与抑制NF-κB p65,增加Beclin1 和LC-3蛋白表达有关。见Fig9。
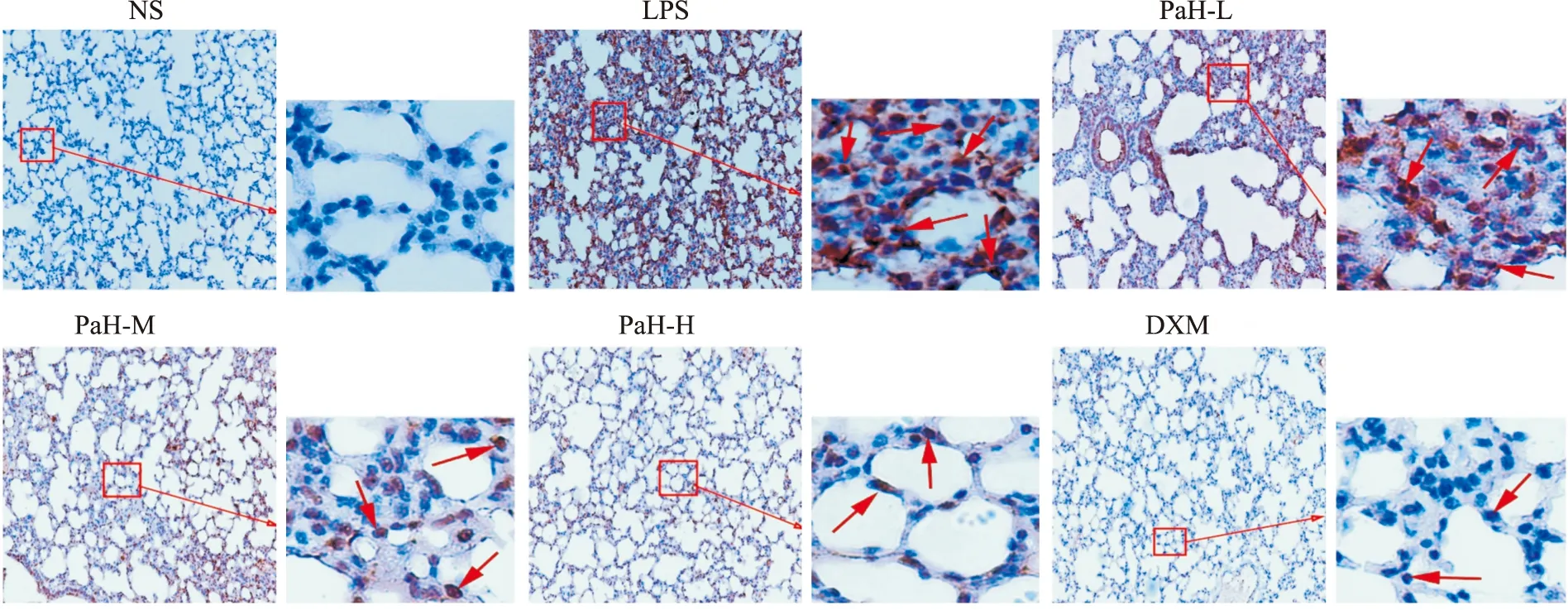
Fig 7 NF-κB p65 protein immunohistochemical staining (200×)(n=6)NS-normal group,LPS-lipopolysaccharide model group,PaH-L-Low doses of palmatine hydrochloride group,PaH-M-Midle doses of palmatine hydrochloride group,PaH-H-High doses of palmatine hydrochloride group,DXM-Dexamethasone positive drug group.
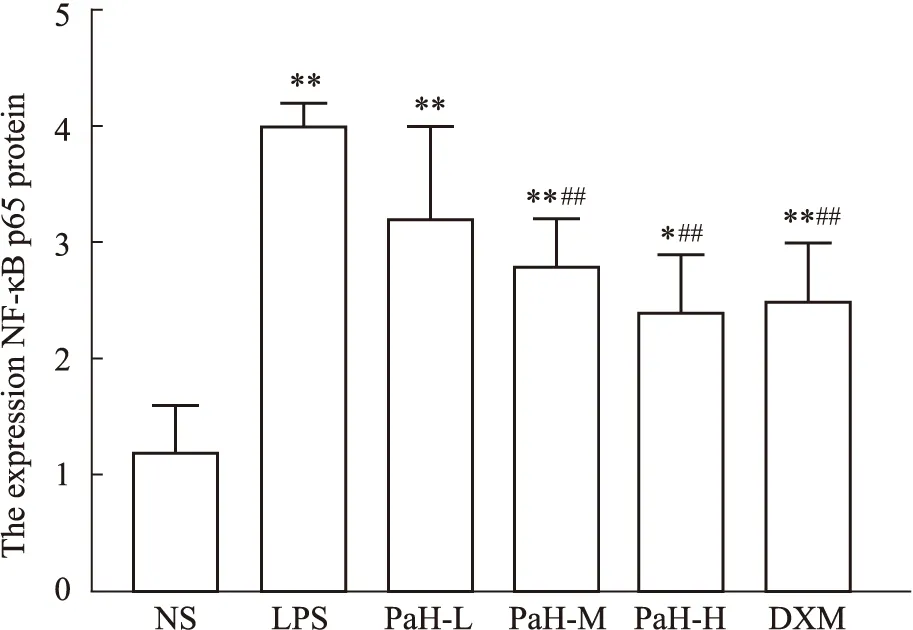
Fig 8 Immunohistochemical score (n=6)NS-normal group,LPS-lipopolysaccharide model group,PaH-L-Low doses of palmatine hydrochloride group,PaH-M-Midle doses of palmatine hydrochloride group,PaH-H-High doses of palmatine hydrochloride group,DXM-Dexamethasone positive drug group.**P<0.01,*P<0.05 vs normal group;##P<0.01 vs LPS group.
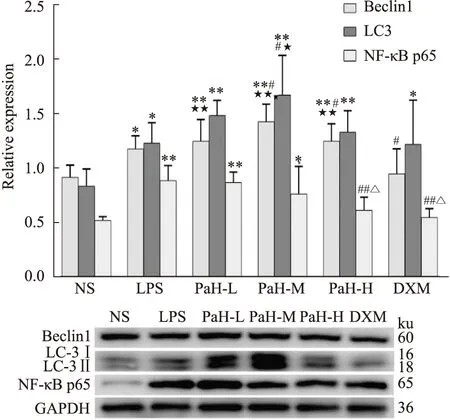
Fig 9 Expression of NF-κBp65,Beclin 1 and LC-3 protein (n=6)NS-normal group,LPS-lipopolysaccharide model group,PaH-L-Low doses of palmatine hydrochloride group,PaH-M-Midle doses of palmatine hydrochloride group,PaH-H-High doses of palmatine hydrochloride group,DXM-Dexamethasone positive drug group.*P<0.05,**P<0.01 vs normal group;#P<0.05,##P<0.01 vs LPS group;★P<0.05,★★P<0.01 vs DXM group;△P<0.05 vs PaH-L group.
3 讨论
ALI是由于肺内外的多种因素如感染、创伤、休克及手术等引起的肺毛细血管炎症损伤,通透性增加,并导致肺水肿和肺不张为病理特性的疾病,进一步发展可以形成急性呼吸窘迫综合征(ARDS)。ARDS在临床中是急性呼吸衰竭的主要因素,它的主要特点是爆发性的肺部炎症,ALI属于ARDS的早期阶段[10]。LPS是革兰阴性菌细胞壁的一种主要致病成分,LPS进入肺组织后可以诱导炎症反应,引起大量的免疫细胞聚集,分泌多种细胞因子,引起肺组织的损伤。因而治疗ALI中的炎症至关重要。本研究采用气管滴注LPS制作急性肺损伤小鼠模型,由病理结果可知模型组有大量炎症细胞浸润,部分肺泡塌陷,肺泡间隔增厚,可见模型制备成功,黄藤素预防治疗可明显减轻急性肺损伤小鼠肺组织炎症性病理改变,作用有一定剂量依赖关系。
当肺部受到致病因素刺激发生炎症反应时,引起肺泡上皮及毛细血管内皮损伤,毛细血管通透性增强,血浆中的白蛋白、中性粒细胞、血小板等渗入肺间质和肺泡腔,导致肺水肿。肺系数以及BALF中总蛋白含量和总细胞可分别反映肺水肿程度与肺泡毛细血管通透性大小。本研究显示,黄藤素能降低急性肺损伤小鼠肺系数、BALF中总蛋白含量和总细胞数来延缓疾病进程,作用有一定剂量依赖关系,黄藤素能够改善急性肺损伤时肺泡上皮和损伤和肺泡毛细血管内皮损伤,减轻炎症反应。
自噬可由多种刺激引起,例如营养缺乏和病原体感染等,在已鉴定的众多自噬相关基因中,Beclin-1在自噬途径的启动中起着关键的调节功能[11]。在自噬过程中,胞质微管相关蛋白-1轻链3(LC-3)从(LC-3Ⅰ)裂解为LC-3Ⅱ亚型,LC-3Ⅱ 聚集到成熟的自噬小体膜上被认为是自噬体形成的重要步骤[12]。自噬在脂多糖诱导的急性肺损伤中起着至关重要的作用,但其具体机制尚不清楚,自噬过程涉及许多与自噬相关的蛋白质,它们可以吞噬和杀死病原体以保护细胞免受病原体的侵害,并抑制炎症体和炎症因子的分泌[13]。研究表明,自噬促进细胞的存活或死亡取决于多种因素,如细胞类型、环境条件和特定刺激[14]。在LPS引起ALI的发病机制中,适度自噬是机体应对损伤因素的一种适应性反应,有利于维持肺微血管内皮屏障的完整性,减少肺水肿,对抗ALI,延长存活时间[15]。因此,适当增加细胞自噬可减轻ALI。本研究发现,LPS组小鼠肺组织Beclin1和LC-3的表达水平明显升高,与文献报道相符[16],黄藤素预防给药会进一步升高ALI小鼠肺组织Beclin1和LC-3的表达水平,增强自噬作用。结果表明,LPS诱导小鼠ALI过程中,机体为了应对损伤因素刺激而启动了自噬性保护机制,引起自噬水平升高,而黄藤素能够进一步增强机体的自噬性保护机制,进一步增强自噬而减轻急性肺损伤炎症反应,其具体作用机制需要进一步研究。
NF-κB是调节炎症途径的最重要的转录调节因子,激活的NF-κB可转移到细胞核并与促炎基因的启动子结合,导致基因表达增强和炎症反应扩增,最终导致组织炎症损伤。有研究发现,LPS可以激活NF-κB信号通路,促进下游炎症介质的产生[17]。ALI的本质是肺内失控性炎症反应,其炎症反应与NF-κB蛋白表达、激活以及NF-κB信号通路下游炎症细胞因子的表达水平呈正相关。有研究表明,抑制NF-κB蛋白以及相关炎症因子表达可以减轻ALI的严重程度[18]。NF-κB可被TNF-α、IL-1β等炎症因子刺激激活,激活后的NF-κB又可诱导TNF-α、IL-1β产生。本研究采用免疫组织化学染色方法,对NF-κB p65蛋白进行染色,NF-κB p65阳性染色为细胞核呈棕褐色,因而当其被活化时,其阳性表达定位在细胞核。染色结果可见,模型组和药物治疗组部分细胞核被染成棕褐色,阳性表达明显,可表明NF-κB p65蛋白被激活。黄藤素能明显抑制ALI小鼠NF-κB p65蛋白的激活并降低该蛋白表达,下调BALF中TNF-α、IL-8和IL-1β含量来减轻ALI肺部炎症反应。
综上所述,黄藤素对LPS诱导ALI小鼠具有保护作用,可能通过NF-κB信号通路和自噬通路,干预NF-κB p65、LC-3Ⅱ和Beclin1蛋白表达,通过诱导自噬来抑制炎症因子TNF-α、IL-8和IL-1β的释放从而缓解肺部炎症。本研究可为黄藤素治疗炎症性肺疾病提供一定的参考依据,为急性肺损伤的防治提供奠定一定的基础。

